
- •Міністерство освіти і науки україни
- •Коректор о.О. Чибук
- •Формули та рівняння, які використовуються при виконанні самостійної роботи
- •Обчислення теплоємності
- •Обчислення зміни ентропії при фізичних процесах:
- •Ентропія речовини при температурі т:
- •Зміна ентропії при хімічному процесі:
- •1. Термодинамічні властивості простих речовин, сполук та іонів у водних розчинах
- •2. Іони у водних розчинах
- •3. Теплота згорання деяких речовин при стандартних умовах
- •4. Величина Мn для обчислення стандартної зміни енергії Гіббса за методом Темкіна і Шварцмана
- •5. Емпіричні дані для розрахунку теплоємності
- •6. Інтегральна теплота розчинення солей у воді при 25°с
- •7. Інтегральна теплота розчинення кислот і лугів у воді при 25oС
- •8. Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при 25°с
- •9. Фізико-хімічні константи води в трьох агрегатних станах
- •Вода - рідина
- •Водяна пара (100°с, 101325 Па)
- •10. Щільність, питомий об’єм води та тиск пари при різних температурах
- •11. Кріоскопічні константи
- •12. Ебуліоскопічні константи
- •13. Питома електрична провідність розчинів кСl в інтервалі 0–30°с
- •14. Іонний добуток води в інтервалі 0 – 100оС
- •15. Співвідношення між концентрацією, активністю й середнім іонним коефіцієнтом активності електролітів різного типу
- •16. Молярна електрична провідність розведених водних розчинів електролітів при 25°с
- •17. Еквівалентна електрична провідність розчинів електролітів при 25°с
- •18. Коефіцієнти активності деяких іонів
- •19. Середні іонні коефіцієнти активності сильних електролітів у водних розчинах при 25°с
- •20. Стандартні окисно-відновні потенціали (е°) стосовно потенціалу стандартного водневого електрода при 25°с
- •21. Нормальний потенціал хінгідронного електрода (е0хін/гідр) при температурах
- •22. Склад і потенціал деяких електродів порівняння відносно нормального водневого електрода
Формули та рівняння, які використовуються при виконанні самостійної роботи
Теплота згорання органічних речовин у газоподібному стані:
![]() [кДж/моль],
[кДж/моль],
де n – число атомів кисню, необхідне для повного згорання речовини; m – число молів води, яка утворилась; X – поправка (термічна характеристика), стала для гомологічного ряду.
Обчислення теплоємності
Правило Неймана-Копа:
![]() n
n![]() n
n![]() ,
,
де n![]() та
n
та
n![]() – кількість атомів даного елемента у
сполуці;
– кількість атомів даного елемента у
сполуці;![]()
![]() – теплоємність елемента, Дж/моль·К.
– теплоємність елемента, Дж/моль·К.
Для сплавів:
![]() ,
,
де
![]() – теплоємності простих речовин;
– теплоємності простих речовин;![]() – вміст простих речовин у сплаві, мол.
частки.
– вміст простих речовин у сплаві, мол.
частки.
Правило Джонсона-Хуанга:
![]() ,
,
де
![]() – атомно-груповий множник теплоємності.
– атомно-груповий множник теплоємності.
Тверді та рідкі речовини:
![]() ,
,
де
![]() – атомна теплоємність;
– атомна теплоємність;![]() – число атомів у молекулі.
– число атомів у молекулі.
Теплота випаровування неполярної рідини при Тнтв :
![]() [Дж/(моль·К)],
[Дж/(моль·К)],
![]() [Дж/(моль·К)].
[Дж/(моль·К)].
Теплота плавлення:
прості речовини:
![]() [Дж/(моль·К)],
[Дж/(моль·К)],
неорганічні
речовини:
![]() [Дж/(моль·К)],
[Дж/(моль·К)],
органічні речовини:
![]() [Дж/(моль·К)].
[Дж/(моль·К)].
Тепловий ефект хімічної реакції:
![]() ,
,
![]() .
.
Рівняння Кірхгофа:
![]()
або
![]() ,
,
д![]() еa,
b,
c,
c`
– зміна коефіцієнтів в рівняннях
теплоємностей.
еa,
b,
c,
c`
– зміна коефіцієнтів в рівняннях
теплоємностей.
Обчислення зміни ентропії при фізичних процесах:
для n молів речовини:
– нагрівання від Т1 до Т2:
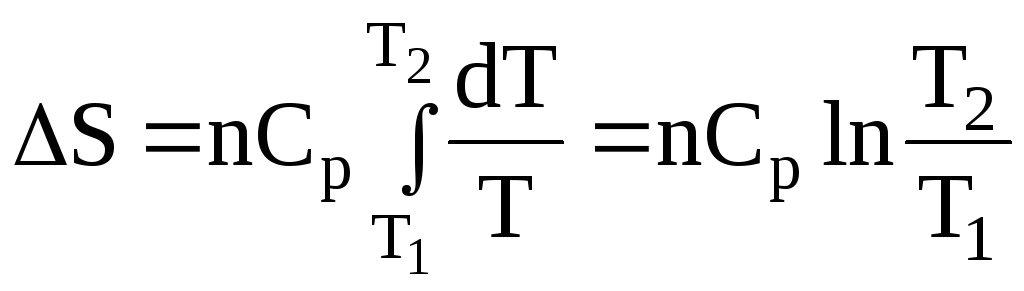 ;
;
– фазовий перехід:
![]() ;
;
– ізотермічне розширення:
![]() або
або
![]() ;
;
одночасна зміна T, P і V ідеального газу:
![]() (P = const),
(P = const),
![]() (V = const);
(V = const);
– при адіабатичному розширенні ідеального газу:
 ;
;
– дифузії двох ідеальних газів:
![]() .
.
Ентропія речовини при температурі т:
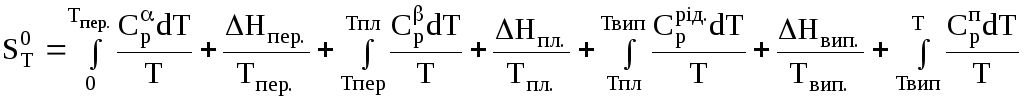 ,
,
де
![]() ,
,![]() – ізобарні теплоємності фаз α і;
Тпер. –
температура переходу речовини з α в
фазу; Нпер.
– теплота
переходу речовини з α в
фазу; Нпл,
.Нвип.
– теплоти плавлення та випаровування;
Тпл.,
Твип.
– температури плавлення та випаровування;
– ізобарні теплоємності фаз α і;
Тпер. –
температура переходу речовини з α в
фазу; Нпер.
– теплота
переходу речовини з α в
фазу; Нпл,
.Нвип.
– теплоти плавлення та випаровування;
Тпл.,
Твип.
– температури плавлення та випаровування;
![]() – ізобарні теплоємності рідини та пари.
– ізобарні теплоємності рідини та пари.
Зміна ентропії при хімічному процесі:
![]() ,
,
або
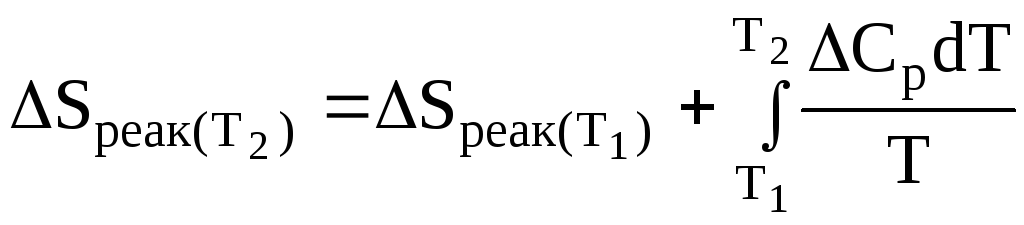 .
.
Зміна внутрішньої енергії при фазових переходах (рідина ↔ газ; тв. тіло ↔ газ):
![]() .
.
Рівняння Клапейрона-Клаузіуса:
![]() ,
,
для рівноваги:
тверде тіло
![]() газ
або рідина
газ
або рідина![]() газ:
газ:
![]() ;
;
![]() .
.
Правило фаз Гіббса:
С = К – Ф + n,
де С – варіантність системи; К – число компонентів; Ф – число співіснуючих фаз; n – число незалежних параметрів.
Залежність
підвищення температури кипіння (![]() )
розбавленого розчину від моляльної
концентрації m :
)
розбавленого розчину від моляльної
концентрації m :
– для речовин, які не дисоціюють:
![]() ;
;
– для речовин, які дисоціюють:
![]() ,
,
де T![]() ,T
– температура кипіння, відповідно,
розчинника та розчину; Ке
,T
– температура кипіння, відповідно,
розчинника та розчину; Ке![]() –
ебуліоскопічна стала (молярне підвищення
температури кипіння); і – ізотонічний
коефіцієнт.
–
ебуліоскопічна стала (молярне підвищення
температури кипіння); і – ізотонічний
коефіцієнт.
![]() ;
;
де T![]() –
нормальна температура кипіння чистого
розчинника;
–
нормальна температура кипіння чистого
розчинника;![]() – питома теплота випаровування
розчинника.
– питома теплота випаровування
розчинника.
За підвищенням температури кипіння розчину можна визначити молекулярну масу речовини:
![]() ,
,
де M![]() –
молекулярна маса розчиненої речовини;
m
–
молекулярна маса розчиненої речовини;
m![]() – маса розчиненої речовини; m
– маса розчиненої речовини; m![]() – маса розчинника.
– маса розчинника.
– для речовин, які не дисоціюють:
![]() ;
;
– для речовин, які дисоціюють:
![]() ;
;
де К![]() – кріоскопічна стала розчинника.
– кріоскопічна стала розчинника.
![]() ,
,
де T![]() – температура кристалізації чистого
розчинника;
– температура кристалізації чистого
розчинника;![]() – питома теплота кристалізації
розчинника.
– питома теплота кристалізації
розчинника.
Рівняння Арреніуса:
![]()
![]()
![]() .
.![]()
Залежність константи дисоціації від температури:
![]() ,
,
 ,
,
де
![]() – теплота дисоціації.
– теплота дисоціації.
W= -
![]() =
RT·lnK
=
RT·lnK![]() .
.
Для сильних електролітів:
Залежність середньої іонної моляльності m± від моляльності електроліту:
![]() ,
,
де
![]() – число катіонів і число аніонів;
– число катіонів і число аніонів;![]() – загальне число іонів.
– загальне число іонів.
Середній іонний коефіцієнт активності γ±:
![]() .
.
Середня іонна активність:
![]() ,
,
![]()
де
![]() – активності іонів.
– активності іонів.
![]()
Іонні моляльності:
![]() .
.
.
Перше наближення Дебая-Гюккеля:
![]() ,
,
де А – стала, для водних розчинів (Т=298 К), 0,509.
Друге наближення Дебая-Гюккеля:
![]() .
.
Рівняння Кольрауша:
![]() ,
,
![]() .
.
Числа переносу t+ або t-:

Рівняння Нернста:
![]() ,
,
де аокисл. і авідн. – активності окисненої та відновленої форм:
– для електрода
1-го роду:
![]() ,
,
– для електрода 2-го роду (наприклад Ag|AgCl, KCl):
![]() ,
,
– окисно-відновного електрода (наприклад, Pt / Fe2+; Fe3+):
![]() .
.
