|
Глава I. ПАТОГЕНЕЗ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Распространенность хронической почечной недостаточности (ХПН), по различным литературным данным, составляет от 50 до 250 человек на 1 млн населения в год. По данным Европейской Ассоциации Диализа и Трансплантации, активную терапию ХПН (гемодиализ, перитонеальный диализ, трансплантацию почки) получают в странах Западной Европы 500 - 600 пациентов, а в США и Японии 1000 - 1200 больных на млн населения в год. По усредненным данным, десятилетняя вероятность выживания пациентов с ХПН на активной терапии превышает 50%, без учета больных сахарным диабетом. Учитывая продолжительность жизни больных, длительное сохранение трудоспособности и стоимость гемодиализа, к чисто медицинским проблемам лечения пациентов с ХПН добавляются социальные. В таблице 2.1 приведены в порядке убывания заболевания, наиболее часто приводящие к ХПН. Таблица 2.1. Наиболее частые причины хронической почечной недостаточности
Следует отметить, что в последние годы все большее значение в структуре заболеваний почек, приводящих к ХПН, занимает сахарный диабет и наблюдается увеличение числа больных пожилого возраста. Классификации хронической почечной недостаточности Существует множество классификаций хронической почечной недостаточности. В данном разделе мы остановимся на основных из них. Классификация В.И. Шумакова с соавт. (табл. 2.2) построена по клиническому принципу без учета уровня азотемии и достаточно полно описывает клиническую картину ХПН, но не захватывает доазотемическиой стадии. Таблица 2.2. Классификация терминальной фазы ХПН (В.И. Шумаков, Э.Р. Левицкий, 1974 г.)
В настоящее время по Международной классификации болезней (МКБ 10) предложена классификация ХПН, приведенная в таблице 2.3. На наш взгляд эта классификация малопригодна в практической работе, поскольку не учитывает уровень азотемии и клинических проявлений уремии. Таблица 2-3. Классификация ХПН по МКБ 10
В Санкт-Петербурге уже более 25 лет используется, на наш взгляд, наиболее удачная классификация хронической почечной недостаточности, впервые предложенная С.И. Рябовым и Б.Б. Бондаренко в 1975 году и получившая дальнейшее развитие в последующие годы. Как следует из таблицы 2.4, ХПН подразделяется на три стадии, характеризующие как доазотемическое, так и последующее течение заболевания. Использование классификации ХПН позволяет также четко определять этапность и способы лечения. Если в I стадии требуется только симптоматическая терапия, направленная на профилактику и лечение обострений основного заболевания, то во II стадии следует применять низкобелковую диету с возможным присоединением энтеросорбции. Во IIБ стадии ХПН требуется решить вопрос о возможности активной терапии почечной недостаточности, а при положительном решении - выбор метода лечения и подготовку больного, т.е. формирование сосудистого доступа. Оптимальные сроки начала диализа - IIБ и IIIА ст. ХПН, поскольку прогноз пациентов, взятых на лечение в терминальной уремии, сомнителен по срокам гемодиализа, по возможности полноценной реабилитации и трансплантации почки. Следует отметить, что, по данным Б.Б. Бондаренко (1980), 50%-я вероятность выживания пациентов с хроническим гломерулонефритом во IIБ ст. ХПН составляет около 4 мес, а при ХПН IIIA ст. - около 2 мес. Становится очевидным, что у подавляющего большинства больных (60-75%) заметно удлиняются сроки жизни при начале проведения активных методов лечения всего лишь на несколько месяцев раньше, при уровне креатинина крови и скорости клубочковой фильтрации, соответствующих IIБ ст. ХПН. Однако это положение не распространяется на ряд больных с аномалией развития почек, где возможно длительное компенсирование уремии при низких значениях клубочковой фильтрации, и также на пациентов с сахарным диабетом, которым активную терапию ХПН следует начинать максимально рано. Таблица 2.4. Классификация хронической почечной недостаточности (С.И. Рябов, 1982 г.)
В какой же момент наступает и постепенно развивается токсическое действие почечной недостаточности, иначе говоря, с какого момента происходит накопление «уремических токсинов»? Это можно определить. Накопление «уремических токсинов» происходит с того момента, когда генерация последних превосходит их выведение, т.е. в тот момент, когда за временной промежуток генерации не происходит очищения всего объема распределения. Если за объем распределения, естественно, с оговорками, принять общий объем жидкости организма, а за временной промежуток - 24 часа, то путем простейших математических расчетов, применив методику вычисления диализного индекса по креатинину или методику расчета KT/V, можно вычислить величину клубочковой фильтрации, дальнейшее снижение которой позволяет ожидать появления клинических изменений, обусловленных действием «уремических токсинов». Эта величина составляет около 28 мл/мин для пациента со «стандартной» массой тела (70 кг) и площадью поверхности тела (1,73 м2), что соответствует IIА ст. ХПН. Таким образом, переход пациента во IIА ст. ХПН требует лечения, направленного, во-первых, на уменьшение генерации «уремических токсинов», во-вторых - на увеличение их элиминации и, в-третьих - на защиту пациента от их действия. При этом, естественно, не следует забывать о патогенетическом и симптоматическом лечении основного заболевания. Уменьшение генерации «уремических токсинов» возможно в основном за счет грамотного назначения диеты с умеренным ограничением белка и фосфатов, хорошим балансом жидкости, электролитов и коррекцией ацидоза. Учитывая, что пациент на этой стадии, как правило, находится в удовлетворительном состоянии, уровень азотемии невысокий, и больной субкомпенсирован по водно-электролитному балансу и КОС, методы активной терапии ХПН не применяются. Однако вполне оправданно назначение энтеросорбентов, при этом следует помнить об их неизбирательности действия и возможной сорбции медикаментов. Пациенты в этой стадии ХПН находятся в полиурии, но вполне допустимо добавление мочегонных препаратов. Защита больных от действия «уремических токсинов» сводится к симптоматической терапии, в первую очередь направленной на коррекцию гипертензии, анемии, проявлений сердечной недостаточности и т.д. Токсичность уремии Клиническая картина симптоматики почечной недостаточности, в зависимости от стадий ее развития, прекрасно описана в литературе, поэтому мы позволим себе только перечислить основные встречающиеся симптомы, которые представлены ниже. Наиболее часто встречающиеся клинические симптомы ХПН Нервная система: - недомогание - укорочение времени сосредоточенности - бессонница или сонливость - ухудшение памяти - тремор - головная боль - тягучая речь - раздражительность - ступор, кома - менингизм - полинейропатия - беспокойство ног - судороги - тики Сердечно-сосудистая система: - гипертензия - гиперлипидемия - атеросклероз - перикардит Желудочно-кишечный тракт: - тошнота и рвота - жажда - анорексия - паротит - стоматит - гастрит - язвенные поражения - снижение веса Система органов кроветворения: - анемия - кровоточивость Костная система: - остеодистрофия - задержка роста Система органов дыхания: - уремическое легкое - нефрогенный отек Мочеполовая система: - гипогонадизм - импотенция - снижении либидо Кожа: - гиперпигментация - сухость кожи Общие симптомы: - гипотермия - снижение иммунитета - уринозный запах изо рта - двигательная слабость - ацидоз - рак - «химический диабет» - снижение социальной активности На наш взгляд, более интересно разобрать вопросы состава «уремических токсинов» и их взаимосвязь с клинической картиной заболевания. Поисками универсального «уремического токсина» стали заниматься с начала 70-х годов после предложенной B. Scribner теории «среднемолекулярных уремических токсинов». Эти поиски заняли около пятнадцати лет, привели к идентификации массы веществ, встречающихся при почечной недостаточности и элиминирующих в ходе диализа. В начале 80-х годов появились работы, критикующие теорию «среднемолекулярных уремических токсинов, и к середине восьмидесятых годов устоялось мнение, что универсального «среднемолекулярного уремического токсина» не существует, а выделенные вещества связаны с глубочайшими нарушениями гомеостаза при почечной недостаточности, которая влияет на все виды обмена веществ в организме. Таким образом, к середине 80-х годов теория «среднемолекулярных уремических токсинов» прекратила свое существование, и в настоящее время она имеет только историческое значение. В последние годы вещества, встречающиеся в крови больных с почечной недостаточностью, называются «потенциальными уремическими токсинами», и в дальнейшем мы будем придерживаться этого термина. Ниже представлен перечень основных веществ, которые накапливаются в крови больных с ХПН и клинические эффекты которых более или менее изучены. Потенциальные уремические токсины, накапливающиеся у пациентов с ХПН Низкомолекулярные вещества: - мочевина - креатинин - гуанидины - фенолы - гиппураты - бензоаты - аммоний - бромин - оксалаты - мочевая кислота Среднемолекулярные вещества: - полипептиды - b2-микроглобулин - индолы - «средние молекулы» - алкалоиды - циклический АМФ - аминокислоты - миоинозитол - глюкоронаты - гликоли - лизоцим Гормоны: - паратгормон - натрийуретический фактор - глюкагон - гормон роста - гастрин - пролактин Следует отметить, что в перечне нет таких веществ, как вода, натрий, калий, фосфаты, ионы водорода и т.д. При определенных условиях задержка этих веществ может значительно ухудшить состояние пациента, и они также могут рассматриваться как «потенциальные уремические токсины». В таблице 2.5 представлены основные эффекты части потенциальных уремических токсинов. Таблица 2.5. Токсические эффекты «потенциальных уремических токсинов»
Как следует из таблицы 2.5, достаточно широкий перечень симптомов ХПН можно связать с тем или иным веществом, однако одни и те же проявления почечной недостаточности могут быть обусловлены накоплением совершенно различных субстанций. Отдельно следует рассмотреть действие гормонов при ХПН, которые также можно отнести к «потенциальным уремическим токсинам», и изменение их метаболизма имеет значение в клинике заболевания (табл. 2.6). Таблица 2.6. Гормональные нарушения при ХПН
Следует также рассмотреть механизмы гормональных нарушений при почечной недостаточности, которые связаны с изменениями синтеза, секреции, недостаточной биологической активностью, нарушениями связывания с белками плазмы или изменениями метаболизма (табл. 2.7). Таблица 2.7. Механизмы нарушения гормонального баланса при ХПН
Рассматривая эндокринные расстройства при ХПН во всем их многообразии и многофакторности действия, становится понятным появление теории «среднемолекулярных уремических токсинов», с помощью которой пытались объяснить многокомпонентность нарушений при уремии. Отдельным нарушением, также не встречающимся при других состояниях, следует считать изменение обмена микроэлементов, которые, за исключением обмена алюминия, чему посвящен самостоятельный раздел, еще малоизученны. Основные данные, касающиеся их действия, представлены в таблице 2.8. Таблица 2.8. Токсические эффекты водных контаминантов
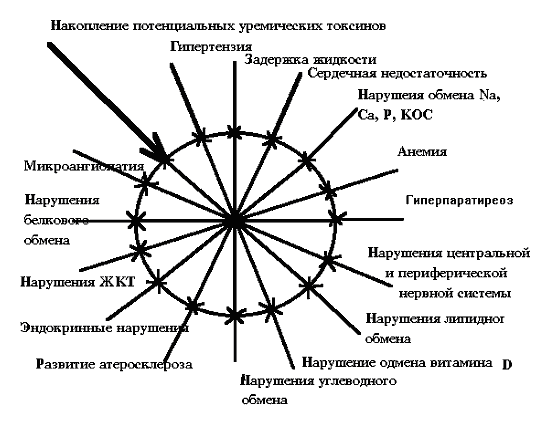
Учитывая, что вопросы костной патологии, обязательно сопровождающие длительное течение ХПН, достаточно подробно изучались, в основном отмечаются дополнительные патологические эффекты алюминия, флюоридов и стронция. Взаимосвязь патологических симптомов ХПН Для понимания патологических взаимосвязей при ХПН предлагается схема. Снижение массы действующих нефронов и накопление потенциальных уремических токсинов запускает «порочный круг» уремии (схема 2.1) Рассмотрим несколько примеров взаимосвязи внутри этого порочного круга.
Артериальная гипертензия появляется достаточно рано при паренхиматозных заболеваниях почек. Ее патогенез сложен, и развитие у больного почечной недостаточности мало что добавляет к патофизиологической картине. Ниже представлены основные факторы, усугубляющие гипертензию в условиях возникновения почечной недостаточности и затрудняющие консервативную и медикаментозную терапию этого синдрома. Взаимосвязь гипертензии с другими факторами ХПН
Задержка жидкости приводит к гипертензии, которая зависит также и от гипернатриемии и не последнее место в ее генезе имеют эндокринные нарушения. Конечным результатом только этих факторов будет сердечная недостаточность. Усугубляют положение анемия, нарушения липидного обмена, сопровождающиеся прогрессированием атеросклероза. Кардиотоксическим эффектом обладает и паратгормон, который усиливает анемию и уремическую полинейропатию. Развитие гиперпаратиреоза обусловлено нарушением обмена витамина D, гиперфосфатемией, и эти же факторы обусловливают нарушения обмена кальция. Приведенные ниже данные отражают взаимосвязь гиперпаратиреоза с другими факторами ХПН.
Анемия в той или иной степени выявляется у всех больных с почечной недостаточностью. Более того, по ее выраженности можно косвенно судить о степени азотемии. Ее генез - накопление потенциальных уремических токсинов, микроангиопатия (оккультный гемолиз, гипертензия), нарушения белкового обмена, нарушение всасывания железа и витаминов в желудочно-кишечном тракте, повышенные кровопотери в ЖКТ, гиперпаратиреоз и накопление алюминия. Анемия, кроме того, усугубляет сердечную недостаточность, которая имеет значение в задержке жидкости. Ниже приводится взаимосвязь анемии с другими факторами ХПН.
В начале развития гемодиализа уремическая полинейропатия рассматривалась как основной критерий адекватности гемодиализа, что совершенно оправданно, если рассмотреть ее взаимосвязи с остальными проявлениями уремии, что и представлено ниже.
Как результирующий фактор изменений при почечной недостаточности, следует рассматривать сердечную недостаточность. В конечном итоге, именно сердечная недостаточность и степень ее выраженности в первую очередь сказываются на социальной активности больных и продолжительности их жизни. Ниже представлены факторы влияния проявлений уремии на усугубление сердечной недостаточности.
Развитие сердечной недостаточности непосредственно связано с длительностью артериальной гипертензии, развитием атеросклероза, скорость прогрессирования которого увеличивается при ХПН нарушениями липидного обмена, и электролитным дисбалансом. Сердечная недостаточность также усугубляется анемией, токсическими действиями паратгормона и алюминия. Если суммировать все выше изложенное, можно прийти к выводу, что механизм, запускаемый уменьшением массы действующих нефронов с последующим накоплением потенциальных уремических токсинов, очень сложный, и любое клиническое проявление уремии связано с остальными симптомами если не прямо, то косвенно. Коррекция одного или нескольких проявлений не разрывает «порочного круга», а лишь выводит его на новый уровень, позволяя продлить сроки накопления фатальных изменений. Единственное, что разрывает этот «порочный круг» - своевременная трансплантация почки, но этот вид лечения, к сожалению, имеет ряд противопоказаний, и абсолютное большинство больных с ХПН лечатся гемодиализом. Сеансы гемодиализа уменьшают накопление потенциальных уремических токсинов у больных с ХПН. Это относится к проблеме адекватности гемодиализа и будет рассматриваться в отдельной главе. Сейчас мы рассмотрим только положительные и отрицательные факторы гемодиализа и действие последнего на «порочный круг» уремии. Во время сеансов гемодиализа происходит нормализация водно-электролитного баланса и КОС. При соблюдении водного баланса, т.е. при прибавке массы тела в междиализный промежуток не более 2-3 кг, соблюдении натриевого и кальциевого баланса у большинства больных можно добиться нормализации артериального давления или контроля гипертензии при подобранной гипотензивной терапии (см. ниже в главе VII). В ходе сеансов гемодиализа, с одной стороны, увеличиваются суммарные кровопотери, которые, в первую очередь, носят ятрогенный характер (остаточные кровопотери в диализаторе и лабораторные исследования). Однако при тщательной работе среднего персонала и разумном назначении исследований с использованием методики безэритроцитарного забора плазмы эти кровопотери можно свести к минимуму. С другой стороны, уменьшение угнетающего действия потенциальных уремических токсинов, назначение препаратов железа, витаминов, улучшение всасывания их в желудочно-кишечном тракте позволяют значительно уменьшить степень выраженности малокровия и зачастую, особенно с введением в клиническую практику эритропоэтина, помогает полностью контролировать анемию (см. ниже в главе IX). Хорошее качество гемодиализа практически полностью защищает больного от развития уремической полинейропатии, а появление и прогрессирование последней может служить признаком декомпенсации гиперпаратиреоза, проблема которого до настоящего времени не потеряла своего значения. Таким образом, применение гемодиализа в клинической практике лечения уремии позволило в значительной степени компенсировать отрицательное действие накопления потенциальных уремических токсинов, но полностью разорвать «порочный круг» уремии только методами внепочечного очищения крови не представляется возможным. И только успешная операция аллотрансплантации почки разрывает этот круг |
Клиническая картина и эволюция заболевания Несмотря на то, что основные лабораторные признаки острой и хронической почечной недостаточности сходны (особенно на стадии уремии), эволюция этих заболеваний имеет существенные различия.
В развитии острой почечной недостаточности различаем следующие периоды:
Период начального действия патогенного фактора – при котором создаются условия нарушающие нормальное функционирование почек. Основные клинические проявления на этом этапе связаны с основным заболеванием (кровопотеря, сепсис, травматических шок и пр.)
Период олигурии (анурии). Олигурия это состояние при котором суточное количество образования и выведения мочи снижается ниже критического уровня (ниже 500 мл за 24 часа). При анурии процесс образования мочи останавливается вообще. Длительность этого периода составляет около 2 недель и характеризуется накоплением в моче продуктов белкового метаболизма, электролитов, ферментов, гормонов и осмоактивных веществ. Развивается синдром аутоинтоксикации (уремия, азотемия). Клинические проявления на этом этапе связаны с поражением систем организма вызванных аутоинтоксикацией. Возникают резкие боли в животе, рвота, одышка, симптомы поражения нервной системы, сонливость, в некоторых случаях, при неадекватном лечении, больной может впасть в кому и умереть. Отмечается образование отеков, которые в начале заболевания располагаются на лице и конечностях, а в последствии распространяются по всему телу (анасарка). Отечная жидкость может скапливаться в полости перикарда и плевральной полости, что может вызвать нарушение работы сердца и легких.
Период восстановления диуреза – наступает спустя 2-3 недели с момента установления почечной недостаточности. В первые дни количество мочи достигает около 500 мл. В последующие дни диурез прогрессивно нарастает и наступает фаза полиурии (избыточное выведение мочи), которая обусловлена выведением большого количества осмоактивных веществ.
Период выздоровления. По мере восстановления функции почек и выведения из организма скопившихся токсических веществ, симптомы аутоинтоксикации спадают, отеки исчезают, а функции внутренних органов восстанавливаются. Период полного выздоровления больного может продлиться 12 месяцев и более.
Развитие хронической почечной недостаточности протекает медленно на протяжении многих лет. Выделяют две клинические стадии эволюции этого заболевания: консервативную и терминальную.
Консервативная стадия характеризуется медленным нарушением функции почек, которые некоторое время сохраняют способность концентрировать и выделять мочу. Симптоматика этого периода связана в основном с хроническими заболеваниями, способствующими установлению почечной недостаточности. При дальнейшем разрушении нефронов почек консервативная стадия переходит в терминальную. Для терминальной стадии характерно развитие уремического синдрома, который проявляется слабостью, головной и мышечной болью, одышкой, расстройством обоняния, вкуса, парестезиями в руках и ногах, зудом кожи, появлением отеков, тошнотой, рвотой. Кожные покровы больного с уремией покрыты тонким налетом из кристаллов мочевины, изо рта больного исходит запах аммиака и мочи. Часто на коже образуются кровоподтеки и трофические язвы. Нарушения работы мозга проявляются психическими расстройствами, раздражительностью, сонливостью или бессонницей. Как правило, развивается повышенное артериальное давление, анемия. Нарушается работа всех внутренних органов: с развитием дыхательной и сердечной недостаточности, тампонадой сердца, гастрита, колита, панкреатита и пр.
При отсутствии лечения больной, как правило, впадает в кому и умирает. Смерть может также наступить от нарушения работы сердца, легких, печени, присоединения различных инфекций.
Диагностика Диагностика почечной недостаточности основывается на данных анамнеза заболеваний почек (для хронической почечной недостаточности), клинических признаках уремии, снижении количества выделяемой мочи, данных лабораторных и инструментальных исследований. Также важное значение имеет диагностика сопутствующих нарушений функции других внутренних органов.
Уремический перикардит
Уремический перикардит отмечается примерно у половины больных в терминальной стадии хронической почечной недостаточности (очень редко - при острой почечной недостаточности). При этом картина уремии бывает развернутой и яркой, а картина перикардита, напротив,- стертой и малосимптомной. Уремический перикардит в отдельных случаях исчезает при лечении гемодиализами. Поскольку лечение гемодиализами сочетается с гепаринизацией, у этих больных могут наблюдаться экссудативные формы с развитием тампонады сердца и изредка - с исходом в констриктивный перикардит.
Острая почечная недостаточность
Ю.С. Милованов, А.Ю. Николаев Проблемная лаборатория нефрологии ММА им. И.М. Сеченова
Острая почечная недостаточность (ОПН) - острое, потенциально обратимое выпадение выделительной функции почек, проявляющееся быстронарастающей азотемией и тяжелыми водно-электролитными нарушениями.
|
Различают три формы ОПН - преренальную (гемодинамическую), обусловленную острым нарушением почечного кровообращения, ренальную (паренхиматозную), вызванную поражением почечной паренхимы, и постренальную (обструктивную), развивающуюся в результате острого нарушения оттока мочи. |
Такое
разделение ОПН имеет важное практическое
значение, так как позволяет наметить
конкретные мероприятия по предупреждению
и борьбе с ОПН.
Среди пусковых механизмов
преренальной
ОПН
- снижение сердечного выброса, острая
сосудистая недостаточность, гиповолемия
и резкое снижение объема циркулирующей
крови. Нарушение общей гемодинамики и
циркуляции и резкое обеднение почечного
кровообращения индуцируют почечную
афферентную вазоконстрикцию с
перераспределением (шунтированием)
почечного кровотока, ишемией коркового
слоя почки и снижением скорости
клубочковой фильтрации (СКФ). При
усугублении почечной ишемии преренальная
ОПН может перейти в ренальную за счет
ишемического некроза эпителия почечных
извитых канальцев.
Ренальная
ОПН
в 75% случаев вызвана острым канальцевым
некрозом (ОКН). Чаще всего это ишемический
ОКН,
осложняющий шок (кардиогенный,
гиповолемический, анафилактический,
септический), коматозные состояния,
дегидратацию. Среди других факторов,
повреждающих эпителий извитых почечных
канальцев, важное место занимают
лекарственные препараты и химические
соединения, вызывающие нефротоксический
ОКН.
В 25% случаев ренальная ОПН
обусловлена другими причинами: воспалением
в почечной паренхиме и интерстиции
(острый и быстропрогрессирующий
гломерулонефрит - ОГН и БПГН),
интерстициальный нефрит, поражением
почечных сосудов (тромбоз почечных
артерий, вен, расслаивающая аневризма
аорты, васкулиты, склеродермическая
почка, гемолитико-уремический синдром,
злокачественная гипертоническая
болезнь) и др.
Нефротоксический
ОКН
диагностируется у каждого 10-го больного
ОПН, поступившего в центр острого
гемодиализа (ГД). Среди более чем 100
известных нефротоксинов одно из первых
мест занимают лекарственные препараты,
главным образом аминогликозидные
антибиотики, применение которых в 10-15
% случаев приводит к умеренной , а в 1-2%
- к тяжелой ОПН. Из промышленных
нефротоксинов наиболее опасны соли
тяжелых металлов (ртути, меди, золота,
свинца, бария, мышьяка) и органические
растворители (гликоли, дихлорэтан,
четыреххлористый углерод).
Одна из
частых причин ренальной ОПН - миоренальный
синдром,
пигментный миоглобинурийный нефроз,
вызванный массивным рабдомиолизом.
Наряду с травматическим рабдомиолизом
(краш-синдром, судороги, чрезмерные
физические нагрузки) нередко развивается
и нетравматический рабдомиолиз вследствие
действия различных токсических и
физических факторов (отравления СО,
соединениями цинка, меди, ртути, героином,
электротравма, отморожения), вирусных
миозитов, ишемии мышц и электролитных
расстройств (хронический алкоголизм,
коматозные состояния, тяжелая гипокалиемия,
гипофосфатемия), а также длительной
лихорадки, эклампсии, пролонгированного
астматического статуса и пароксизмальной
миоглобинурии.
Среди воспалительных
заболеваний почечной паренхимы в
последнее десятилетие существенно
увеличился удельный вес лекарственного
(аллергического) острого интерстициального
нефрита в рамках геморрагической
лихорадки с почечным синдромом (ГЛПС),
а также интерстициального нефрита при
лептоспирозе. Увеличение заболеваемости
острым интерстициальным нефритом (ОИН)
объясняется растущей аллергизацией
населения и полипрагмазией.
Постренальная
ОПН
вызвана острой обструкцией (окклюзией)
мочевых путей: двусторонней обструкцией
мочеточников, обструкцией шейки мочевого
пузыря, аденомой, раком предстательной
железы, опухолью, шистосомозом мочевого
пузыря, стриктурой уретры. Среди других
причин - некротический папиллит,
ретроперитонеальный фиброз и забрюшинные
опухоли, заболевания и травмы спинного
мозга. Следует подчеркнуть, что для
развития постренальной ОПН у больного
с хроническим заболеванием почек нередко
достаточно односторонней обструкции
мочеточника. Механизм развития
постренальной ОПН связан с афферентной
почечной вазоконстрикцией, развивающейся
в ответ на резкое повышение внутриканальцевого
давления с выбросом ангиотензина II и
тромбоксана А2.
Особо
выделяют ОПН,
развивающуюся в рамках полиорганной
недостаточности,
ввиду крайней тяжести состояния и
сложности лечения. Синдром полиорганной
недостаточности проявляется сочетанием
ОПН с дыхательной, сердечной, печеночной,
эндокринной (надпочечниковой)
недостаточностью. Он встречается в
практике реаниматологов, хирургов, в
клинике внутренних болезней, осложняет
терминальные состояния у кардиологических,
пульмонологических, гастроэнтерологических,
геронтологических больных, при остром
сепсисе, при множественной травме.