
termodunRozv_39_yazki_do_testiv
.pdf
Розділ 1
Задачі рівня складності A
Яка термодинамічна система називається ізольованою?
Ізольована система – система, яка не обмінюється енергією та речовиною з іншими системами Що називається термодинамічною системою?
Термодинамічна система – сукупність тіл (чи тіло), які можуть енергетично взаємодіяти між собою і з іншими тілами, а також обмінюватися з ними речовиною
Назвіть термічні параметри стану:
Абсолютний тиск Р, абсолютна температура Т, питомий об’єм V Назвіть калоричні параметри стану:
Внутрішня енергія U, ентальпія H (I), ентропія S Фізичний зміст універсальної газової сталої:
універсальна газова стала R чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час нагрівання його на 1 К. Rµ = 8314 Дж/кмоль*К. Rµ = R*µ
Чому дорівнює питома газова стала для кисню?
Який буде абсолютний тиск газу в резервуарі, якщо надлишковий тиск 40656,5 Па а барометричний тиск 745 мм.рт.ст.
Pa = Pб + Pн = 139965 Па
Який об’єм займає 1 кг повітря за нормальних фізичних умов?
PV=mRT. V= = 0.783
Яка густина азоту за нормальних умов?
ρ = |
|
= 1.25 |
|
Обчислити питому газову сталу кисню.
При яких умовах абсолютна температура може бути від’ємною? Абсолютна температура не може бути відємною. Т ≥ 0
В балоні міститься кисень масою 2 кг при тиску 8,3 МПа і температурі 18 0С. Обчислити місткість балона.
PV=mRT. V=
Повітря масою 19,395 кг займає об’єм 15 м3. Чому дорівнює його питомий об’єм?
υ =
Визначити абсолютний тиск пари в конденсаторі, якщо покази вакуумметра 620 мм.рт.ст. при 00C, а барометричний тиск становить 97309 Па при цій же температурі.
Ра = Рб – Рв = 14663 Па
Визначити густину вуглекислого газу при тиску 101325 Па і температурі 0 0C.
ρ = Pμ/RT. R вугл газу = 296.9 |
|
μ =28 |
|
. тоді ρ = 35 |
|
|
Задачі рівня складності B
Наскільки відрізняється питома газова стала водню від питомої газової сталої кисню?
. |
|
. |
|
Два кисневих балони однакового об’єму сполучені між собою трубою. Вичисліть абсолютний тиск який встановиться в обох балонах при t = 26 î Ñ , якщо до сполучення параметри газу в першому балоні були
р1 = 5 МПа і t1 = 30 î Ñ , а в другому р2 = 8,0 МПа і t2 = 20 î Ñ
1

P=P1T/T1 = 4.93 МПа PI=P2T/T2 =8.16 МПа Pсер=(P+ PI)/2 = 6.55 МПа
Чому дорівнює молярна маса газу, якщо в посудині місткістю 1л при температурі 15 î Ñ і тиску 0,2 МПа міститься 2,07 г газу?
PV=m(Rμ/μ)T. μ = 24.782 кг/моль
273 м3 ідеального газу нагрівається при сталому тиску від 546 до 547 К. Визначити на скільки зміниться
об’єм газу. |
|
|
|
P=const. |
V1/T1 = V2/T2. |
V2 = V1* T2/ T1 = 273.5 |
V2 = 1.0018 V1 |
0,37·10-3 кг газоподібної органічної речовини при температурі 400 К і абсолютним тиском 0,0958 МПа займають об’єм 292·10-6 м3. Встановіть хімічну формулу речовини
PV = m(Rμ/μ)T. μ = mRμT/PV = 43.99 кг/моль
Резервуар місткістю 4 м3 наповнений діоксидом вуглецю (СО2). Обчислити масу газу, якщо надлишковий тиск газу в резервуарі 40 кПа, температурі 80 0С, а барометричний тиск 102,4 кПа.
m = PVμ/ RμT. P = Pн + Pб μ(СО2) = 28 m = 5.434 кг
В балоні масою 117 кг і місткістю 100 л знаходиться кисень при температурі 20 0С. Визначити тиск кисню в балоні, якщо маса порожнього балону 102 кг.
m(O2) = 15кг R = 259.8 P = mRT/V = 11418210 Па = 11.4 МПа
Обчислити масу випущеного повітря із балона, якщо місткість балона 200 л, початковий тиск в балоні 2,26 МПа, кінцевий 1,86 МПа. Початкова температура t1 = 99 оС.
T2=T1P2/P2=306.16 K. |
μпов=29 |
m = PVμ/ RμT=4.238 кг |
Визначити масу кисню в балоні об’ємом 56 л, якщо при 20 0C надлишковий тиск дорівнює 1,1 МПа, а |
||
атмосферний 740 мм.рт.ст.. |
|
|
P = Pн + Pа |
m = PVμ/ RμT= 0.882 кг |
|
При автогенному різанні металу витрачається кисень із балона місткістю 50 л. Початковий абсолютний тиск кисню 12 МПа і температура 27 0C, кінцевий абсолютний тиск 6 МПа і температура 17 0C.
Визначити витрату кисню. |
|
|
m1 = P1Vμ/ RμT1=7.698 кг |
m2 = P2Vμ/ RμT2=3.982 кг |
|
∆m=m1 - m2=3.716 кг |
або ∆a=∆m/μ=0.116 кмоль |
або ∆V=∆a*V۫μ=2.598 |
Взакритій посудині міститься повітря під тиском 750 мм.рт.ст. і температурі t1 = 20 0C. На скільки знизиться тиск в посудині, якщо його охолодити до t2 = -30 0C.
P2=P1T2/T1 = 82.814 кПа
Врезервуарі об’ємом 1 м3 міститься повітря при тиску 0,5 МПа і температурі 20 оС. Обчислити масу повітря:
PV=m(Rμ/μ)T m = PVμ/ RμT = 2.976 кг
Задачі рівня складності C
Із резервуару місткістю 0,5 м3 в якому міститься кисень при абсолютному тиску 2,5 МПа і температурі 35 0С, випущено частину газу. Тиск в балоні знизився до 15 бар, а температура до 20 0С. Скільки
випущено газу? |
|
|
|
m1 = P1Vμ/ RμT1=14.156 кг |
m2 = P2Vμ/ RμT2=8.929 кг |
|
|
∆m=m1 - m2=5.227 кг або |
∆a=∆m/μ=0.18 кмоль |
або |
∆V=∆a*V۫μ=4.032 |
Яка кількість електричних ламп може бути заповнена азотом, який міститься в балоні об’ємом 4 м3 при абсолютному тиску 1 МПа і температурі t = 15 0С, якщо в колбі повинен бути абсолютний тиск p = 900
мм.рт.ст., при t =25 0С, а об’єм колби V = 100 см3. |
|
|
m1 = P1Vμ/ RμT1=46.775 кг |
m2 = P2Vμ/ RμT2=2.257 кг |
n= m1/m2= 20.72 ламп |
2

Розділ 2
Задачі рівня складності A
Чому дорівнює масова ізохорна теплоємність повітря у випадку незалежності її від температури?
Cv=R/(k-1)= 955.63 Дж/кгК
Чому дорівнює теплоємність повітря при сталому об’ємі?
масова ізобарна теплоємність повітря Сpm=22.4C pm/ кДж/(кг К)
Середня мольна ізобарна теплоємність повітря С pm=22.4C'pm кДж/ (кмоль К)
Наскільки відрізняється теплоємність |
при сталому тиску від теплоємності при сталому об’ємі для |
|
аміаку? |
|
|
Cp = Cv + R |
R(NH3)=489 |
Cp = 489Cv |
Для яких із названих газів залежність теплоємності від температури зображується лінією 1-2.
с |
2 |
|
1
 t
t
Для двохатомних газів (Cx=C۫x+a+bT)
В якому термодинамічному процесі з участю ідеального газу теплоємність дорівнює нулю? При політропному процесі, але тільки якщо n=K
Чому дорівнює газова стала суміші з таким масовим складом qCO2 8,6%, qO2 9%, qN2 82,4% ?
µсум=1/∑(gi/µi)=29.41 R=Rµ/µ=289.7
Яке рівняння найточніше опише залежність теплоємності від температури для NH3 в інтервалі температур 0-1000 0С?
x= x+a+bT
Як зміниться показник адіабати при збільшенні атомності газу? Спаде K=1.3 для багатоатомних
Як можна обчислити масову теплоємність ідеального газу при сталому тиску нехтуючи залежністю її від температури?
Cx=δQ/mdT - масова теплоємніть
Від 5 кг газу відведено 5 кДж теплоти. На скільки змінилась температура газу, якщо його середня теплоємність 0,5 кДж/(кг К)?
Cx=δQ/mdT dT= δQ/Cxm= 2 K
Визначити питомий об’єм суміші за нормальних фізичних умов, якщо заданий її масовий склад: 7 % N2; 8 % Н2; 70 % СН4; 5 % СО; і 10 % СО2.
υ = 22.4/µ = 22.4/11.074= 2.0227
Генераторний газ має наступний масовий склад: Н2 = 7,0 %; СН4 = 2,0 %; СО = 27,6 %; СО2 = 4,8 %; N2 = 58,6 %. Визначити молекулярну масу суміші.
µсум=1/∑(gi/µi)= 14.7 кг/кмоль
Повітря має такий об’ємний склад: 20,9 % кисню, 79,1 % азоту. Обчислити густину повітря за нормальних умов.
µсум=∑(ri*µi) = 28.836 кг/кмоль |
ρ = |
|
= 1.287 |
|
Обчислити молярну масу суміші яка складається із 5 кг СО2 і 3 кг Н2О.
µсум=1/∑(gi/µi)= 28.57 кг/кмоль
Обчислити питому газову сталу суміші, яка складається із азоту з парціальним об’ємом 0,4 м3 і кисню, парціальний об’єм якого 0,2 м3.
μі /μсум=Rсум/Rі μсум=μ1r1+μ2r2+...=29.3 Rсум = 283.75
Визначити молярну масу сухого повітря, якщо відомий його об’ємний склад – 21 % O2 і 79 % N2.
μпов=μ1r1+μ2r2+...= 28.84
Чому дорівнює сума парціальних об’ємів газової суміші? Дорівнює обєму самої газової суміші (Vсум)
Перелічіть види теплоємності в залежності від температури
3

Середня і істинна Назвіть види теплоємності в залежності від термодинамічного процесу
Ізобарна Cp та ізохорна Cv
Задачі рівня складності B
У скільки разів теплоємність при сталому тиску більша за теплоємність при сталому об’ємі для кисню?
Більша на 259.8 |
(Cp = Cv + R) |
|
|
|
|
Чому дорівнює молярна маса газової суміші з таким об’ємним складом |
rCO 8,6%, |
rO 9%, rN |
82,4% |
? |
|
|
|
2 |
2 |
2 |
|
µсум=∑(ri*µi) = 29.736 кг/кмоль
До газової суміші входить 11,1 %мас. водню і 89,9 %мас. кисню. Який її об’ємний склад? µсум=1/∑(gi/µi)= 11.96 кг/кмоль ri=gi µсум/ µi r1= 66.4 % ; r2 = 33.6 %
Визначити питому газову сталу гримучого газу, який складається із 11,1 %мас. водню і 89,9 %мас. кисню:
µсум=1/∑(gi/µi)= 11.96 кг/кмоль
Визначити густину газової суміші за норм. умов з таким об’ємним складом rH2 0,597, rO2 0,403
ρ = |
|
= 0.629 |
|
µсум=∑(ri*µi) = 14.09 кг/кмоль |
|
|
Генераторний газ має наступний об’ємний склад, % об.: Н2 = 5,0; СН4 = 3,0; СО = 28,6; СО2 = 5,8; N2 = 57,6. Визначити масову частку СО:
g(CO)=µi*ri/µсум = 0.29 |
|
|
µсум=∑(ri*µi) = 27.268 кг/кмоль |
|
|
|||||||
Об’ємний |
склад сухих |
продуктів |
згоряння палива (які не вміщують водяних парів) наступний |
|||||||||
СО2=12,3%; О2=7,2%; N2=80,5%. Визначити їх густину за нормальних умов. |
|
|
|
|||||||||
ρ = |
|
|
= 1.35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Аналіз |
продуктів |
згоряння |
палива |
показав |
наступний |
їх |
об’ємний |
склад: |
||||
rCO 12,2%; |
rO 7,1%; rCO 0,4%; rN |
|
80,3% . Визначити масовий відсоток азоту. |
|
|
|||||||
2 |
|
2 |
|
|
|
2 |
|
|
|
|
|
|
g(N2)=µi*ri/µсум = 0.74
Визначити газову постійну суміші, якщо об’ємний склад суміші наступний СО2 =12 %; СО =1 %; N2 = 74 %; Н2 = 13 %.
µсум=∑(ri*µi) = 26.54 кг/кмоль
Визначити молярну частку водяної пари, якщо масовий склад суміші наступний: СО2 = 12 %; СО = 1 %;
Н2О = 6 %; О2 = 7 %; Н2 = 74 %. |
|
|
|
|
µсум=1/∑(gi/µi)= 2.642 кг/кмоль |
y1=g1µсум/ µ1= 8.807 % |
|
|
|
Аналіз продуктів згоряння палива показав наступний їх об’ємний склад: |
rCO |
11,2%; rO |
8,1%; rCO 1,4%; |
|
|
|
2 |
2 |
|
rN2 79,3% . Визначити масову частку кисню.
g(O2)=µi*ri/µсум = 0.086 = 8.6%
Визначити газову постійну суміші газів, яка складається з 1 м3 генераторного газу і 1,5 м3 повітря, взятих за нормальних умов. Густину генераторного газу ãã прийняти рівною 1,2 кг/м3.
PV = mRT R=PV/(V1 ρ1+V2 ρ2)T=301.86 Дж/кгК
В закритій посудині місткістю 0,1 м3 міститься кисень при 0 0С і тиску 760 мм.рт.ст. Визначити кількість теплоти яка потрібна для нагрівання кисню на 200 0С. Залежністю теплоємності від температури знехтувати.
Q=mR(T2-T1)/k-1 m=PV/RT=0.143 кг Q=18575.7 Дж = 18.58 кДж
Газова суміш складається із діоксиду вуглецю, азоту, кисню, маси яких відповідно такі : 2 кг, 1 кг і 0,5 кг. Обчислити густину суміші при температурі 27 0С і тиску 147 кПа.
µсум=1/∑(gi/µi)= 36.17 кг/кмоль ρ = RT/P = 0.469
До якого тиску слід стиснути суміш масою 8 кг, яка складається із 18 % СО2, 12 % О2, 70 % N2 по масі, щоб при температурі 180 0С, вона займала об’єм 4 м3.
4

P=mRT/V = 247374.24 Па = 0.247 МПа
µсум=1/∑(gi/µi)= 30.45 кг/кмоль
Задачі рівня складності C
Суміш містить 2,0 кг кисню і 8,0 кг водню. Чому дорівнює об’ємний склад суміші? µсум=1/∑(gi/µi)= 2.46 кг/кмоль ri=gi µсум/ µi r1= 1.6 % ; r2 = 98.4 %
Знайти масу газової суміші, яка міститься кулястому газгольдері діаметром 5 м, якщо надлишковий тиск рн = 0,1 МПа, а барометричний тиск рб = 750 мм.рт.ст., темпе-ратура навколишнього середовища 20 0С. Склад газової суміші в %об.
rH |
2 |
57%, rCH |
23%, |
rCO 6%, |
rCO 2%, |
rN |
12% . |
|
|
|
|
4 |
|
2 |
|
2 |
|
|
|
|
|
m=PV/RT= 576.78 кг |
|
|
V=4ПRRR/3=65.42 |
µ=10.74 |
R=774.115 |
||
Гасова лампа спалює за годину 0,3 кг гасу, при цьому витрачається 5 кг повітря. Питома газова стала
продуктів згорання, які утворюються при згорянні гасу 287 Äæ |
êã Ê . Температура продуктів згоряння |
|
380 0C. Визначити об’єм продуктів згорання, які утворюються в лампі за годину, якщо барометричний |
||
тиск 101328 Па. |
|
|
V=mRT/P= 9.8 м3 |
m=m1+m2=5.3 |
|
Визначити газову постійну суміші, яка складається із 20 масових часток повітря і 1 масової частки |
||
світильного газу. Густина світильного газу при 0 0C і 101325 Па дорівнює 0,52 кг/м3. |
||
R2=P/ ρT=713.76 |
µ2=R µ/R=11.648 µ1=29 |
µсум=1/∑(gi/µi)= 27.108 кг/кмоль |
Rзаг = 306.699 Äæ |
êã Ê |
|
5
Розділ 3
Задачі рівня складності A
T
1 |
2 |
4 |
3 |
Що означає площа фігури зображеної на рисунку? 

 S Діаграма ізотермічного процесу (T=const)
S Діаграма ізотермічного процесу (T=const)
Що називається теплотою?
Теплота процесу – енергія, що передається від одного тіла до іншого при їх взаємодії, яка залежить тільки від температури цих тіл і не зв’язана з переносом речовини від одного тіла до іншого та з виконанням роботи
Що називається роботою?
Робота процесу – енергія, що передається від одного тіла до іншого при їх взаємодії, яка не залежить від температури цих тіл і не зв’язана з переносом речовини від одного тіла до іншого.
Що таке внутрішня енергія?
Енергія внутрішня - функція стану термодинамічної системи, зміна якої не залежить від термодинамічного шляху процесу, а визначається початковим і кінцевим станом термодинамічної системи.
Якого значення може набувати показник адіабати для 3-х атомного газу? |
|
|||
k=1,3 |
|
|
|
|
За якою формулою знаходиться зміна питомої внутрішньої енергії? |
|
|||
∆u=Cv(T2 - T1) |
( ∆U=mCv(T2 - T1) = (mR/K – 1) (T2 – T1) ) |
|
||
Що таке ентальпія? |
|
|
|
|
Ентальпія – це повна енергія розширеної термодинамічної системи |
H=U+PV |
|||
Суть першого закону термодинаміки: |
|
|
|
|
Суть полягає в тому, що в ізольованій термодинамічній системі енергія не зникає безслідно і не |
||||
виникає знову, вона лише переходить із одного виду в інший |
|
|||
Що означає площа під кривою процесу в P – V координатах? |
|
|||
Кількість теплоти q |
|
|
|
|
Наведіть розрахунковий вираз для зміни питомої внутрішньої енергії: |
|
|||
∆u=Cv(T2 - T1)= (R/K – 1) (T2 – T1) |
|
|
|
|
Наведіть розрахунковий вираз для зміни питомої ентальпії: |
|
|||
∆h=Cp(T2 - T1) = (KR/K-1)(T2 – T1) |
|
|
|
|
Що означає площа під кривою процесу в T – S координатах? |
|
|||
Робоа ℓ |
|
|
|
|
Наведіть розрахунковий вираз для обчислення зміни ентропії: |
|
|||
∆s=Cvln(T2/T1)+Rln(υ2/ υ1) |
або |
∆s=Cpln(T2/T1)+Rln(p2/ p1) |
||
Задачі рівня складності B
Запишіть перший закон термодинаміки для ізотермічного процесу з участю ідеального газу в інтегральній формі:
δq = pdυ; q1-1=∫
Обчислити зміну внутрішньої енергії при нагріванні 5кг кисню в ізобарному процесі від 20 0С до 60 0С
∆U=mCv(T2 - T1) = (mR/K – 1) (T2 – T1)=129900 Дж= 129.9 кДж
Обчислити зміну ентальпії в ізобарному процесі 4кг азоту, якщо початкова температура газу 25 0С, кінцева температура 80 0С.
∆H=mCp(T2 - T1) = (mKR/K – 1) (T2 – T1) = 228613 Дж = 228.6 кДж
Запишіть рівняння І–го закону термодинаміки в диференційній формі для процесу, в якому теплоємність рівна нулю.
δq = du + pdυ; δq = dh – υdp; |
δl+du=0 |
|
Запишіть рівняння |
першого закону термодинаміки через ентальпію в інтегральній формі для |
|
політропного процесу в якому n = 0. |
|
|
δq = dh – υdp |
якщо n=o то pυ0=p=const; Cn=Cp |
|
|
|
6 |
Що таке ентропія?
Ентропія – це калоричний параметр стану диференціал якого дорівнює відношенню елементарної кількості теплоти яку приймає тіло в процесі до температури при якій здійснюється цей процес.
dS= δq/T
Дайте визначення ентропії.
Ентропія – це калоричний параметр стану диференціал якого дорівнює відношенню елементарної кількості теплоти яку приймає тіло в процесі до температури при якій здійснюється цей процес.
dS= δq/T
Записати формулу для визначення зміни питомої внутрішньої енергії в політропному процесі. ∆u=Cv(T2 - T1) = (R/K – 1) (T2 – T1)
Обчислити зміну внутрішньої енергії 2 кг азоту в політропному процесі з показником політропи n = 1.
Якщо n=1, то T=const, тоді ∆U=mCv= mR/K – 1= 1484,6 Дж
При стискуванні 3 кг метану (С4Н4) затрачена робота 800 кДж, при цьому внутрішня енергія збільшилась на 595 кДж. Визначити на скільки збільшилась температура газу. Теплоємність метану вважати незалежною від температури.
L=mR ΔT
При розпаді 1 кг урану в реакторі атомної електростанції кількість теплоти, яка виділяється 22,9·106 кВт·год. Визначити яку кількість кам’яного вугілля з теплотою згорання 29300 кДж/кг потрібно для отримання такої ж кількості теплоти.
Q = 22.9*106*3600/29300 = 2.814
Задачі рівня складності C
Обчислити зміну ентропії 1 кг кисню в процесі, в якому виконується співвідношення між температурою
|
|
T2 |
|
|
1 |
k 1 |
при збільшенні температури від 10 î Ñ до 30 î Ñ |
|
|
і об’ємом |
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
T1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
=1.186 |
∆S=m(Cvln(T2/T1)+Rln(V2/ V1))= m(((RlnT2/T1)/K-1)+Rln( |
) = |
|||
|
|
||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.251 Дж/кгК
7
Розділ 4
До якої температури слід нагріти газ при сталому об’ємі, щоб його тиск зріс в два рази, якщо початкова температура t1 = 15 0С?
p1/p2=T1/T2; p2=2*p1; T1=t1+273=15+273=288(K); T2=2*T1=2*288=576(K)або=303(C)
При ізотермічному розширенні 1 кг діоксиду вуглецю до трьохкратного збільшення об’єму виконується робота 100 кДж. Визначити температуру діоксиду вуглецю в процесі.
L=m*R*T*ln(V2/V1); V2=3*V1; R=8314/44=188,9; T=L/(m*R*ln(V2/V1))= 100000/(1*188,9*ln(3*V1/V1))=481,9(K)=208,9(C)
1 кг повітря з початковою температурою T1 = 293 К і тиском p1 = 6 бар розширюється адіабатно до p2 = 0,1 МПа. Визначити роботу процесу.
p1=6 бар=6*0,1 МПа=0,6 МПа;
L=( m*R*T1/(k-1) )*[1-(p2/p1)^( (k-1)/k )] = ( 1*286,7*293/(1,4-1) )*[1-(0,1/0,6)^( (1,4-1)/1,4 )] =
84142,3.
Яку кількість тепла треба підвести до 1 кг повітря з температурою t1 = 15 0С, щоб його об’єм при сталій температурі зріс в два рази?
R=8314/29=286,7; T=t1+273=15+273=288(K); v2=2*v1; q=R*T*ln(v2/v1)=286,7*288*ln(2)= 286,7*288*0,69= 56973(Дж/кг);
Впроцесі згоряння палива при сталому тиску в циліндрі ДВЗ температура 1 кг газоподібних продуктів згоряння зростає від 50 0С до 1500 0С. Чому дорівнює робота розширення, при умові що продукти згоряння носять фізичні властивості повітря?
L=m*R*(T2-T1); R=8314/29=286,7; L=m*R*(T2-T1)=1*286,7*(1773-323)= 415715.
1 кг повітря з початковою температурою t1 = 20 0С і абсолютним тиском p1 = 0,6 МПа розширюється адіабатно до p2 = 1 бар. Визначити зміну внутрішньої енергії в процесі.
T1=t1+273=293(K); p2=0,1(МПа); T1/T2=(p1/p2)^( (k-1)/k ); T2=T1/( (p1/p2)^( (k-1)/k ) )=175,6(K)
del’taU=( m*R/(k-1) )*(T2-T1)=( 1*286,7/(1,4-1) )*(175,6-293)= -84146,45.
При адіабатному розширенні температури повітря зменшується від t1 = 20 0С до t2 = -20 0С. Визначити початковий абсолютний тиск повітря р1, якщо в кінці процесу абсолютний тиск складає 0,1 МПа.
T1/T2=(p1/p2)^( (k-1)/k ); k=1,4(для повітря); p1=p2*(T1/T2)^( k/(k-1) )=0,1*(293/253)^( 1,4/(1,4- 1) )=0,167.
Вадіабатному процесі температура повітря зменшується від t1 = 20 0С до t2 = -20 0С. Визначити тиск в кінці процесу, якщо початковий тиск p1 = 1,67 бар.
T1/T2=(p1/p2)^( (k-1)/k ); k=1,4(для повітря); p1=0,167(МПа);
p2=p1/( (T1/T2)^( k/(k-1) ) )=0,167/( (293/253)^( 1,4/(1,4-1) ) )=0,099.
При адіабатному стискуванні температура повітря зростає від 15 0С до 160 0С. Визначити кінцевий абсолютний тиск, якщо початковий складає 0,1 МПа.
T1/T2=(p1/p2)^( (k-1)/k ); k=1,4(для повітря); p2=p1/( (T1/T2)^( k/(k-1) ) )=0,1/( (288/433)^(
1,4/(1,4-1) ) )=0,42.
1 кг повітря ізохорно нагрівається від t1 = 10 0С до t2 = 100 0С. Визначити зміну ентропії в процесі враховуючи, що теплоємність повітря не залежить від температури.
T1=t1+273=10+273=283; T2=t2+273=100+273=373; k=1,4(для повітря); del’taS=m*Cv*ln(T2/T1)=(m*R/(k-1) )*ln(T2/T1)=(1*286,7/(1,4-1) )*ln(373/283)=197,92.
Знайти показник політропи для азоту в процесі, для якого при збільшенні об’єму у 10 раз абсолютний тиск зменшується у 8 раз.
n=ln(p1/p2)/ln(v2/v1)=ln(10*p2/p2)/ln(10*v1/v1)=1.
При адіабатному розширенні температура повітря зменшилась від t1 = 20 0C до t2 = - 20 0C. Визначити початковий абсолютний тиск повітря p1, якщо в кінці процесу абсолютний тиск знижується до 0,1 МПа.
T1/T2=(p1/p2)^( (k-1)/k ); T1=303(K); T2=253(K); k=1,4(для повітря);
p1=p2*(T1/T2)^( k/(k-1) )=0,1*(303/253)^( 1,4/(1,4-1) )=0,188.
0,5 м3 кисню при тиску р1 = 1 МПа і температурі t1 = 30 0С стискується ізотермічно до об’єму в 5 раз менше початкового. Визначити роботу стиску.
V2=(1/5)*V1=(1/5)*0,5=0,1; L=p1*V1*ln(V2/V1)=1000000*0,5*ln(0,1/0,5)= -804719.
0,1 м3 повітря при тиску р1 = 2 МПа і температурі t1 = 20 0С розширюється ізотермічно в циліндрі з рухомим поршнем до тиску 0,1 МПа. Визначити кінцевий об’єм газу.
8
p1/p2=v2/v1; v2=p1*v1/p2=2*0,1/0,1=2.
1 кг діоксиду сірки (SO2) при температурі t1 = 30 0C і початковому тиску р1 = 0,1 МПа стискується ізотермічно до кінцевого тиску р2 = 1 МПа. Визначити кількість теплоти, відведеної від газу.
Q=m*R*T*ln(p1/p2); T=t1+273= 30+273=303(K); R=8314/48=173,2; Q=m*R*T*ln(p1/p2)=1*173,2*303*ln(0,1/1)= -120838,7;
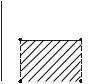
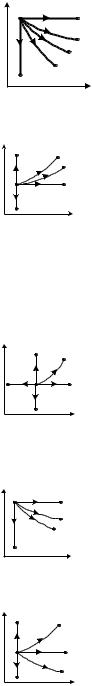
На рисунку зображено основні термодинамічні процеси і політропний процес з показником n = 2,5. Назвіть лінію цього процесу.
p |
a |
1 |
|
||
|
|
|
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
лінія 4 Яка із показаних ліній зображає адіабатне розширення?
T |
1 |
4 |
|
||
|
|
5 |
|
a |
3 |
|
|
2 |
s
Адіабатне розширення – лінія 2.
Вкажіть рівняння зв’язку між змінними параметрами в політропному процесі, в якому теплоємність рівна нулю.
T1/T2=(v2/v1)^(k-1); v2/v1=(p1/p2)^(1/k); T1/T2=(p1/p2)^( (k-1)/k );
Вкажіть в тепловій діаграмі політропу відведення теплоти в процесі з теплоємністю рівною нескінченості.
T |
3 |
|
|
|
5 |
2 |
a |
|
4 |
|
1 |
s
Лінія 2.
На рисунку зображені основні термодинамічні процеси ідеальних газів. Назвіть лінію процесу, в якому робота виконується тільки за рахунок втрати внутрішньої енергії.
p |
a |
1 |
|
||
|
|
|
|
|
2 |
|
|
3 |
|
|
4 |
|
|
|
Вроді лінія 3, але не впевнений.
Вкажіть в тепловій діаграмі ізобару стиснення робочого тіла.
T |
1 |
2 |
|
||
|
a |
3 |
|
5 |
4 |
|
|
s
Лінія 2.
Азот масою 0,5 кг розширюється при сталому тиску таким чином, що його температура зростає від 100 0C до 300 0C. Обчислити роботу зміни об’єму.
L=m*R*(T2-T1); R=8314/28=296,9; L=0,5*296,9*(573-373)= 29690.
1 кг діоксиду вуглецю стискується ізотермічно при температурі 20 0C до десятикратного зменшення об’єму. Визначити роботу стиску газу.
L=m*R*T*ln(V2/V1); V1=10*V2; R=8314/44=188,9; T=t+273= 20+273=293(K); L=1*188,9*293*ln(V2/10*V2)= -127442,8.
При ізотермічному розширенні 1 кг діоксиду вуглецю до трьохкратного збільшення об’єму виконується робота 100 кДж. Знайдіть температуру процесу.
9
L=m*R*T*ln(V2/V1); V2=3*V1; R=8314/44=188,9;
T=L/( m*R*ln(V2/V1))=100000/( 1*188,9*ln(3*V1/V1))=481,9(K)=208,9(C)
Повітря при початковому тиску 0,5 МПа адіабатно розширюється до тиску 0,15 МПа. У скільки раз повинен при цьому зрости об’єм?
k=1,4(для повітря); v2/v1=(p1/p2)^(1/k)= (0,5/0,15)^(1/1,4)=2,36.
Газова суміш (k = 1,38) з тиском 90 кПа адіабатно стискується до об’єму в 5 раз меншого ніж початковий. Обчислити кінцевий тиск.
Адіабатний процес: v2/v1=(p1/p2)^(1/k); p2=p1/( (v2/v1) )^k=90/( (1/5) )^1,38=829,509(кПа).
Повітря з початковим абсолютним тиском 0,1 МПа і температурою 15 0С адіабатно стискується до кінцевого абсолютного тиску 0,8 МПа. Визначити кінцеву абсолютну температуру.
T1/T2=(p1/p2)^(1/k); k=1,3(для повітря); T1=t1+273= 15+273=288(K); T2=T1/( (p1/p2)^(1/k) )=288/( (0,1/0,8)^(1/1,3) )=1425,86(K)=1152,86(C).
Чому дорівнює робота зміни об’єму в процесі, в якому збільшення абсолютної температури в два рази призвело до зростання абсолютного тиску в стільки ж разів?
робота L=0.
Уполітропному процесі з показником політропи n = 1 підведено 100 кДж теплоти, чому дорівнює виконана робота.
n=1: ізотермічний процес, тоді
L=Q=100 (кДж).
Уполітропному процесі при підведенні 100 кДж теплоти була виконана робота 100 кДж. Чому дорівнює показник політропи процесу?
Q=L: ізотермічний процес, тоді показник адіабати n=1.
Чому дорівнює масова теплоємність в політропному процесі з показником політропи n = 1. n=1 – це ізотермічний процес, тоді: Cm=+/-нескінченості.
Вкажіть розрахункову формулу для обчислення питомої теплоти в ізотермічному процесі. q=R*T*ln(v2/v1)= R*T*ln(p1/p2)=p1*v1* ln(p1/p2)=p1*v1* ln(v2/v1)= p2*v2* ln(v2/v1).
Вкажіть розрахункову формулу для обчислення теплоти в адіабатному процесі.
Q=0.
Яка лінія в координатах T-S зображає адіабатний процес?
T |
|
|
|
|
1 |
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
4 |
|
|
a |
5 |
|
|
|
|
0 |
|
|
S |
|
|
|
Адіабатний процес – лінія 1.
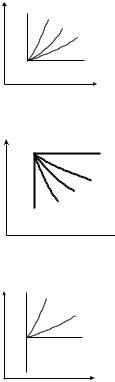
Яка лінія зображає в координатах P-V процес з показником політропи n = 0?
P |
|
a |
|
|
1 |
|
2 |
|
3 |
5 |
4 |
|
0 |
V |
|
Лінія 1.
Яка лінія зображає в координатах T–S процес з показником політропи n = 1?
T |
1 |
2 |
|
|
|
|
|
3 |
|
a |
4 |
|
|
5 |
0 |
|
S |
|
|
|
|
|
Лінія 4. |
Як називається процес, в якому збільшення абсолютного тиску в два рази супроводжується зменшенням об’єму в стільки ж разів?
Це ізотермічний процес.
10
