
Doslidjenya
.pdfM Mi xi , |
(2.18) |
|
де M i |
- молекулярна маса i -го компонента; |
|
xi |
- об'ємний вміст i -го компонента в частках одиниці. |
|
Молекулярна маса природних газів становить16 20.
Відносна густина природного газу (за повітрям) – це відношення густини газу г до густини повітря пов. , взятих
при однакових температурі і тиску. Густина повітря пов. при
стандартних умовах становить 1,293 кг/м3, молекулярна маса 29. З ростом температури густина газу зменшується, а з підвищенням молекулярної маси і тиску - зростає.
Теплота згоряння газу вимірюється кількістю тепла (кДж), що виділяється при спалюванні 1 м3 або 1 кг газу. Вища теплота згоряння відповідає сухому газу (без парів води), нижчавологому(зпарамиводи). ТеплотазгорянняВГзростає зі збільшенням молекулярної маси. Середня теплота згоряння для природних газів дорівнює 35160 кДж/м3.
В'язкість газу г - це сила внутрішнього тертя, що
виникає між двома шарами газу, що переміщаються паралельно відносно один одного з різними за величиною швидкостями. В'язкість вуглеводневих газів є незначна.
В'язкість сухого газу при t = 0 С становить 13 10 6 Па с,
повітря 17 10-6 Па с.
Зі збільшенням температури при низьких тисках в'язкість газів і повітря збільшується; при значеннях тиску до 4 МПа в'язкість газів мало залежить від тисків, при більш високих тисках - підвищується (див. табл. 2.2, 2.3, рис.2.1).
Таблиця 2.2 - Динамічна в’язкість метану
Тиск, |
|
|
|
Температура, ºС |
|
|
||
МПа |
|
|
|
|
|
|
|
|
-15 |
0 |
18 |
|
25 |
50 |
75 |
100 |
|
33
0,1 |
99,5 |
105 |
110 |
113 |
120 |
128 |
136 |
1 |
101 |
106 |
111 |
114 |
122 |
129 |
137 |
2 |
103 |
108 |
113 |
116 |
123 |
130 |
138 |
4 |
109 |
114 |
117 |
120 |
127 |
134 |
140 |
6 |
117 |
120 |
123 |
126 |
132 |
138 |
144 |
8 |
127 |
129 |
131 |
133 |
138 |
142 |
148 |
Таблиця 2.3 - Динамічна в’язкість газів при тиску 0,101 МПа
|
|
|
|
|
|
|
Газ |
|
Температура, ºС |
|
|||
|
|
|
|
|
|
|
|
0 |
20 |
25 |
50 |
75 |
100 |
Етан |
87,1 |
93,3 |
94,7 |
104,0 |
109,0 |
117,0 |
|
|
|
|
|
|
|
Пропан |
76,4 |
81,5 |
82,7 |
89,5 |
96,0 |
102,0 |
|
|
|
|
|
|
|
n - Бутан |
69,5 |
74,9 |
76,3 |
83,0 |
89,8 |
96,5 |
|
|
|
|
|
|
|
Ізобутан |
70,2 |
75,8 |
77,3 |
83,7 |
90,3 |
96,5 |
n - Пентан |
63,5 |
68,1 |
69,3 |
75,1 |
81,1 |
86,6 |
Ізопентан |
65,0 |
69,8 |
70,9 |
76,6 |
72,0 |
87,7 |
Азот |
170,0 |
180,0 |
181,0 |
192,0 |
202,0 |
213,0 |
|
|
|
|
|
|
|
Вуглекислий газ |
139,0 |
149,0 |
151,0 |
164,0 |
175,0 |
186,0 |
|
|
|
|
|
|
|
Сірководень |
120,0 |
129,0 |
131,0 |
142,0 |
153,0 |
164,0 |
|
|
|
|
|
|
|
34
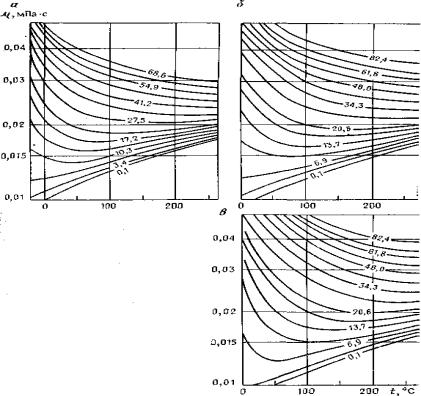
Рисунок 2.1 - Залежність в'язкості природних газів від
температури t і тиску Р при відносній густині 0,6 - (а), 0,8 - (б), 1,0 - (в)
В'язкістьвуглеводневихгазівприоднаковихумовахєменшою, ніж невуглеводневих. Значення в'язкості невуглеводневих природних газів можна знайти за графіком (див.рис.2.2).
35
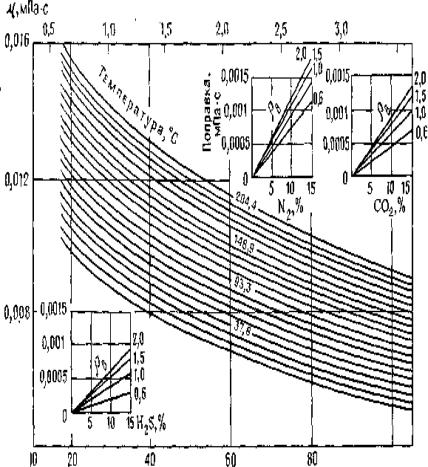
Рисунок 2.2 - Номограма для визначення в'язкості невуглеводневих газів г при тиску 0,1 МПа (по Д. Л.
Катцу, Д. Корнеллу, Р. Кобаяшину й ін.)
Аналітичну залежність між параметрами (об’ємом, тиском і температурою) газу, яка описує стан газу, називають рівнянням стану (ідеального або реального) газу. Ідеальним
36
називається газ, у якому відсутні сили міжмолекулярної взаємодії.
Рівняння стану ідеального газу (Клапейрона-Менделєєва)
має вигляд РVi NRT , де Р - тиск; Vi - об’єм ідеального газу;
N - число кіломолей газу; R - універсальна газова постійна, рівна 8,32 Дж / (моль · К); T - абсолютна температура, К.
Рівняння Клапейрона-Мендєлєєва для реальних газів записується у вигляді
РV zNRT , |
(2.19) |
де z - коефіцієнт стиснення, що є функцією тиску, температури, складу газу і який характеризує ступінь відхилення реального газу від ідеального. Для ідеальних газів z 1 .
Коефіцієнтстисненняреальнихгазівпоказуєвідношення об’ємів рівного числа молів реального Vp і ідеального Vi газів
при однакових тиску і температурі: z Vp /Vi .
Коефіцієнт z визначає величину відношення об’ємів реального газу при пластових Vпл і стандартних Vст умовах.
При цьому він безпосередньо залежить від величини пластового тиску Рпл , Па, і температури, К : z = 0,00289 ( Рпл
/Тпл ) (Vпл /Vст ).
Коефіцієнт стиснення більш точніше визначають експериментальним шляхом по пластових пробах газу або наближено розраховують по кривих Брауна (рис.2.3).
37
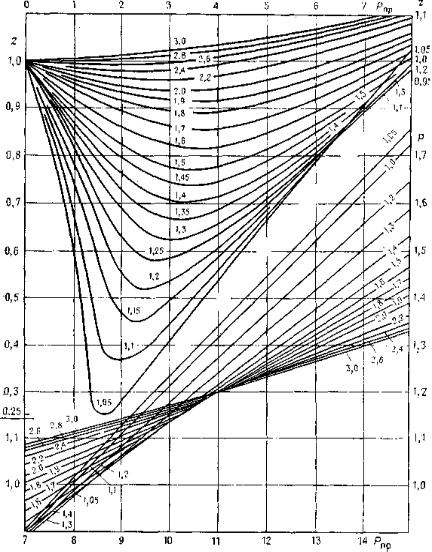
Рисунок 2.3 - Залежність коефіцієнта стиснення z вуглеводневого газу від приведених псевдокритичних тиску
Pпр і температури Tпр (по Р. Брауну)
38
По вищеприведеному графіку коефіцієнт z знаходять у залежності від приведених значень псевдокритичних тиску і температури.
Приведені тиски Pпр і температуру Tпр виражають в частках від критичних тиску Ркр і температури Tкр і для однокомпонентного газу визначають з рівнянь:
Pпр Р/ Ркр , |
Tпр T / Tкр , |
(2.20) |
де Р і T - конкретні тиски і температура, для яких визначається z .
Критичнатемпература Tкр - цетакатемпература, вище
якої газ не може переходити в рідкий стан, яким би великим не був тиск. Тиск, що відповідає точці критичної температури, називається критичним тиском, інакше кажучи, це граничний тиск, нижче якого, якою б низькою не була температура, газ не переходить в рідкий стан.
Для вуглеводневих газів, що представляють собою суміш окремих компонентів, величини Ркр і Tкр визначають як
середнє арифметичне їхніх значень для кожного компонента. Ці середні значення називають псевдокритичним тиском Рпкр
і температурою Tпкр .
Приведені тиск і температуру суміші вуглеводневих газів визначають з рівнянь:
Pпр Р/ Рпкр Р/ Ркр.і xі , |
(2.21) |
Tпр T / Tпкр T / Tкр.і xі |
(2.22) |
де Ркр.і і Tкр.і - відповідно критичні тиск і температура і-го
39
компонента;
xі - частка і гокомпонентавоб’ємісуміші(часткиодиниці).
Приведені температуру і тиск для сумішей газів часто називають псевдоприведеними.
Якщо відомий об’єм газу V0 при нормальних умовах ( Р0 і T0 ), тоді об’єм його при інших тисках і температурах ( Р і T
) зурахуванням стиснення можнарозрахувати на основізакону Гей-Люсака:
V V0 z |
T |
|
|
Р0 |
, |
(2.23) |
T0 |
|
Р |
||||
|
|
|
|
|
||
де T0 273 К; Р0 |
|
0,103 МПа. |
|
|||
Для переходу від об’єму, займаного газом у нормальних умовах, до об’єму, займаному ним у пластових умовах,
користуються об'ємним коефіцієнтом пластового газу,
чисельно рівним об’єму, що зайняв би 1 м3 газу в пластових
умовах Vпл.г : |
|
|
|
|
|
|
bг |
Vпл.г /V0 , |
|
|
|
(2.24) |
|
bг |
z Tпл |
Р0 |
0,000378 z |
Tпл |
, |
(2.25) |
Р |
|
|||||
|
T0 |
|
Рпл |
|
||
де Рпл і Tпл - відповідно пластові тиск і температура.
Об'ємнийкоефіцієнтгазузавждизначноменшийодиниці, тому що об’єм газу в пластових умовах на два порядки (приблизно в 100 разів) менший, ніж у стандартних умовах.
Закон Гей-Люсака стверджує, що об’єм деякої кількості газу при постійному тиску змінюється прямо-пропорційно
40
зміні абсолютної температури:
V2 /V1 T2 /T1 ; |
V2 (V 1T2 ) /T1 . |
(2.26) |
Іншими словами - усі гази при постійному тиску розширюються однаково на ту саму величину, яку називають коефіцієнтом розширення газу при підвищенні температури на
1 °С:
V1 V0 (1 at) V0 (1 t / 273) , |
(2.27) |
де V1 - об’єм газу при температурі t ; V0 - об’єм газу при температурі 0 °С;
a - коефіцієнт розширення. Дослідним шляхом установлено, що a 1/ 273,16 0,0036604 .
Тиск у всіх газів при постійному об’ємі зростає з підвищенням температури також на 1/273 частку того тиску, який мав газ при t 0 °С:
Р1 Р0 (1 at) Р0 (1 t / 273) , |
(2.28) |
де Р1 і Р0 - тиск газу при постійному об’ємі при температурах
t і 0 °С.
Закон Бойля-Маріотта стверджує, що при постійній температурі об’єм однієї й тієї ж маси газу змінюється обернено-пропорційно тиску Р, тобто добуток об’єму даної маси газу V на абсолютний тиск Р, під яким знаходиться газ, при постійній температурі T є величиною постійною:
V 1/ Р const ; |
РV c const ; |
V1 /V2 Р2 / Р1 або |
Р1V1 Р2V2 const . |
(2.29) |
|
41
Вуглеводневі гази стискуються більше, ніж це випливає з закону Бойля-Маріотта. Тому при визначенні об’єму природних газів у формулу підрахунку запасів газу необхідно ввести поправку на стисливість a 1/ z . Для знаходження поправки a при температурі 15 °С користуються виразом:
n 2,26 Р (m 4e 8d 3c 5,5s 0,22l) /1000 , (2.30)
де n - відхилення від закону Бойля-Маріотта, %; Р - манометричний абсолютний тиск;
m,e,d,c, s,l - вміст відповідно метану, етану, пропану,
вуглекислоти, сірководню, повітря, %.
Підрахувавши по характеру компонентного складу газу величину n , підставляють в об’ємну формулу поправку a 1 n / 100 . При високому вмісті важких вуглеводнів і абсолютному тиску понад 10 МПа приведеною вище формулою користуватися не рекомендується.
Закон Дальтона формулюється так: загальний тиск газової суміші Р дорівнює сумі парціальних тисків, створюваних кожним окремим газом:
Р Р1 Р2 Рn , |
(2.31) |
де Р1 , Р2 , . . . Рn - парціальні тиски компонентів суміші газу.
Закон Амага стверджує, що загальний об’єм V , займаний сумішшю газів, дорівнює сумі парціальних об’ємів компонентів:
V V1 V2 |
Vn , |
(2.32) |
де V1 , V2 , ..... Vn |
- парціальні об’єми окремих газів, приведені |
|
до загального тиску. |
|
|
|
|
42 |
