
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Содержание этапов занятия
1-й этап.Преподаватель проверяет выполнение домашнего задания в рабочих тетрадях, отвечает на вопросы студентов. Оценка проделанной работы по пятибалльной системе.
2-й этап.Студент письменно отвечает на билет тест-контроля, сдает работу преподавателю; ответ проверяется на занятии и оценивается в баллах.
3-й этап.При ответе теоретического материала студенты у доски разбирают:
– особенности электронного строения гидроксильной и тиоловой групп и их химическое поведение;
– сравнение кислотности одноатомных спиртов с различными заместителями в радикале, одноатомных и многоатомных спиртов, одноатомных спиртов и фенолов, одноатомных спиртов и тиолов;
– образование «хелатов», как доказательство повышенных кислотных свойств у многоатомных спиртов и фенолов;
– реакция этерификации и гидролиз;
– реакции окисления спиртов, фенолов и тиолов;
– реакции замещения «ОН» группы на галоген (SN– реакции).
4-й этап.Студенты по 2 человека выполняют лабораторные работы по теме по практикуму, выдаваемому на занятии.
5-й этап.Студенты оформляют лабораторные работы в виде таблицы, данной в рабочей тетради.
6-й этап.Студент сдает оформленный протокол и объясняет полученные данные. Преподаватель оценивает приобретенные практические навыки.
Кислотность и основность органических соединений
Реакционная способность органических соединений тесно связана с понятиями “кислотность“ и “основность“. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда (протолитическая ) и теория Льюиса.
Согласно определению Бренстеда, кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов); основания по Бренстеду – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Кислота Льюиса – это акцептор электронной пары, основания Льюиса – донор электронной пары.
В принципе большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся связи С-Н, N-H,O-H,S-H. Сила кислоты определяетсястабильностью аниона, образующегося в результате диссоциации этой кислоты. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от многих факторов:
а) способности атома, связанного с водородом, удерживать электронную пару после ухода протона (т.е. электроотрицательности);
б) размера этого атома;
в) возможности делокализации (распределения отрицательного заряда по другим атомам);
г) способности растворителя сольватировать анион.
В качестве меры кислотности используют константу равновесия реакции ионизации (Ка):
![]() АН
АН![]() Аˉ + Н+АˉН+
Аˉ + Н+АˉН+
 кислота анион про-АН
кислота анион про-АН
Кислоты тон
Для удобства часто вместо КаиспользуютрКа= lg Ка
Кислотность различных классов органических соединений с одинаковыми радикалами увеличивается в следующей последовательности:
|
R–H2С –H Алканы |
R-NH-H Амины |
R-O-H Спирты |
R-S-H Тиолы |
Фенолы |
R– СOOH Карбоновые кислоты |
|
рКа 50 |
рКа 30 |
рКа 18 |
рКа 12 |
pКа 10 |
рКа 4,7 |
|
СН кислоты |
NH кислоты |
ОН кислоты |
SH кислоты |
ОН кислоты |
ОН кислоты |
Причиной самой слабой кислотности С-Н кислот является то, что углерод обладает низкой электроотрицательностью и проявляет слабую способность удерживать отрицательный заряд на анионе. Поэтому образование карбанионов является энергетически невыгодным процессом:
СН4![]() СН3 ˉ + Н+
СН3 ˉ + Н+
карбанион
(метил-анион)
Среди насыщенных соединений заметную кислотность проявляют спирты (О-Н-кислоты), что обусловлено достаточной электроотрицательностью атома кислорода, т.е. способностью удерживать электронную пару в анионе, тем самым, стабилизируя его:
ROH
![]() ROˉ
+ H+
ROˉ
+ H+
спирт алкоксид-
анион
Стабильность аниона R–Oˉ значительно повышается с появлением возможности делокализации отрицательного заряда либо за счет электроотрицательного элемента в радикале, либо по системе сопряженных связей. Так, например, увеличение кислотности нарколана (Br3C–CH2-OH) объясняется влиянием –Iэффекта трех атомов брома в радикале (стабилизирующий фактор).
У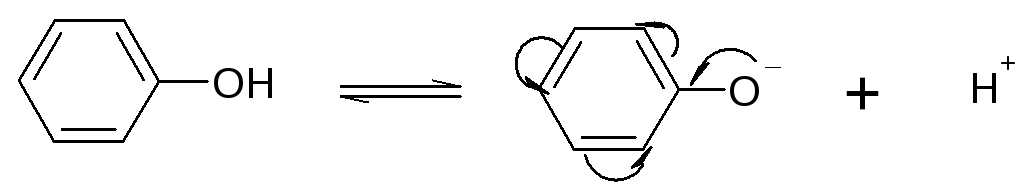 величение
кислотности фенолов по сравнению с
алифатическими спиртами объясняется
стабильностью фенолят-аниона, отрицательный
заряд которого делокализуется по
ароматическому кольцу вследствие +М
эффекта.
величение
кислотности фенолов по сравнению с
алифатическими спиртами объясняется
стабильностью фенолят-аниона, отрицательный
заряд которого делокализуется по
ароматическому кольцу вследствие +М
эффекта.
Br3C–CH2-OH
![]() Br3CCH2O
+ H+
Br3CCH2O
+ H+
Тиолы проявляют более сильные кислотные свойства по сравнению со спиртами благодаря большему размеру атома серы, в котором отрицательный заряд лучше делокализуется, стабилизируя тиолят-анион.
Карбоновые кислоты в данном ряду – самые сильные кислоты.
Это объясняется образованием стабильного карбоксилат-аниона при диссоциации карбоновых кислот. Карбоксилат-анион стабилизирован за счет делокализации отрицательного заряда по системе сопряжения:

()
Изменение основности будет противоположно изменению кислотности. Чем выше основность, тем ниже кислотность.
Спирты
Производные углеводородов, в которых один или несколько атомов водорода замещены на ОН-группы, называют спиртами. Общая формула R-O-H.
Классификация:
1) по атомности – по количеству ОН-групп на одно- и многоатомные спирты;
2)по характеру радикала – предельные и непредельные; алифатические и ароматические;
3) по характеру атома углерода, с которым связана ОН-группа, – первичные, вторичные, третичные спирты.
