
- •Кинетика химических процессов.
- •Реакции нулевого порядка
- •A b
- •Кинетика реакций первого порядка
- •Пример решения задачи в системе MathCad
- •Кинетика реакций второго порядка
- •Пример решения задачи Всистеме MathCad
- •Линейные цепи реакций
- •Разветвленные цепи реакций
- •Кинетика процессов в открытой системе
- •Кинетика реакций ферментативного катализа
- •Кинетическая модель Михаэлиса – Ментена
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
Разветвленные цепи реакций
В![]() процессах превращения веществ (и во
многих биологических процессах более
высокого уровня) нередко их развитие
может происходить двумя альтернативными
путями (возможно и большее ветвление
процесса). Рассмотрим простейший случай,
когда вещество А может превращаться
либо в В, либо в С, но с разными в общем
случае константами скоростей:
процессах превращения веществ (и во
многих биологических процессах более
высокого уровня) нередко их развитие
может происходить двумя альтернативными
путями (возможно и большее ветвление
процесса). Рассмотрим простейший случай,
когда вещество А может превращаться
либо в В, либо в С, но с разными в общем
случае константами скоростей:


B C
Считаем систему закрытой и в начальный момент времени t=0
a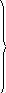 =a0,
b=c=a.Кинетические уравнения запишутся
следующим образом:
=a0,
b=c=a.Кинетические уравнения запишутся
следующим образом:
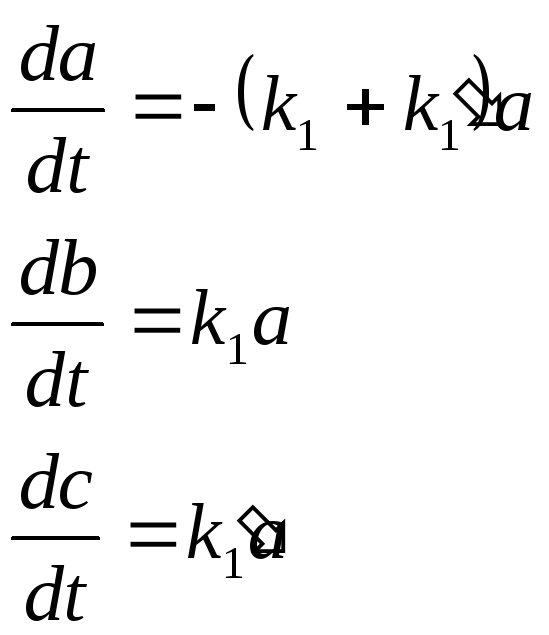
![]()
Р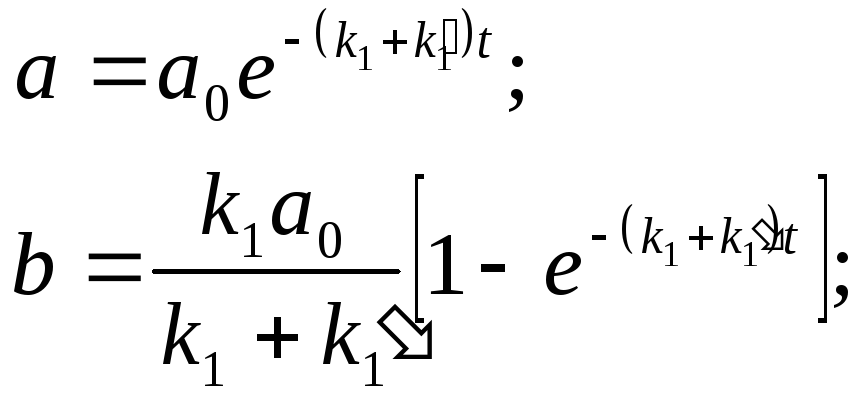
![]() ешая
эти уравнения, получим:
ешая
эти уравнения, получим:
Нетрудно видеть, что b/c=k1/k1,т. е. количества конечных продуктов но каждому направлению относятся как константы скоростей но этим направлениям.
Кинетика процессов в открытой системе
Рассматривая различные тины элементарных процессов превращения веществ, при решении кинетических уравнений мы использовали условие неизменности общей массы реагирующих
веществ. Этим подразумевалось, что реакции должны заканчиваться установлением равновесия между тем все биологические системы открытые, и протекающие в них процессы не есть переход к состоянию равновесия. Процессы в открытых системах приводят к установлению стационарного состояния.
К
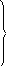
![]() инетические
уравнения для концентрацииаиbзапишутся так:
инетические
уравнения для концентрацииаиbзапишутся так:
У![]() словием
стационарного состояния всего процесса
является равенство скоростей реакций
нулю:
словием
стационарного состояния всего процесса
является равенство скоростей реакций
нулю:
![]()
П![]() риравнивая
правые части уравнений (12) нулю, из
первого уравнения выразима:
риравнивая
правые части уравнений (12) нулю, из
первого уравнения выразима:
и подставим его во второе. Решая затем получившееся уравнение
о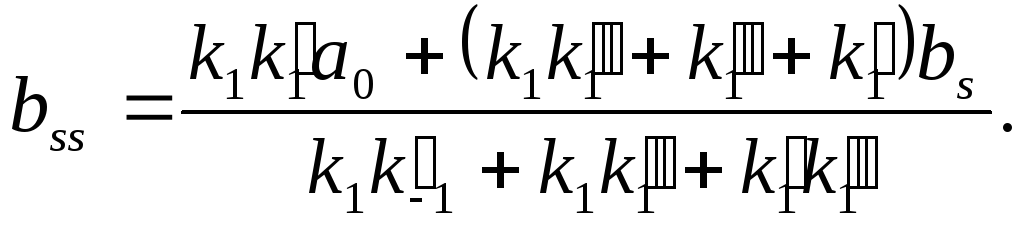 тносительно
b,мы найдем выражение этой величины
и стационарном состоянии.
тносительно
b,мы найдем выражение этой величины
и стационарном состоянии.
Если подставить это выражение в первое из уравнений (12) и решить его относительно а(при условии стационарностиdа/dt/=0), то получим формулу для стационарной концентрации
![]()
Таким образом, если (фиксированы уровни поступления и удаления веществ (а0 и bs) и известны константы скоростей реакций, то это 'предопределяет установление стационарного состояния всей системы реакций.
Кинетика реакций ферментативного катализа
Особенностью кинетики процессов, обсуждаемых в этой лекции, является наличие в системе агентов, способных существенно влиять на скорость протекания реакции. К ним относятся ферменты, катализирующие те или иные биохимические превращения. Эффективность элементов чрезвычайно высока. Например, число оборотов (число молекул субстрата, с которым успевает прореагировать и освободиться одна молекула фермента и минуту) для фумаразы составляет 105, а для ацетилхолинэстеразы 2 . 107. Понятно, что концентрация ферментов в метаболических системах на несколько порядков ниже, чем соответствующих субстратов.
Кинетическая модель Михаэлиса – Ментена
Еще в начале века было установлено, что если концентрацию фермента поддерживать постоянной, а начальную концентрацию субстрата изменять в достаточно широких пределах
Математическая модель, ферментативного катализа была разработана Л.Михаэлисом и М. Меитсиом в 1913 г. Ими была предложена двустадийная последовательность процесса
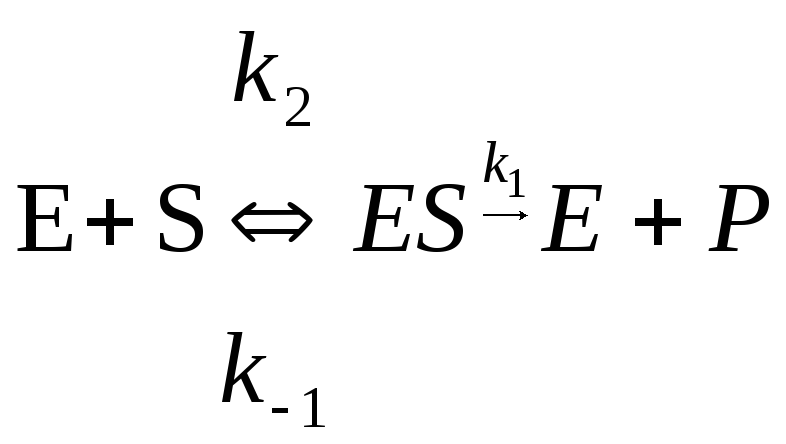
Здесь S—субстрат; Е—фермент; Р—продукт. На первой обратимой стадии образуется фермент-субстратный комплекс ES который затем необратимо распадается на конечный продукт, освобождая молекулу фермента для участия в следующем цикле.
К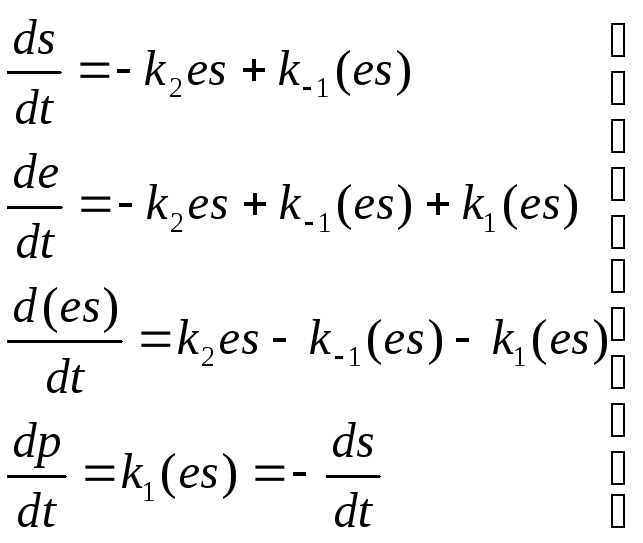 инетические
уравнения запишутся следующим образом:
инетические
уравнения запишутся следующим образом:
![]()
Здесь e, s, p, (es) —концентрации фермента, субстрата, продукта и комплекса ES соответственно.
