
- •Глава 1 Химическая термодинамика.
- •1.1 Основные понятия и определения в термодинамике.
- •Термодинамические процессы.
- •Внутренняя энергия
- •Формы обмена энергией
- •1.2. Первый закон термодинамики.
- •Теплоемкость
- •Влияние температуры на теплоемкость
- •Термохимия
- •Энтальпии образования и сгорания
- •Закон Гесса и следствия из него
- •Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
- •Второй закон термодинамики Самопроизвольные и несамопроизвольные процессы.
- •Содержание и формулировки второго закона термодинамики. Энтропия как функция состояния системы.
- •Статистический характер второго закона термодинамики.
- •Некоторые закономерности в изменении энтропии веществ.
- •Изменение энтропии в химических реакциях.
- •Температурная зависимость стандартной энтропии реакции.
- •Изменение энергии Гиббса
- •Термодинамическая зависимость стандартной энергии Гиббса химической реакции - ∆rG0т
- •Направление процессов в открытых многокомпонентных системах. Химический потенциал.
- •Термодинамика химических равновесий
- •Уравнение изотермы химической реакции.
- •Зависимость константы равновесия от температуры. Уравнение изобары реакции.
- •Глава 2 Химическая кинетика.
- •2.1 Общие представления о скорости химических реакций.
- •2.2 Зависимость скорости реакции от концентрации. Закон действующих масс.
- •Скорость гетерогенных химических реакций.
- •2.3 Влияние температуры на скорость химических реакций.
- •2.4 Кинетическая классификация реакций
- •Кинетические уравнения реакций различных порядков
- •Кинетические представления о химическом равновесии.
- •Смещение химического равновесия.
- •2.5 Теоретические подходы к трактовке элементарного акта химической реакции.
- •Теория активных соударений (тас)
1.2. Первый закон термодинамики.
Формулировки и аналитическое выражение первого закона термодинамики.
Первый закон термодинамики представляет собой одну из форм закона сохранения энергии, установленного в современном виде Гессом (1840 г), Майером (1842г), Джоулем (1842 г) и Гельмгольцем (1847 г).
Существует несколько формулировок закона сохранения энергии:
Энергия не создается и не уничтожается;
Вечный двигатель первого рода невозможен;
В любой изолированной системе общее количество энергии постоянно.
В термодинамике применяется еще одна формулировка закона сохранения энергии, которая и является первым законом термодинамики. Этот закон оперирует с количествами теплоты и работы, которыми система обменивается с окружающей средой.
Предположим, что система совершает круговой процесс претерпевая изменения, например, сжатие, расширение, нагревание и т.д., при этом поглощает теплоту Q и совершает работу А. Рис. 1.7 а
Поскольку в самой системе в круговом процессе ничего не изменяется, согласно закону сохранения энергии
Q = А (1.5)
При этом будем считать, что + Q соответствует теплоте поглощаемой системой,
- Q теплоте, выделяемой системой.
Количество же работы в термодинамике принято считать положительным (+А), когда работа совершается системой и со знаком минус (-А), если совершается внешними силами над системой.
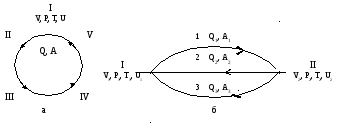
Рис.1.7 К формулировке первого закона термодинамики.
А теперь представим себе, что система совершает незамкнутый процесс по пути 1 (рис 1.6 б), переходя из состояния I в состояние II, при этом поглощает теплоту Q, и совершает работу А1. Система перешла в иное состояние, в ней произошли какие-то изменения и, следовательно, количества теплоты и работы не будут равны.
Q1≠ А1(1.6)
Далее можно предположить, что система возвращается в положение I, но уже по пути 2, поглощая при этом теплоту Q2и совершая работу А2. и в этом случае следует считать, что Q2≠ А2.
В целом же система совершила круговой процесс и поэтому можно записать
Q1+ Q2= А1+ А2(1.7)
или
Q2– А2 = - (Q1– А1) (1.8)
Если представить, что наша система будет переходить из состояния I в состояние II по 1 пути, а а возвращаться по иному – 3,4,5..., то можно записать
Q2 – А2= Q3– А3 = Q4– А4 = …=Qj – Аi = - (Q1 – А1) = const (1.9)
Отсюда следует, что разность Q– А для данного начального и конечного состояний не зависит от пути перехода и будет рвана изменению некоторого свойства системы. Этим свойством является внутренняя энергия. Поэтому, согласно предыдущему можно записать:
Q1– А1= U2 – U1(1.10)
или
Q– А =ΔU = U2 – U1(1.11)
Данное соотношение можно представить в виде: Q=ΔU + А (1.12) – которое является математической записью первого закона термодинамики.
Этот закон формулируется так:
Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею внешней работы.
Уравнение (1.12) можно переписать в виде
- ΔU = -Q+ А (1.13)
Т.е. убыль внутренней энергии системы расходуется на выделение теплоты и совершение работы.
Знак Δ (дельта, греч.) – означает конечную разность свойства системы. Для бесконечно малого изменения состояния уравнений 1.12 примет вид
δQ = dU + δA = dU + РdV + δA` (1.14)
где δА – сумма всех элементарных работ,
δA` - работа против гравитационных, электрических, магнитных и прочих сил, т.е. не связанная с изменением термодинамических параметров (так называемая полезная работа);
РdV – работа преодоления внешнего давления Р, необходимое для удержания системы в состоянии механического равновесия. Если на систему действует только постоянное внешнее давление, а другие силы отсутствуют, то A' = 0 и уравнение (1.14) принимает вид:
δQ = dU + РdV (1.15)
В этом уравнении Р можно считать давлением в системе только для равновесных (обратимых) процессов.
Процессы в которых участвуют системы могут протекать при различных условиях:
Изохорный процесс.
При изохорном процессе V= const, РdV = 0, согласно уравнению (1.15)
δQV = dU (1.16)
и для конечного изменения
QV
=
![]() (1.17)
(1.17)
Таким образом, в изохорном процессе величина δQV приобретает свойства полного дифференциала и теплота не зависит от пути превращения. Если теплоту измерять в калориметре с постоянным объемом, то можно определять приращение (илиубыль) внутренней энергии системы. Реакции при V= const, могут быть осуществлены: а) в закрытой бомбе; б) между твердыми телами и жидкостями без выделения газа; в) между газами, если число молекул остается постоянным, например, H2 + Cl2 = 2HCl (газ)
Для изобарного процесса (р = const), в котором совершается только работа расширения уравнения (1.15), можно записать
δQр = dU + рdV = d (U + PV) = dН (1.18)
Сумма внутренней энергии и произведения объема вещества на внешнее давление называют энтальпией и обозначают буквой Н. Произведение рV численно равно работе, которую надо совершить, что бы данную систему ввести в пространство объемомV с давлением р. Следовательно, оно представляет собой ту потенциальную энергию системы, которая обусловлена давлением р в объемеV.Поэтому произведение рV– называютпотенциальной энергией давления.
Последняя, не имеет ничего общего с потенциальной энергией положения системы во внешнем силовом поле.
Термодинамическая система, в которой учитывается внутренняя энергия и потенциальная энергия давления, называется расширенной системой.
Интегрирование уравнения и простое преобразование дают:
Qр = ΔU + PΔV = U2 – U1 + р (V2 – V1) = (U2 + рV2) – (U1 + рV1) = Н2 – Н1 = ΔН (1.19)
Следовательно, теплота, поглощенная в изобарном процессе, служит мерой приращения энтальпии системы. Так же, как и внутренняя энергия, энтальпия системы является функцией состояния.
Изотермический процесс
Передача теплоты при Т = const от одного тела к другому является квазистатическим процессом. Для идеального газа, а так же для реального при невысоких давлениях внутренняя энергия является функцией температуры. Поэтому при изотермических процессах U= const и уравнение (1.15) принимает вид:
δQ = рdV (1.20)
или
Q = А (1.21)
Следовательно, при изотермическом процессе сообщенная системе теплота целиком превращается в работу расширения.
Адиабатический процесс
При адиабатическом процессе δQ = 0 и уравнение (1.15) принимает вид:
δА = - dU (1.22)
или
А = - ΔU (1.23)
Таким образом, при адиабатическом процессе работа расширения совершается системой за счет убыли ее внутренней энергии.
