
- •Глава 1 Химическая термодинамика.
- •1.1 Основные понятия и определения в термодинамике.
- •Термодинамические процессы.
- •Внутренняя энергия
- •Формы обмена энергией
- •1.2. Первый закон термодинамики.
- •Теплоемкость
- •Влияние температуры на теплоемкость
- •Термохимия
- •Энтальпии образования и сгорания
- •Закон Гесса и следствия из него
- •Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
- •Второй закон термодинамики Самопроизвольные и несамопроизвольные процессы.
- •Содержание и формулировки второго закона термодинамики. Энтропия как функция состояния системы.
- •Статистический характер второго закона термодинамики.
- •Некоторые закономерности в изменении энтропии веществ.
- •Изменение энтропии в химических реакциях.
- •Температурная зависимость стандартной энтропии реакции.
- •Изменение энергии Гиббса
- •Термодинамическая зависимость стандартной энергии Гиббса химической реакции - ∆rG0т
- •Направление процессов в открытых многокомпонентных системах. Химический потенциал.
- •Термодинамика химических равновесий
- •Уравнение изотермы химической реакции.
- •Зависимость константы равновесия от температуры. Уравнение изобары реакции.
- •Глава 2 Химическая кинетика.
- •2.1 Общие представления о скорости химических реакций.
- •2.2 Зависимость скорости реакции от концентрации. Закон действующих масс.
- •Скорость гетерогенных химических реакций.
- •2.3 Влияние температуры на скорость химических реакций.
- •2.4 Кинетическая классификация реакций
- •Кинетические уравнения реакций различных порядков
- •Кинетические представления о химическом равновесии.
- •Смещение химического равновесия.
- •2.5 Теоретические подходы к трактовке элементарного акта химической реакции.
- •Теория активных соударений (тас)
Смещение химического равновесия.
Химическое равновесие, отвечающее
равенству скоростей прямой и обратной
реакций (![]() =
=![]() )
и минимальному значению энергии Гиббса
(∆Gр,т= 0), является наиболее
устойчивым состоянием системы при
заданных условиях и остается неизменным
до тех пор, пока сохраняются постоянными
параметры, при которых равновесие
установилось.
)
и минимальному значению энергии Гиббса
(∆Gр,т= 0), является наиболее
устойчивым состоянием системы при
заданных условиях и остается неизменным
до тех пор, пока сохраняются постоянными
параметры, при которых равновесие
установилось.
При изменении условий равновесие нарушается и смещается в сторону прямой или обратной реакции. Смещение равновесия связано с тем, что внешнее воздействие в разной степени изменяет скорость двух взаимно противоположных процессов. Через некоторое время система вновь становится равновесной, т.е. она переходит из одного равновесного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
Направление смещения равновесия в общем случае определяется принципом Ле Шателье: если на систему, находящуюся в состоянии устойчивого равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону процесса, ослабляющего эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, концентрации (давления) одного из реагентов.
Температура – тот параметр, от которого
зависит величина константы равновесия
химической реакции. Вопрос смещения
равновесия при изменении температуры
в зависимости от условий использования
реакции решается путем использования
уравнения изобары (1.90) -
![]() =
=![]()
Для изотермического процесса ∆rН0(т)< 0, в правой части выражения (1.90) R > 0, T > 0, следовательно первая производная логарифма константы равновесия по температуре отрицательна
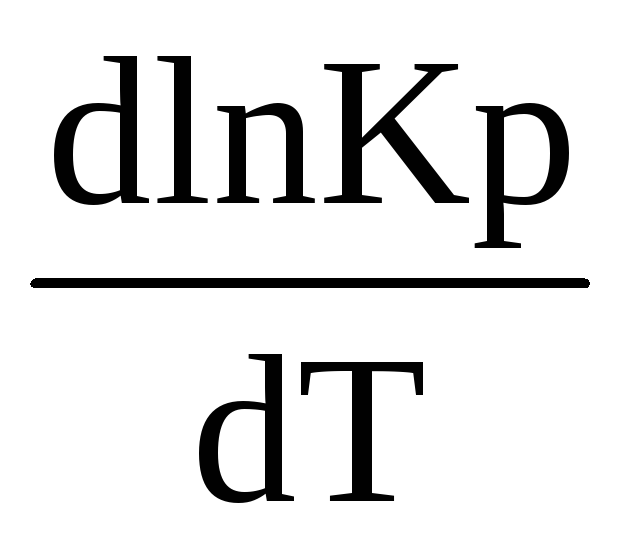 <
0, т.е. ln Kp (и сама константа Кр) являются
убывающими функциями температуры. При
увеличении температуры константа
химического равновесия (Кр) уменьшается
и что согласно закону действующих масс
(2.27), (2.28)соответствует смещению
химического равновесия в сторону
обратной (эндотермической) реакции.
Именно в этом проявляется противодействие
системы оказанному воздействию.
<
0, т.е. ln Kp (и сама константа Кр) являются
убывающими функциями температуры. При
увеличении температуры константа
химического равновесия (Кр) уменьшается
и что согласно закону действующих масс
(2.27), (2.28)соответствует смещению
химического равновесия в сторону
обратной (эндотермической) реакции.
Именно в этом проявляется противодействие
системы оказанному воздействию.Для эндотермического процесса ∆rН0(т)> 0 производная логарифма константы равновесия по температуре положительна (
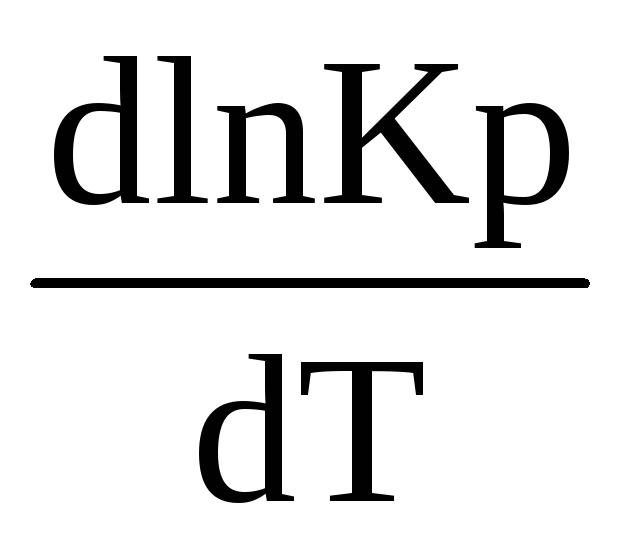 >
0), тема образом ln Kp и Кр являются
возрастающими функциями температуры,
т.е. в соответствии с законом действующих
масс при увеличении температуры
равновесие смещается в сторону прямой
(эндотермической реакции). Однако надо
помнить, что скорость как изотермического
так и эндотермического процессов при
повышении температуры возрастает, а
при понижении понижается, но изменение
скоростей
>
0), тема образом ln Kp и Кр являются
возрастающими функциями температуры,
т.е. в соответствии с законом действующих
масс при увеличении температуры
равновесие смещается в сторону прямой
(эндотермической реакции). Однако надо
помнить, что скорость как изотермического
так и эндотермического процессов при
повышении температуры возрастает, а
при понижении понижается, но изменение
скоростей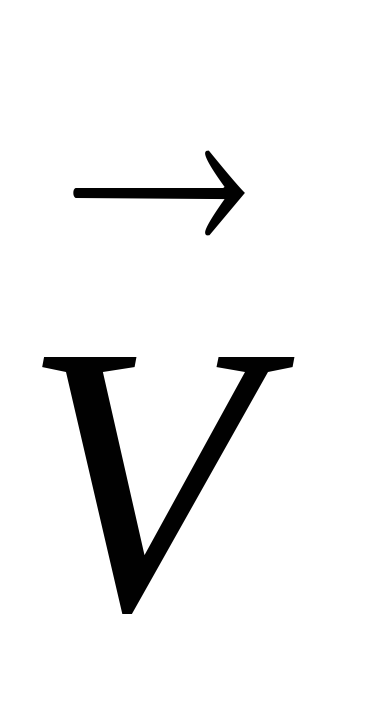 и
и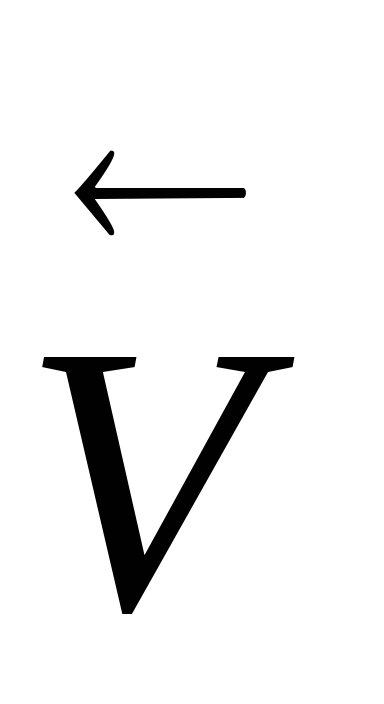 при
изменении температуры неодинаково,
поэтому, варьируя температуру, можно
смещать равновесия в заданном направлении.
Смещение равновесия может быть вызвано
изменением концентрации одного из
компонентов: добавлением вещества в
равновесную систему или выводом из
системы.
при
изменении температуры неодинаково,
поэтому, варьируя температуру, можно
смещать равновесия в заданном направлении.
Смещение равновесия может быть вызвано
изменением концентрации одного из
компонентов: добавлением вещества в
равновесную систему или выводом из
системы.
По принципу Ле Шателье при изменении
концентрации одного из участников
реакции равновесие смещается в сторону
компенсирующую изменение, т.е. при
увеличении концентрации одного из
исходных веществ – в правую сторону, а
при увеличении концентрации одно из
продуктов реакции – в левую. Если в
обратимой реакции участвуют газообразные
вещества, то при изменении давления,
одинаково и одновременно изменяются
все их концентрации. Изменяются и
скорости процессов, а следовательно,
может произойти и смещение химического
равновесия. Так, например, при увеличении
давления (по сравнению с равновесным)
на систему СаСО3(К)![]() СО(к)+ СО2(г)возрастает скорость обратной
реакции
СО(к)+ СО2(г)возрастает скорость обратной
реакции![]() =
=![]() что
приведет к смещению равновесия в левую
сторону. При понижении давления на туже
систему скорость обратной реакции
уменьшается, и равновесие смещается в
правую сторону. При увеличении давления
на систему 2HCl
что
приведет к смещению равновесия в левую
сторону. При понижении давления на туже
систему скорость обратной реакции
уменьшается, и равновесие смещается в
правую сторону. При увеличении давления
на систему 2HCl![]() H2+Cl2, находящуюся в состоянии
равновесия, смещение равновесия не
произойдет, т.к. обе скорости
H2+Cl2, находящуюся в состоянии
равновесия, смещение равновесия не
произойдет, т.к. обе скорости![]() и
и![]() возрастут
одинаково.
возрастут
одинаково.
Для системы 4HCl + О2![]() 2Cl2+ 2Н2О(г)увеличение давления
приведет к увеличению скорости прямой
реакции и смещению равновесия вправо.
2Cl2+ 2Н2О(г)увеличение давления
приведет к увеличению скорости прямой
реакции и смещению равновесия вправо.
И так, в соответствии с принципом Ле Шателье при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газовой смеси и соответственно в сторону уменьшения давления в системе.
И наоборот, при внешнем воздействии, вызывающем понижение давления, равновесие смещается в сторону образования большего количества молей газообразных веществ, что вызовет увеличение давления в системе и будет противодействовать произведенному воздействию.
Принцип Ле Шателье имеет большое практическое значение. На его основе можно подобрать такие условия осуществления химического взаимодействия, которые обеспечат максимальный выход продуктов реакции.
