
- •Глава 1 Химическая термодинамика.
- •1.1 Основные понятия и определения в термодинамике.
- •Термодинамические процессы.
- •Внутренняя энергия
- •Формы обмена энергией
- •1.2. Первый закон термодинамики.
- •Теплоемкость
- •Влияние температуры на теплоемкость
- •Термохимия
- •Энтальпии образования и сгорания
- •Закон Гесса и следствия из него
- •Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
- •Второй закон термодинамики Самопроизвольные и несамопроизвольные процессы.
- •Содержание и формулировки второго закона термодинамики. Энтропия как функция состояния системы.
- •Статистический характер второго закона термодинамики.
- •Некоторые закономерности в изменении энтропии веществ.
- •Изменение энтропии в химических реакциях.
- •Температурная зависимость стандартной энтропии реакции.
- •Изменение энергии Гиббса
- •Термодинамическая зависимость стандартной энергии Гиббса химической реакции - ∆rG0т
- •Направление процессов в открытых многокомпонентных системах. Химический потенциал.
- •Термодинамика химических равновесий
- •Уравнение изотермы химической реакции.
- •Зависимость константы равновесия от температуры. Уравнение изобары реакции.
- •Глава 2 Химическая кинетика.
- •2.1 Общие представления о скорости химических реакций.
- •2.2 Зависимость скорости реакции от концентрации. Закон действующих масс.
- •Скорость гетерогенных химических реакций.
- •2.3 Влияние температуры на скорость химических реакций.
- •2.4 Кинетическая классификация реакций
- •Кинетические уравнения реакций различных порядков
- •Кинетические представления о химическом равновесии.
- •Смещение химического равновесия.
- •2.5 Теоретические подходы к трактовке элементарного акта химической реакции.
- •Теория активных соударений (тас)
Кинетические уравнения реакций различных порядков
Реакции первого порядка.
К этим реакциям относятся реакции изомеризации, термического разложения веществ, реакции радиоактивного распада и многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной.
Для реакции типа А → В скорость выражается уравнением:
V = -
![]() = К * СА(2.15)
= К * СА(2.15)
Или разделив переменные
-
![]() = К *
= К *![]() и проинтегрировав данное уравнение,
получим:
и проинтегрировав данное уравнение,
получим:
- ln CA = K * τ + const
Значение constможно определить из начальных условий. При τ = 0 концентрация вещества А в данный момент (СА) будет равна концентрации вещества А в начальный момент времени (СО,А). Следовательно,const= -lnCО,AВ этом случае
- lnCA = К * τ -lnCО,А
Или
- lnCA +lnCО,А= К * τ
Из полученного выражения
К =
![]() (2.16)
(2.16)
Это уравнение называется уравнением реакции первого порядка. Оно дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или, наоборот, найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени.
Если через Сх обозначить уменьшение концентрации исходного вещества к моменту времени τ, то уравнению можно придать вид:
К =
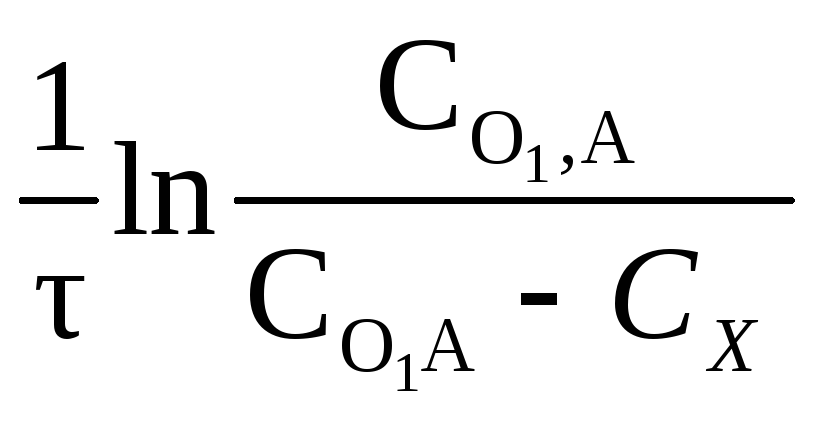 (2.17)
(2.17)
Для характеристики скорости реакции
первого порядка наряду с константой
скорости часто пользуются величиной,
называемой периодом полураспада (τ1/2),
то есть временем, необходимым для того,
чтобы прореагировало половина взятого
вещества. Принимая![]() ,
из уравнения (2.16) находим:
,
из уравнения (2.16) находим:
К =
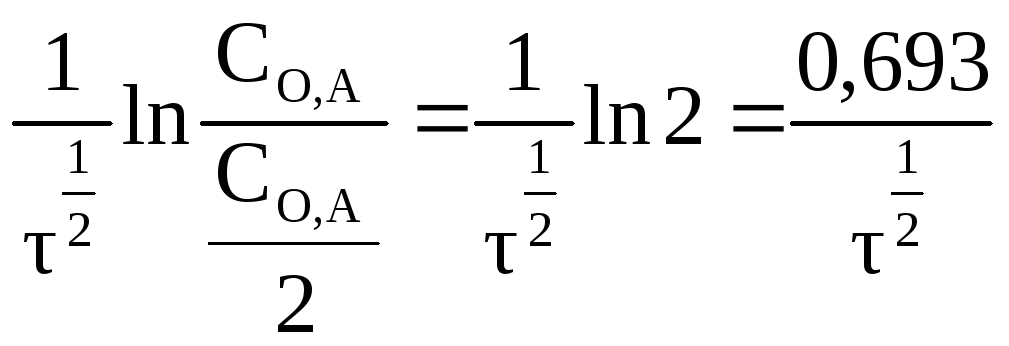 или
или![]() = 0,693/К (2.18)
= 0,693/К (2.18)
Из уравнения видно, что время полураспада для реакции первого порядка не зависит от количества вещества.
Следует также отметить, что константа скорости в уравнениях первого порядка имеет размерность обратного времени [K] = С-1, мин-1
Реакции второго порядка.
К ним принадлежит большинство бимолекулярных реакций и некоторые тримолекулярные. Реакции второго порядка можно представить схемой А + В → продукты реакции.
Скорость такой реакции определяется уравнением:
V = -
![]() = К * СА* СВ
= К * СА* СВ
Где СА и СВ– концентрации реагирующих веществ в момент времени τ.
Рассмотрим простейший случай, когда концентрации двух реагирующих веществ одинаковы, тогда
-
![]() = К * С2(2.20)
= К * С2(2.20)
Разделить переменные
![]() и
проинтегрировав уравнение
и
проинтегрировав уравнение
(С-2* dc =![]() )
получим
)
получим
![]() const (2.21)
const (2.21)
При τ = 0, С = Со, const =
![]() ,
тогда
,
тогда![]() -
-![]() =
Кτ или
=
Кτ или
К =
![]() (
(![]() -
-![]() )
=
)
=![]() (
(![]() ) (2.22)
) (2.22)
Заменив С на Со- Сх, получим:
К =
![]() (
(![]() )
=
)
=![]() (
(![]() ) (2.23)
) (2.23)
При условии СА≠ СВуравнение скорости реакции в дифференциальной форме имеет вид:
-
![]() = К * СА* СВ= К (СО,А-
СХ)(СО,В - СХ)
= К * СА* СВ= К (СО,А-
СХ)(СО,В - СХ)
Разделив переменные
![]() = - К * dτ и проинтегрировав, получим:
= - К * dτ и проинтегрировав, получим:
К =
![]()
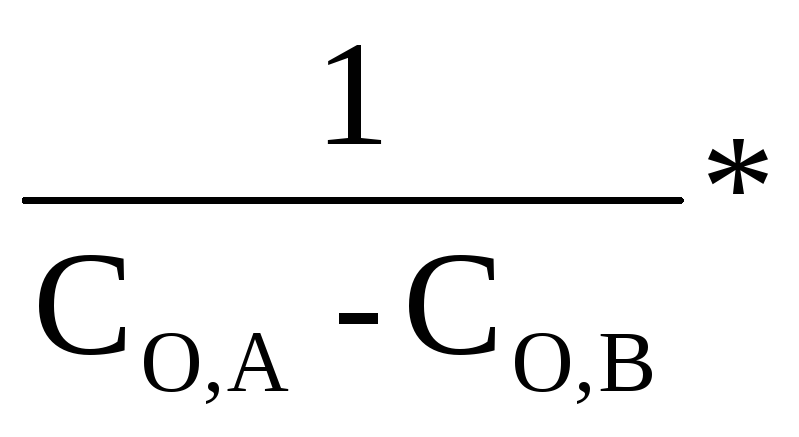 ln
ln![]() (2.24)
(2.24)
Кинетические представления о химическом равновесии.
Необратимые и обратимые химические реакции.
Когда при химическом взаимодействии хотя бы одной из исходных веществ расходуется полностью реакцию можно считать протекающей до конца, такую реакцию называют необратимой.
Например, Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O.
При достаточном количестве азотной кислоты реакция закончится тогда, когда весь Znрасходуется. И если попытаться привести эту реакцию в обратном направлении – пропустить диоксид азота через раствор нитратаZnто, металлическогоZnи азотной кислоты не получится – данная реакция не может протекать в обратном направлении.
Другим примером необратимой реакции может быть разложение бертолетовой соли:
KClO3 → KCl + 1,5O2
К необратимым принято относить взаимодействие между веществами, в результате которых образуются осадки, газы или мало диссоциированные соединения.
BaCl2 + Na2SO4 = BaSO4↓+2NaCl
NaCO3 + 2HCl = 2NaCl + CO2↑+ H2O
Однако каждая из приведенных реакций лишь практически необратима.
В химии растворов электролитов рассматривается возможность процессов.
BaSO4
→ Ba2+
+ S![]()
CO2
+ H2O
→ 2H + C![]()
H2O → H+ + OH-
Обратимых выделению осадков, газа, образованию мало диссоциированрого соединения. Как показывает опыт, большинство химических реакций протекают одновременно в сторону образования продуктов реакции (вправо, прямая реакция), так и в сторону превращения последних в исходные вещества (влево, обратная реакция). Такие реакции называются химически обратимыми.
Из основного постулата химической
кинетики следует, что скорости реакций
в любой момент времени, кроме τ = τравн,
имеют конечную величину. Поэтому с точки
зрения термодинамики все они необратимы.
Скорость обратимой реакции равна
разности между скоростями прямой и
обратной реакции в данный момент времени.
Если рассмотреть общий случай реакции
видааА +вВ![]() mM
+nN, то скорость прямой реакции
определяется уравнением
mM
+nN, то скорость прямой реакции
определяется уравнением
![]() = -
= -![]() = К1*
= К1*![]() (а)
(а)
А скорость обратной реакции
![]() =
=![]() = К2*
= К2*![]() (в)
(в)
Где К1– константа скорости прямой
реакции -![]()
Ка – константа скорости обратной реакции
![]()
Е сли
в начальном состоянии системы в ней
содержались только вещества А и В, то
скорость прямой реакции уменьшается
по мере течения ее в соответствии с
уменьшением их концентраций. Зависимость
этой скорости от времени можно представить
кривой I на рисунке (2.3);
сли
в начальном состоянии системы в ней
содержались только вещества А и В, то
скорость прямой реакции уменьшается
по мере течения ее в соответствии с
уменьшением их концентраций. Зависимость
этой скорости от времени можно представить
кривой I на рисунке (2.3);
Если бы не было обратной реакции, эта кривая достигла бы оси абсцисс при израсходовании одного из исходных веществ. Кривая II, относящаяся к скорости обратной реакции, начинается в начале координат (так как по условию в начальный момент C'A = C'В= 0) и повышается по мере течения прямой реакции и вызываемого его увеличения этих концентраций.
Общая скорость реакции в любой данный момент равна разности скоростей прямой и обратной реакции
V = -
![]() =
=![]() *
*![]() -
-![]()
![]() (2.25)
(2.25)
Очевидно, что при дальнейшем течении
реакции указанные две кривые – скоростей
прямой и обратной реакции – должны
где-то пересечься, т.е. должно быть
достигнуто такое состояние, при котором
скорости
![]() прямой
и
прямой
и![]() обратной
реакции станут равными между собой.
Когда обе скорости сравняются, наступит
состояние химического равновесия –
концентрации реагирующих веществ
становятся вполне определенными и
постоянными во времени (при условии,
что давление и температура не меняются).
обратной
реакции станут равными между собой.
Когда обе скорости сравняются, наступит
состояние химического равновесия –
концентрации реагирующих веществ
становятся вполне определенными и
постоянными во времени (при условии,
что давление и температура не меняются).
Таким образом, кинетическим условием
химического равновесия является
равенство скоростей
![]() =
=![]() ,
а концентрации веществ в равновесной
системе называютсяравновесными(
,
а концентрации веществ в равновесной
системе называютсяравновесными(![]() ).
).
Если скорости равны между собой, следовательно должны быть равны и правые части уравнений (а) и (в).
К1*![]() = К2*
= К2*![]()
Откуда
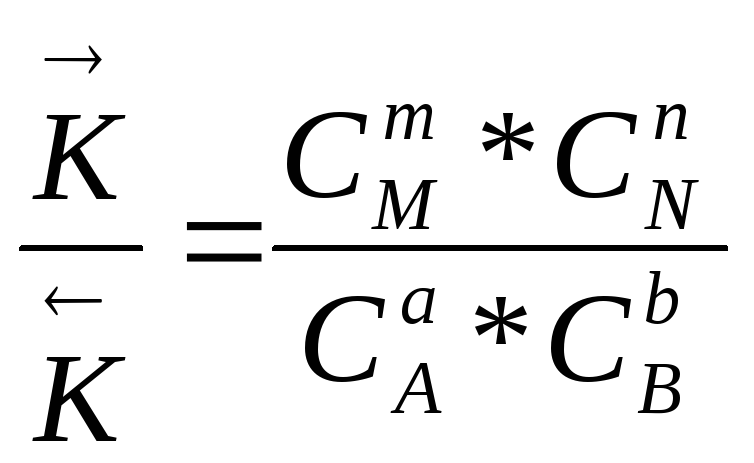
Правая часть равенства представляет собой константу равновесия (Кс) данной реакции
Кс =
![]() (2.26)
(2.26)
Следовательно,
Кс =
![]() =
=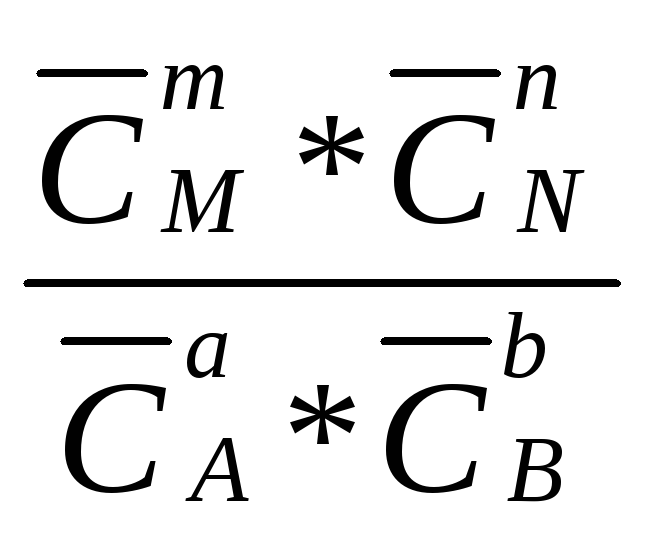 (2.27)
(2.27)
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой химического равновесия.
Концентрации газообразных веществ в выражении (2.27) могут быть заменены равновесными парциальными давлениями этих веществ.
Кр =
![]() =
=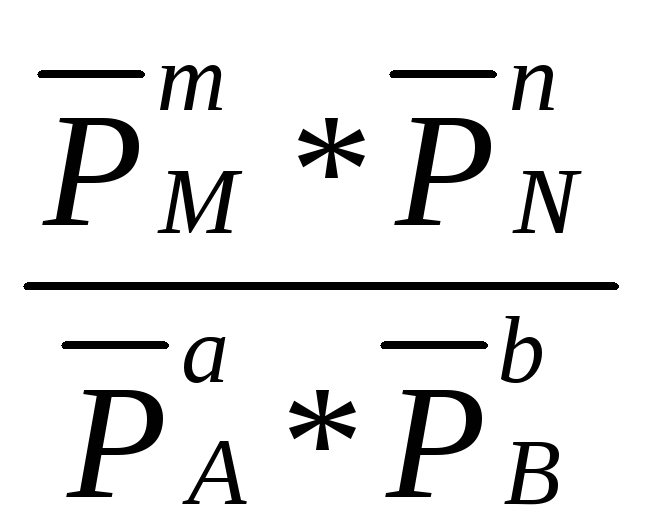 (2.28)
(2.28)
(Парциальное давление – давление компонента газовой смеси, которое он имел бы при представлении ему объема занимаемого всей смесью газов).
Если обратимая реакция протекает в гетерогенной системе, в которой наряду с газообразными реагентами участвуют твердые и жидкие вещества (не образующие друг с другом растворов), то при данной температуре парциальные давления реагентов, находящиеся в конденсированном состоянии, постоянны и не зависят от количества реагентов (как и давление постоянного пара какого-либо чистого индивидуального вещества, например воды при данной температуре).
Поэтому эти парциальные давления, независимо от того, малы они или существенны, известны или неизвестны, можно включить в константу равновесия. Следовательно, в подобных случаях в выражении (2.28) следует ввести толь равновесные парциальные давления газообразных веществ.
Так для реакции, FeO(k) + CO(г) ![]() Fe(k)+ CO2(г)
Fe(k)+ CO2(г)
Кр =
![]()
Полученные уравнения (2.27) и (2.28) справедливы
только для элементарных реакций. В общем
случае для сложных превращений, для
получения зависимости между величинами
Кс, Кр,
![]() нужны
знания о механизме процессов.
нужны
знания о механизме процессов.
И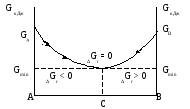 так,
равенство скоростей (
так,
равенство скоростей (![]() =
=![]() )
является кинетическим условием
химического равновесия, но при этом
надо помнить, что любая реакция при
постоянных температуре и давлении
протекает самопроизвольно в направлении
убыли энергии Гиббса. Пределом этой
убыли является минимальное значение
энергии Гиббса. На рисунке 2.4 представлено
изменение энергии Гиббса для обратимой
реакции (А
)
является кинетическим условием
химического равновесия, но при этом
надо помнить, что любая реакция при
постоянных температуре и давлении
протекает самопроизвольно в направлении
убыли энергии Гиббса. Пределом этой
убыли является минимальное значение
энергии Гиббса. На рисунке 2.4 представлено
изменение энергии Гиббса для обратимой
реакции (А![]() В) осуществляемой в закрытой системе в
изобарно-изотермических условиях. (Р,Т
= const), в зависимости от состава реакционной
смеси.
В) осуществляемой в закрытой системе в
изобарно-изотермических условиях. (Р,Т
= const), в зависимости от состава реакционной
смеси.
Рис. 2.4 Изменение энергии Гиббса для
обратимой реакции (А![]() В)
в зависимости от состава смеси.
В)
в зависимости от состава смеси.
Точке А соответствует состав 100 % вещества А, а точке В – 100 % вещества В. Процесс А → В идет самопроизвольно до тех пор, пока величина энергии Гиббса системы уменьшается от GAдо Gmin , и процесс В → А идет самопроизвольно до тех пор пока GВуменьшится до Gmin.
Точка С на оси абсцисс отвечающая минимальному значению энергии Гиббса (Gmin) определяет равновесный состав смеси при заданных условиях (Р,Т). Состояние равновесия характеризуется равенством∆Gр,т= 0
