
- •Глава 1 Химическая термодинамика.
- •1.1 Основные понятия и определения в термодинамике.
- •Термодинамические процессы.
- •Внутренняя энергия
- •Формы обмена энергией
- •1.2. Первый закон термодинамики.
- •Теплоемкость
- •Влияние температуры на теплоемкость
- •Термохимия
- •Энтальпии образования и сгорания
- •Закон Гесса и следствия из него
- •Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
- •Второй закон термодинамики Самопроизвольные и несамопроизвольные процессы.
- •Содержание и формулировки второго закона термодинамики. Энтропия как функция состояния системы.
- •Статистический характер второго закона термодинамики.
- •Некоторые закономерности в изменении энтропии веществ.
- •Изменение энтропии в химических реакциях.
- •Температурная зависимость стандартной энтропии реакции.
- •Изменение энергии Гиббса
- •Термодинамическая зависимость стандартной энергии Гиббса химической реакции - ∆rG0т
- •Направление процессов в открытых многокомпонентных системах. Химический потенциал.
- •Термодинамика химических равновесий
- •Уравнение изотермы химической реакции.
- •Зависимость константы равновесия от температуры. Уравнение изобары реакции.
- •Глава 2 Химическая кинетика.
- •2.1 Общие представления о скорости химических реакций.
- •2.2 Зависимость скорости реакции от концентрации. Закон действующих масс.
- •Скорость гетерогенных химических реакций.
- •2.3 Влияние температуры на скорость химических реакций.
- •2.4 Кинетическая классификация реакций
- •Кинетические уравнения реакций различных порядков
- •Кинетические представления о химическом равновесии.
- •Смещение химического равновесия.
- •2.5 Теоретические подходы к трактовке элементарного акта химической реакции.
- •Теория активных соударений (тас)
Уравнение изотермы химической реакции.
Рассмотрим ту же реакцию при постоянных температуре и давлении, но в условиях, отличных от равновесных
аА + bВ![]() сС
+ dD
сС
+ dD
Допустим, что в системе имеются настолько большие количества веществ А, В, С, D, что в результате взаимодействия а молей вещества А и b молей вещества В состав и общее давление системы не меняется. Но если прореагировали эти количества веществ, то изменение изобарно-изотермического потенциала системы определяется равенством:
∆rG =![]() μi
μi
![]() = сμС + dμD - аμА - bμВ
= сμС + dμD - аμА - bμВ
причем ∆G < 0, следовательно, система совершает химическую работу за счет изменения концентрации и убыли –∆ G изобарно-изотермического потенциала.
Предположим, что реагирующим веществам
применимы законы идеальных газов.
Подставляя химические потенциалы μА,
μВ, μС, μD, выраженные
формулой μi = μi0+ RT
lnpi в![]() μi
μi
![]() и группируя слагаемые соответствующим
образом, получим
и группируя слагаемые соответствующим
образом, получим
∆rG = (сμ0С + dμ0D - аμ0А - bμ0В) + RT (ср'С + dр'D - ар'А - bр'В) ≠ 0
(парциальные давления относятся к неравновесному состоянию)
Сумма в первой скобке, как показано при выводе уравнения (1.84) при условии ∆G = 0, равна -RT lnКp. Следовательно,∆rG = -RT lnКp + RT (ср'С + dр'D - ар'А - bр'В) или
∆rG = RT
(ln 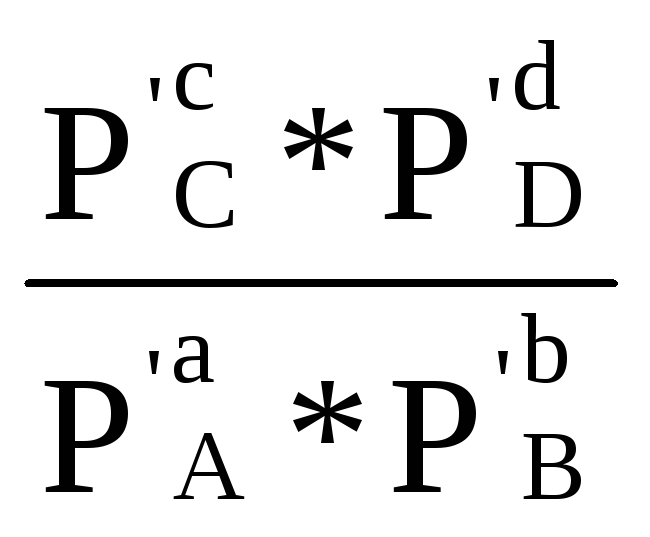 - ln Кp) (1.87)
- ln Кp) (1.87)
Полученное уравнение называется уравнением изотермы химической реакции (или уравнением Вант-Гоффа, 1886 г.), оно связывает энергию Гиббса реакции с константой химического равновесия и начальным парциальным давлением реагирующих веществ.
Если парциальное давление всех участков реакции в исходной смеси равны единице (рi= 1), то из уравнения (1.87) следует, что
∆rG0 = -RT ln Кр (1.88)
или
Кр =
![]() =
=
![]() *
*![]() (1.88а)
(1.88а)
Величина ∆rG0– стандартный изобарно-изотермический потенциал реакции при выбранной температуре – Т. После замены -RTlnКр на∆rG0уравнение (1.87) принимает следующий вид:
∆rG=∆rG0+RT ln 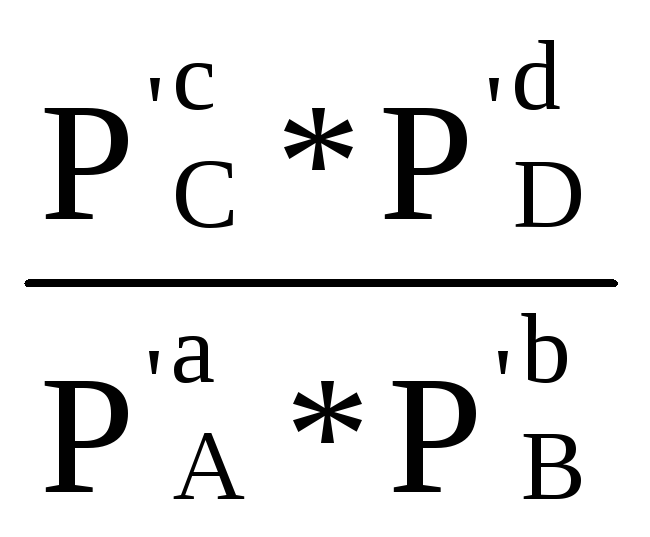 (1.89)
(1.89)
Из уравнения видно, что изменение изобарно-изотермического потенциала реакции состоит из двух частей. Одна часть ∆rG0– изменение для гипотетической реакции, в которой все реагирующие вещества взяты в стандартном состоянии. Для данной реакции∆rG0- постоянная величина при р,Т, зависящая только от природы участников реакции. Второй член в уравнении (1.89) отражает зависимость∆rG0от состава реакционной цепи.
Он представляет собой увеличение изобарно-изотермического потенциала, которое получается при переходе реагирующих веществ, взятых при любых парциальных давлениях (концентрациях) в продукты реакции, так же взятых при любых парциальных давлениях.
Зависимость константы равновесия от температуры. Уравнение изобары реакции.
Химическое равновесие является динамическим, оно смещается в ту или иную сторону при изменении внешних условий. В частности, на положение равновесия, и, следовательно, на константу равновесия влияет температура.
Функциональную зависимость константы равновесия от температуры при постоянном давлении можно получить исходя из уравнения изотермы реакции (1.87) и уравнения Гиббса – Гельмгольца (1.70).
Продифференцируем уравнение изотермы реакции (1.87) по температуре с учетом, что р'А, р'В, р'С, р'Dзаданы и от температуры не зависят, получим
![]() =
R ln
=
R ln 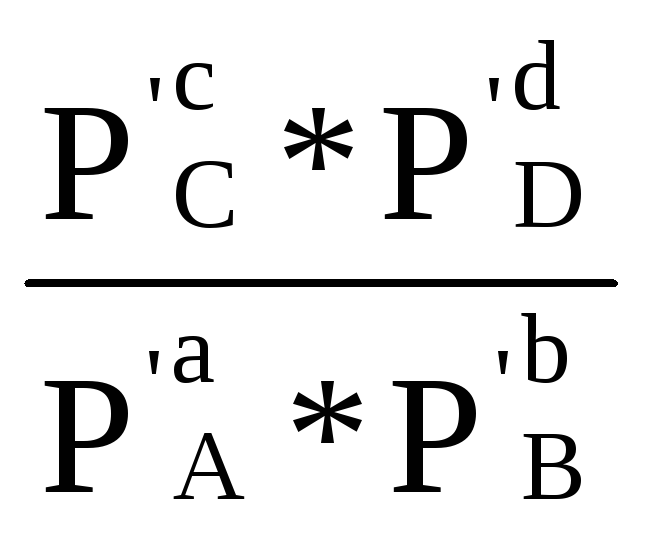 - R ln Кр - RT
- R ln Кр - RT
![]()
Подставим в уравнение Гиббса – Гельмгольца:
∆rG(т)=∆rН(т)+ Т[![]() ]рзначение∆rGиз уравнения изотермы и найденное
выражение
]рзначение∆rGиз уравнения изотермы и найденное
выражение![]() :
:
RТln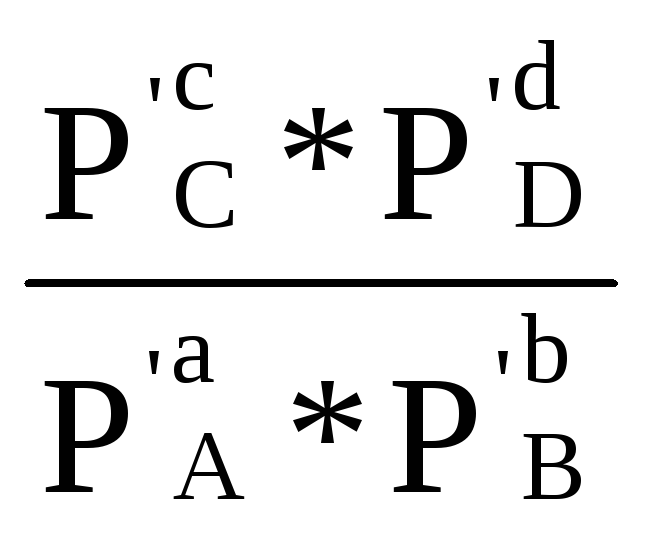 -RТlnКр =∆rН +RТln
-RТlnКр =∆rН +RТln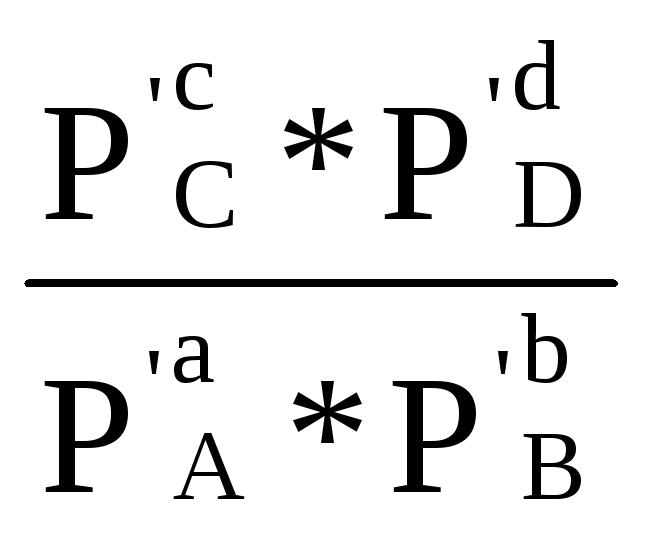 -RТlnКр –RT2
-RТlnКр –RT2
![]()
После сокращения получим:
![]() =
=![]() (1.90)
(1.90)
Это уравнение устанавливает связь между изменением константы равновесия с температурой и тепловым эффектом реакции. Оно относится к процессам, происходящем при постоянном давлении и называется уравнением изобары (Вант-Гоффа, 1885 г.)
Для расчетов равновесия при различных температурах уравнение (1.90) необходимо проинтегрировать. После разделения переменных имеем
d ln Кр =
![]()
В узком интервале температур тепловой эффект реакции практически не зависит от температуры, т.е. ∆Ср = 0. Поэтому, после интегрирования получим
ln Кр = -
![]() +
В (1.91)
+
В (1.91)
где В – постоянная интегрирования.
Из сравнения уравнения (1.91) с уравнением
(1.88а) видно, что В =
![]()
Уравнение (1.91) отнесенное к стандартным условиям можно записать в виде:
ln Кр = -
![]() =
-
=
-![]() +
+![]() (1.92)
(1.92)
где
![]() - стандартное изменение энтальпии
системы при температуре Т;
- стандартное изменение энтальпии
системы при температуре Т;![]() -
стандартное изменение энтропии системы
при той же температуре.
-
стандартное изменение энтропии системы
при той же температуре.
Из уравнения (1.92) следует, что ln Кр, а,
следовательно, и константа равновесия
может при повышении температуры и
увеличиваться и уменьшаться. Это связано
со знаком изменения энтальпии
![]() .
.
Если прямая реакция экзотермична (![]() < 0), то константа равновесия Кр при
повышении температуры уменьшается. И
наоборот, если реакция эндотермична (
< 0), то константа равновесия Кр при
повышении температуры уменьшается. И
наоборот, если реакция эндотермична (![]() > 0), то величина Кр с повышением
температуры увеличивается.
> 0), то величина Кр с повышением
температуры увеличивается.
