
- •Занятие 21
- •Краткие теоретические сведения и основные формулы Первое начало (закон) термодинамики выражает закон сохранения энергии:
- •На основании первого начала термодинамики
- •Адиабатный процесс
- •Работа, совершаемая газом при адиабатном процессе:
- •Теплоемкость одного моля и удельная теплоемкость при постоянном давлении
- •Метод решения задач
- •I часть Примеры решения задач
- •Решение
- •Задачи для самостоятельного решения
- •II часть Примеры решения задач
- •Сила удара молекулы о стенку будет равна
- •Давление газа на стенки сосуда
- •Из основного уравнения молекулярно-кинетической теории
- •Решение
- •Тогда работа
- •Вычислим
- •Решение
- •Решение
- •Качественные задачи
- •Задачи для самостоятельного решения
Решение
При переходе 1 - 2 работа складывается из двух работ: А1-3 – работа перехода из 1 в 3 состояние, и А3 - 2 – работа перехода из 3 во 2 состояние, т.е.
![]() ,
,
1 – 3 – изотерма.
![]() ,
,
причем
![]() V1
=
V1
=
![]() V3,
V3,
3 – 2 – адиабата.
Так как работа в адиабатном процессе равна изменению внутренней энергии:
![]()
![]() V3
=
V3
=![]() V1,
V1,
тогда
![]()
Полная работа перехода 1 - 2 равна
![]() .
(1)
.
(1)
Определим
отношение
![]() ,
решив систему уравнений:
,
решив систему уравнений:
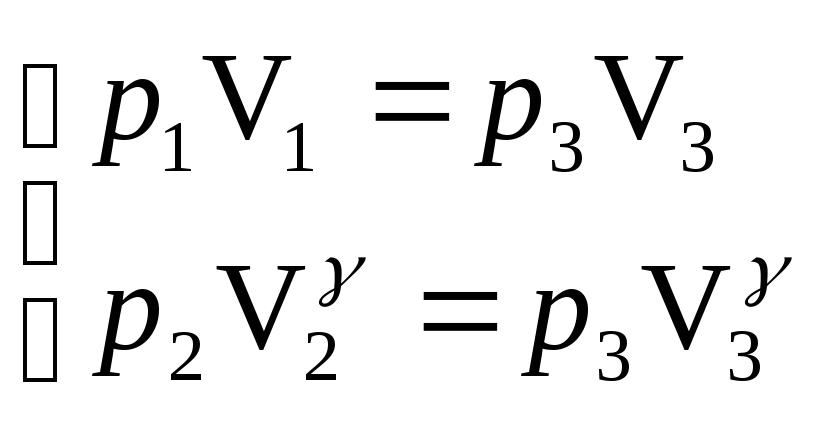 .
.
Разделим второе уравнение на первое:
![]()
Домножив
и разделив левую часть равенства на
![]() ,
получим
,
получим

Тогда
 (2)
(2)
Полученное выражение (2) подставим в формулу работы (1)

![]() отсюда
отсюда
![]()
= 1,4 (двухатомный газ).
= 1,4 (двухатомный газ).
Окончательно

После подстановки
 Дж.
Дж.
Ответ: А1-2 = 203 Дж.
Задача
8. При
адиабатическом сжатии кислорода массой
т
= 20 г его внутренняя энергия увеличилась
на 8360 Дж и температура повысилась до t2
= 643 0С.
Найти: 1) повышение температуры Т;
2) конечное давление газа
![]() ,
если начальное давление
,
если начальное давление![]() = 2 атм.
= 2 атм.
Д
В
адиабатическом процессе нет теплообмена
c
окружающей средой, следовательно, Q
= 0, U
=
A.
Работу совершают внешние силы, изменение
внутренней энергии положительно,
температура растет
U
=

![]() RT.
RT.
т = 20 г = 2 . 10–2 кг
=
32 . 10–3
![]()
i = 5
U = 8360 Дж
t2 = 643 0С; Т2 = 916 К
![]()
 =
2 атм = 2 . 105
Па
=
2 атм = 2 . 105
Па
Т
- ?
![]() - ?
- ?
1) Тогда

Вычисление:
![]() К
= 648 К.
К
= 648 К.
2) Запишим уравнение адиабаты в виде
![]() ,
,
то есть

![]() К.
К.
Подставив числовые данные, получим
![]() Па.
Па.
Ответ:
Т
= 648 К;
![]() = 2,76. 107
Па.
= 2,76. 107
Па.
Качественные задачи
Задача 1. Изобразить для идеального газа примерные графики изохорического, изобарического, изотермического и адиабатического процессов на диаграммах: а) р, V; б) Т, V; в) р, Т. Графики изобразить проходящими через общую для них точку.
Задача 2. На рис.21.6 изображены две изотермы для одной и той же массы идеального газа. Какая из температур больше?
Задача 3. На рис. 21.7 изображены пять процессов, протекающих с идеальным газом. Как ведет себя внутренняя энергия газа в ходе каждого из процессов?


Задача 4. Изобразить для идеального газа примерные графики: а) изохорного, изобарного, адиабатического процессов на диаграмме U, Т; б) изохорного, изобарного, изотермического и адиабатического процессов в координатах U, V и U, р. U откладывать по оси ординат. Исходное состояние общее для всех процессов. U – внутренняя энергия.
Задача 5. Температура одного моля идеального газа с известным повышается на Т в изобарном и адиабатическом процессах. Определить приращение внутренней энергии идеального газа в этих случаях.
Задача 6. Чему равна теплоемкость С идеального газа при: а) изотермическом; б) адиабатическом процессе.
Задача 7. Как изменится температура идеального газа при адиабатическом расширении? сжатии?
Задача 8. Температура газа в адиабатическом процессе уменьшилась на Т = 50 К. Как изменился объем газа? Как изменилась его внутренняя энергия? Какую работу совершил газ?
