
- •Занятие 21
- •Краткие теоретические сведения и основные формулы Первое начало (закон) термодинамики выражает закон сохранения энергии:
- •На основании первого начала термодинамики
- •Адиабатный процесс
- •Работа, совершаемая газом при адиабатном процессе:
- •Теплоемкость одного моля и удельная теплоемкость при постоянном давлении
- •Метод решения задач
- •I часть Примеры решения задач
- •Решение
- •Задачи для самостоятельного решения
- •II часть Примеры решения задач
- •Сила удара молекулы о стенку будет равна
- •Давление газа на стенки сосуда
- •Из основного уравнения молекулярно-кинетической теории
- •Решение
- •Тогда работа
- •Вычислим
- •Решение
- •Решение
- •Качественные задачи
- •Задачи для самостоятельного решения
Решение
При
построении графика нужно учесть: 1) газ
сжимается, т. е. V2
< V1
1 - 2 - адиабата; 2) в процессе охлаждения
V2
= V3
= const,
следовательно, процесс изохорный,
давление р
уменьшается; 3) так как по условию
Т3
= Т1,
то через точки 1 и 3 можно провести
изотерму. При решении используем
уравнение изотермы рV
= const,
или
![]() V1
=
V1
=
![]() V2
(V2
= V3,
так как процесс 2 - 3 изохорный).
V2
(V2
= V3,
так как процесс 2 - 3 изохорный).
Тогда
![]() м3.
м3.
Давление
![]() найдем из уравнения адиабаты:
найдем из уравнения адиабаты:
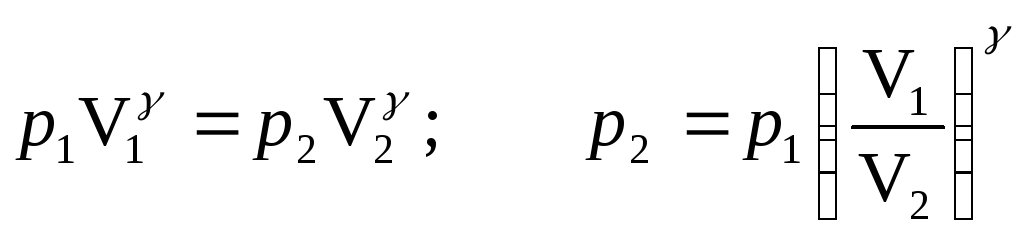 .
.
Показатель
адиабаты
![]() ,
так какi
= 5 (газ двухатомный).
,
так какi
= 5 (газ двухатомный).
![]() Па.
Па.
Ответ: V2 = 0,25 . 10–3 м3; Р2 = 1,32 . 105 Па.
Задача 4. В сосуде под поршнем находится гремучий газ, занимающий объем 10–4 м3 при нормальных условиях. При быстром сжатии газ воспламеняется. Найти температуру воспламенения гремучего газа, если работа сжатия равна 47,3 Дж.
Д ано:Решение
ано:Решение
V
Гремучий
газ представляет собой смесь двухатомных
газов – кислорода и водорода, число
степеней свободы i
= 5.
Процесс
сжатия проходит быстро, теплообмен с
окружающей средой не успевает произойти,
следовательно, Q
= 0, т. е. процесс можно считать
адиабатическим.
![]() =
105
Па
=
105
Па
Т1 = 273 К
А = 47,3 Дж
= 47,3 Дж
Т2 - ?
Применив первое начало термодинамики к адиабатическому процессу, получим
Q = 0; U = A.
Сжатие совершают внешние силы, работа внешних сил считается отрицательной; внутренняя энергия газа возрастает за счет совершенной внешними силами работы. Температура газа повышается
![]() ,
,
где Т = Т2 – Т1.
Тогда работа
![]()
Согласно уравнению Менделеева – Клапейрона,
![]()
откуда
![]()
Тогда
![]()
![]() К.
К.
Ответ: Т2 = 775 К.
Задача
5. Автомобильная
шина была накачана до давления
![]() =
2,2 атм при температуреt1
= 15 0С;
во время движения она нагрелась до t2
= 55 0С
и лопнула. На сколько градусов охладился
вышедший из шины воздух (процесс считать
адиабатическим).
=
2,2 атм при температуреt1
= 15 0С;
во время движения она нагрелась до t2
= 55 0С
и лопнула. На сколько градусов охладился
вышедший из шины воздух (процесс считать
адиабатическим).
Д ано:Решение
ано:Решение
По
условию задачи в шине протекают два
процесса: 1) изохорное нагревание (V
= const),
2) адиабатное расширение (Q
= 0).
для изохорного
процесса:
![]()
![]() ,
,
t1 = 15 0С; Т1 = 288 К
t2 = 55 0С; Т2 = 328 К
![]()
 =
1 атм
=
1 атм
Т2 - ?
![]() .
(1)
.
(1)
2) для адиабатического процесса
![]() ;
;
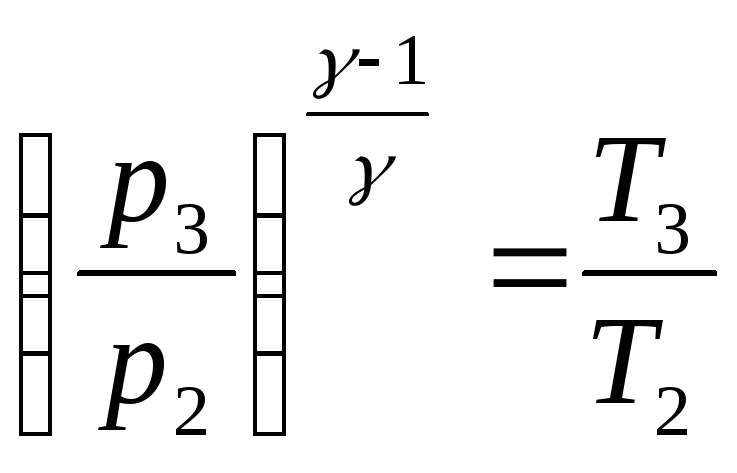 .
(2)
.
(2)
Из уравнения (1)

= 1,4; Т3 – температура после адиабатического расширения.
Вычислим
![]() ;
;
Т3 = 0,76 . Т2 = 250 К;
Т2 = Т3 – Т2 = (250 – 328) К = – 78 К.
Ответ: воздух охладился на 78 К.
Задача 6. Чему равна теплоемкость идеального газа в изотермическом и в адиабатическом процессе.
Решение
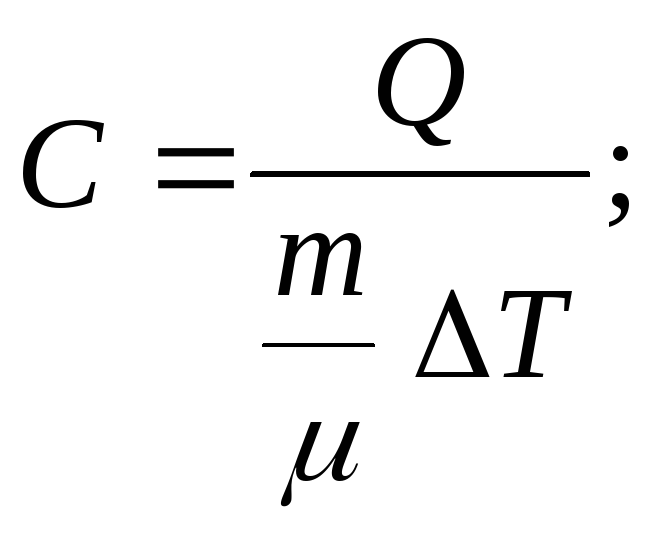
Д ано:
ано:
а) T = const
б) Q = 0
С 1
- ? С2
- ?
1
- ? С2
- ?
а) Т = 0; С1 .
б) Q = 0; С2 = 0.
Ответ: С1 ; С2 = 0.
Задача
7*.
На рис.21.5 показан обратимый переход
идеального двухатомного газа из состояния
1 в состояние 2. Процесс состоит из
изотермического участка 1 - 3 и
адиабатического участка 3 - 2. В начальном
состоянии V1
= 10–3 м3,
![]() =
3. 105
Па в конечном состоянии V2
= 2 . 10–3
м3,
=
3. 105
Па в конечном состоянии V2
= 2 . 10–3
м3,
![]() = 1,33. 105
Па. Вычислить работу, совершенную газом
в процессе перехода 1 - 3 - 2.
= 1,33. 105
Па. Вычислить работу, совершенную газом
в процессе перехода 1 - 3 - 2.
Д ано:
ано:
V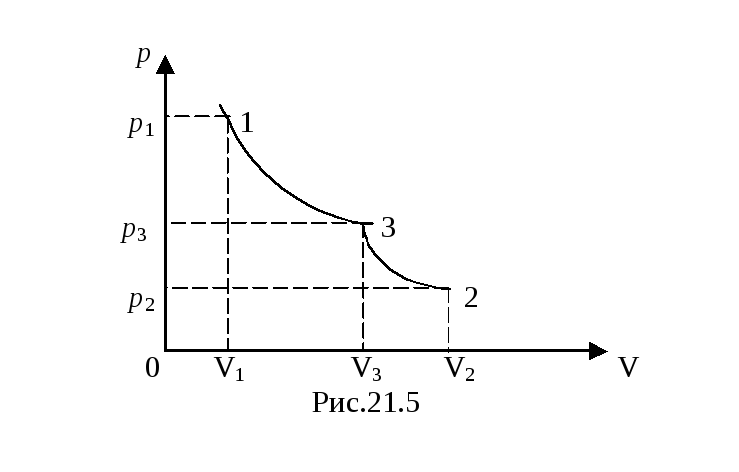 1
= 10–3 м3
1
= 10–3 м3
V2 = 2 . 10–3 м3
![]() =
3 . 105
Па
=
3 . 105
Па
![]() =
1,33 . 105
Па
=
1,33 . 105
Па
А 1-2
– ?
1-2
– ?
