
- •Занятие 21
- •Краткие теоретические сведения и основные формулы Первое начало (закон) термодинамики выражает закон сохранения энергии:
- •На основании первого начала термодинамики
- •Адиабатный процесс
- •Работа, совершаемая газом при адиабатном процессе:
- •Теплоемкость одного моля и удельная теплоемкость при постоянном давлении
- •Метод решения задач
- •I часть Примеры решения задач
- •Решение
- •Задачи для самостоятельного решения
- •II часть Примеры решения задач
- •Сила удара молекулы о стенку будет равна
- •Давление газа на стенки сосуда
- •Из основного уравнения молекулярно-кинетической теории
- •Решение
- •Тогда работа
- •Вычислим
- •Решение
- •Решение
- •Качественные задачи
- •Задачи для самостоятельного решения
I часть Примеры решения задач
Задача 1. 10 г кислорода находятся под давлением 3 . 105 Па при температуре 100С. После нагревания при постоянном давлении газ занял объем 10 л. Найти: 1) количество тепла, полученное газом; 2) изменение внутренней энергии газа; 3) совершенную газом работу.
1.
р
= const;
процесс изобарный.
2.
Q
= U
+ A,
где Q
– количество тепла, сообщенное газу;
U
– изменение внутренней энергии газа;
А
– совершенная газом работа.
3. а) Элементарная
работа
Решение
![]()
Д ано:
ано:
т = 10 г = 10 –2 кг
=
32 .
10-3
![]()
р = 3 . 105 Па = const
t = 100 С; Т = 283 К
V 2
= 10 л = 10-2
м3
2
= 10 л = 10-2
м3
А - ? U - ? Q - ?
где р – давление газа; dV – бесконечно малое изменение его объема. Из условия задачи видно, что dV > 0, т.е. газ расширяется, тогда работа А > 0, т.е. работа совершается газом против внешних сил. Полная работа расширения
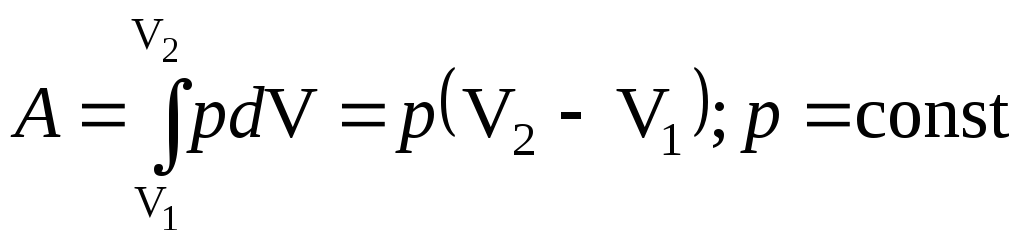 .
.
б) Изменение внутренней энергии равно
![]()
где Т – изменение температуры; i – число степеней свободы молекулы кислорода (i = 5, так как кислород – двухатомный газ).
в) Количество теплоты, полученное газом при нагревании, может быть найдено как сумма А и U, или с помощью молярной теплоемкости Ср:
![]()
4. Решим задачу численно, сделав некоторые преобразования формул и вычислив недостающие параметры газа.
1)
![]() (1)
(1)
Используем два уравнения Менделеева - Клапейрона для состояния 1 и 2:
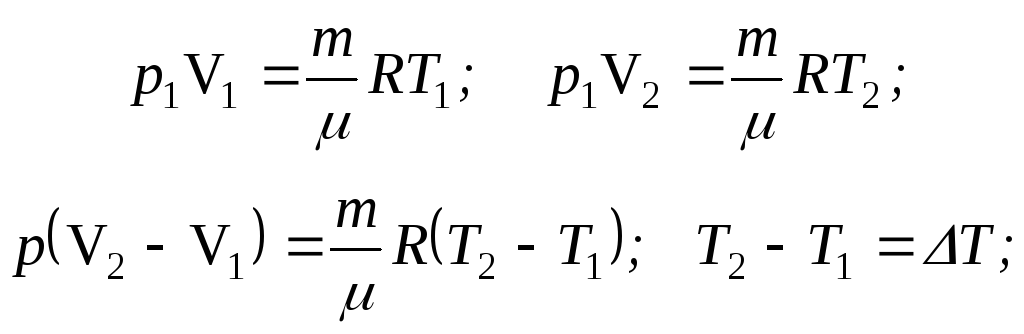
![]() (1')
(1')
(справедливо
только для изобарного процесса)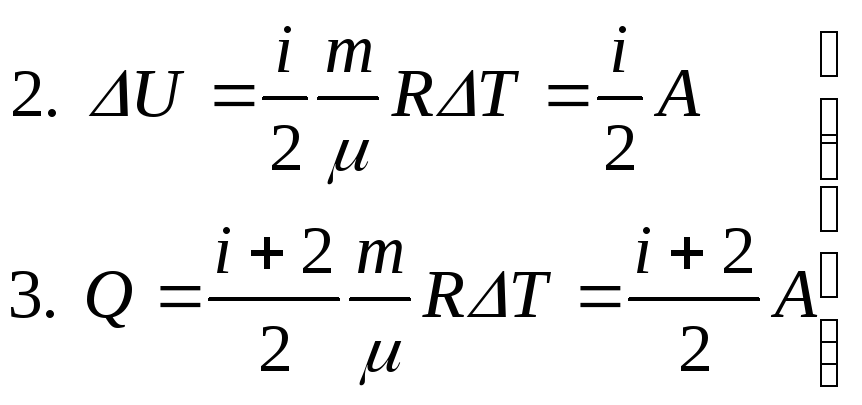
Найдем
Т:
Т
= Т2
– Т1;
![]() - из уравнения Менделеева - Клапейрона
для второго состояния.
- из уравнения Менделеева - Клапейрона
для второго состояния.
Т
= Т2
– Т1
=![]()
Тогда работа
![]() Дж.
Дж.
Изменение внутренней энергии
![]() Дж.
Дж.
Количество теплоты
![]() Дж.
Дж.
Можно определить работу по формуле (1); для этого нужно найти объем газа V1 из уравнения состояния:
![]() .
.
Ответ: А = 2265 Дж; U = 5660 Дж; Q = 7920 Дж.
Задача 2. В закрытом сосуде объемом V = 10 л находится воздух при давлении 105 Па. Какое количество теплоты нужно сообщить газу, чтобы повысить его давление в 5 раз?
Д ано:Решение
ано:Решение
V = 10 –2 м3 1) Из условия задачи следует, что процесс изохорный,
р1 = 10 5 Па так как сосуд закрытый. Следовательно, V = const.
р2 = 5р1 2) Q = U + A – первое начало термодинамики.
i = 5 3) Применим I
начало к изохорному процессу:
= 5 3) Применим I
начало к изохорному процессу:
Q
- ? а)
![]() следовательноА
= 0;
следовательноА
= 0;
б)
![]() ;
;
в)
![]() .
.
4. Вычислим разность температур, пользуясь уравнениями состояния для 1 и 2 состояний:
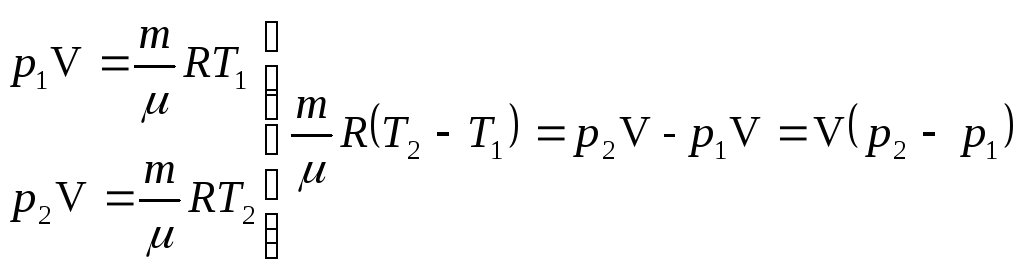 .
.
Тогда
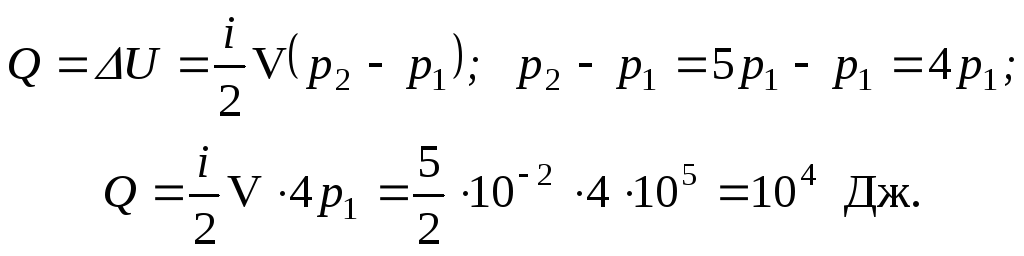
Ответ: Q = 104 Дж.
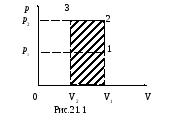
Задача 3. Некоторая масса азота при давлении р1 = 1 атм имела объем V1 = 5 л, а при давлении р2 = 3 атм – объем V2 = 2 л. Переход от первого состояния ко второму сделан в два этапа – сначала по изохоре, затем по изобаре. Определить изменение внутренней энергии, количество теплоты и произведенную работу.
Д ано:Решение
ано:Решение
 =
28 .
10-3
=
28 .
10-3
![]()
i = 5
p1 = 1 атм = 105 Па
р2 = 3 атм = 3 . 105 Па
V1 = 5 л = 5 . 10-3 м3
V2 = 2 л = 2 . 10-3 м3
 U
- ? A
- ? Q
- ?
U
- ? A
- ? Q
- ?
1) V = const – I процесс; р = сonst – II процесс.
I процесс – изохорное нагревание; II процесс – изобарное сжатие.
2) Первое начало термодинамики
![]()
3)
а)
![]() ;
;
![]()
Работа в изобарном сжатии на участке 2-3 отрицательна, так как объем газа уменьшается, газ сжимается под действием внешних сил:
![]() .
.
б)
![]()
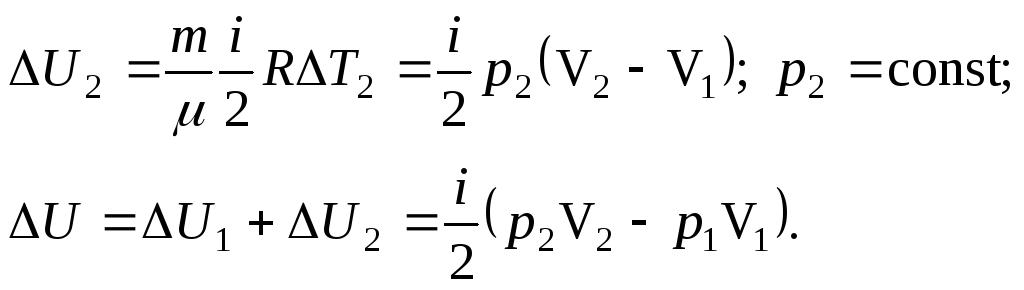
Изменение внутренней энергии зависит только от начального и конечного состояния системы и не зависит от пути перехода.
в) Q = U + A.
Вычисления:
![]()
– работу совершают внешние силы.
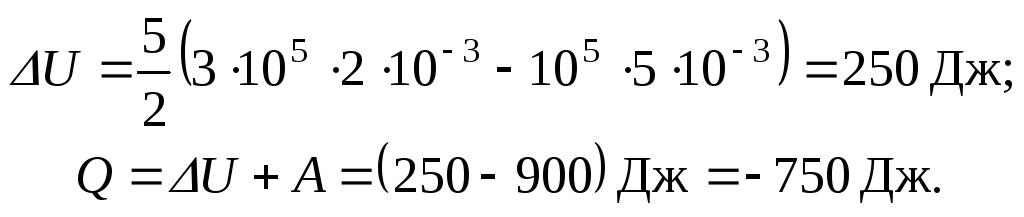
Работа совершается над газом, тепло отводится от газа, газ нагревается (U > 0).
Ответ: А = -900 Дж; U = 250 Дж; Q = -750 Дж.
Задача
4. Один моль
воздуха при давлении р1
= 106
Па и температуре Т1
= 390 К изохорически изменяет давление
так, что его внутренняя энергия изменяется
на U
= - 71,7 Дж, а затем изобарически расширяется
и совершает работу А
= 745 Дж. Определить параметры воздуха,
если удельная теплоемкость
![]()
= 28 .
10-3
= 28 .
10-3
![]() .
.

Дано: Решение
![]() моль
I.
В задаче рассматриваются два процесса:
моль
I.
В задаче рассматриваются два процесса:
=
28 .
10-3
![]() 1) V = const и
2) р
= const.
1) V = const и
2) р
= const.
Т1 = 390 К II. Рассмотрим I процесс (изохорный) (рис. 21.2):
р
р
р1
1 Т1
р2
2 Т2
3
Т3
0
V1
V2
V
Рис.21.2
 1
= 106 Па
1
= 106 Па
U = -71,7 Дж
А
 = 745 Дж
= 745 Дж
![]()



Т 2
- ? Т3
- ?
2
- ? Т3
- ?

а)
![]() .
.
б) Q1= U1 – первое начало в изохорном процессе.
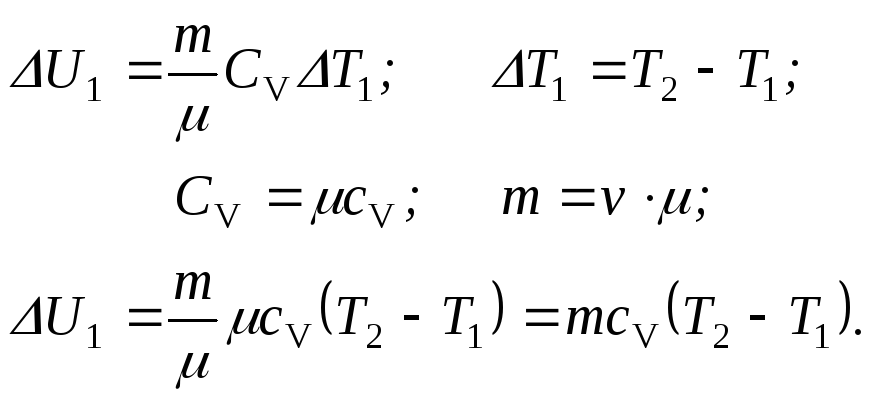
Тогда

III. Второй процесс – изобарное расширение:
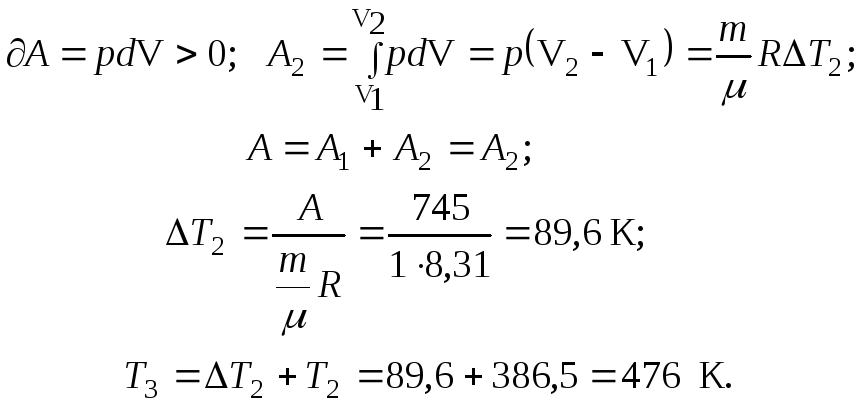
Из уравнения состояния идеального газа и законов Гей-Люссака и Шарля можно получить остальные параметры:
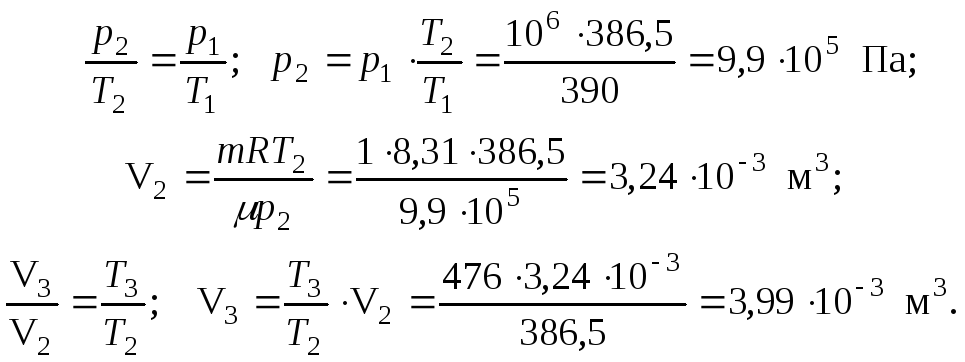
Ответ: р2 = 9,9 . 105 Па; Т2 = 386,5 К; V2 = 3,24 . 10-3 м3; р3 = р2; Т3 = 476 К; V3 = 3,99 . 10-3 м3.
Задача 5. 10,5 г азота изотермически расширяются при температуре –23 0С от р1 = 2,5 атм до р2 = 1 атм. Найти работу, совершенную при расширении, изменение внутренней энергии и количество тепла, переданное газу.
Д ано:Решение
ано:Решение
т
По
условию задачи T
= const,
процесс изотермический
Q
= U
+ A.
a)
A
= pdV;
dV
> 0; A
> 0; б)
в) Q
= A
все переданное газу тепло идет на работу
газа против внешних сил.
![]() ;
;
=
28 .
10-3
![]()
t1 = -230 C; T1 = 250 К
р1 = 2,5 атм = 2,5 . 105 Па
р2 = 1 атм = 1 . 105 Па
А - ? U
- ? Q
- ?
- ? U
- ? Q
- ?
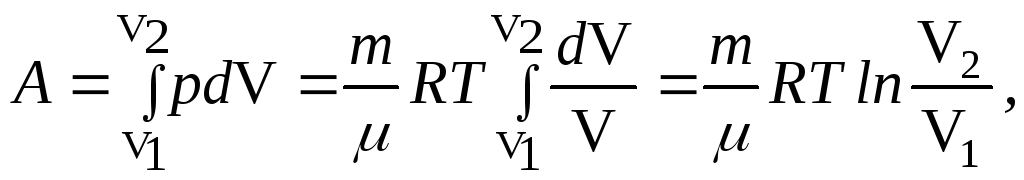
так
как процесс изотермический, то
![]() т.е.
т.е.![]()
![]()
Ответ: А = 713,8 Дж.
Задача 6. 7 г углекислого газа СО2 было нагрето на Т = 10 К в условиях свободного расширения. Найти работу расширения газа и изменение его внутренней энергии.
Д ано:Решение
ано:Решение
i
1)
Свободное расширение газа означает,
что его давление не изменяется, т.е. p
= const,
процесс изобарный. 2)
Q
= U
+ A;
a)
![]() ;
;
m = 7 . 10-3 кг
=
44 .
10-3
![]()
Т = 10 К
А
- ? U
- ? 
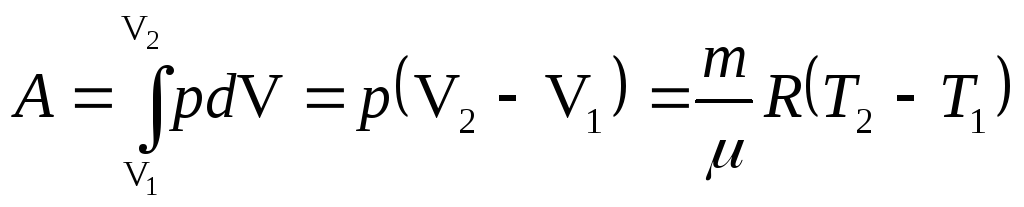 ;
;
T2 – T1 = T;
б)
![]() .
.
Вычисления:
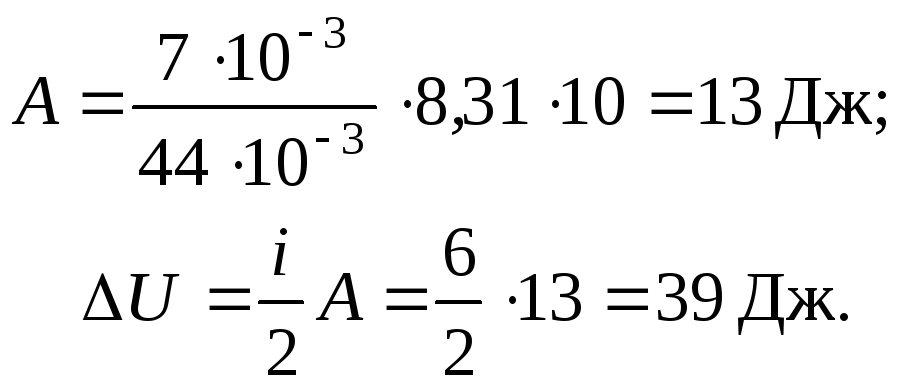
Ответ: А = 13 Дж; U = 39 Дж.
