
- •Передмова
- •Розділ 1. Фізичні процеси в електроізоляційних матеріалах
- •1.1. Будова речовини. Класифікація електроізоляційних матеріалів
- •1.2. Загальні поняття про електротехнічні матеріали
- •1.2. Фізична суть провідності діелектриків
- •1.4. Поляризація діелектриків
- •1.5. Діелектрична проникність
- •Якщо то
- •1.6. Діелектричні втрати
- •Для паралельної схеми:
- •1.7. Пробій діелектриків
- •1.8. Теплові властивості ізоляційних матеріалів
- •1.9. Запитання до самоконтролю
Передмова
Однією із важливих умов стабільного розвитку промисло-вості України є надійне функціонування систем електропостачання. Сучасна електроенергетика використовує в елементах конструкцій надзвичайно широкий спектр різноманітних електротехнічних матеріалів. Від їх властивостей і правильного вибору залежить ефективність роботи електроенергетичного обладнання. Тому актуальним завданням сьогодення є забезпечення систем електроспоживання якісним обладнанням та розробка і впровадження нових, більш якісних матеріалів з кращими функціональними й експлуатаційними характеристиками.
При проектуванні та розробці нових електротехнічних пристроїв і обладнання з покращеними характеристиками знання електрофізичних, фізико-технічних та механічних властивостей використовуваних матеріалів є обов'язковою умовою раціонального вирішення цього завдання. Забезпечення високої надійності роботи електроенергетичного обладнання грунтується насамперед на чітких уявленнях про процеси, що відбуваються в матеріалах протягом їх експлуатації, знаннях про методи профілактичного контролю та випробування електротехнічних виробів, вимогах діючих ДСТУ, нормативних та технічних умовах їх використання. Це є запорукою надійної роботи електричних мереж і комплексу електроенергетичного обладнання.
Використання ізоляційних матеріалів з високими діелектричними властивостями, високою робочою температурою зменшує малогабаритні показники електротехнічних пристроїв, а значить дає змогу підвищувати їх ККД за рахунок зменшення втрат.
В наш час нові електротехнічні матеріали створюються в результаті як глибокого вивчення фізико-технічних характеристик, так і удосконалення технології виготовлення і широкого викорис-тання нових, раніше незастосовуваних в техніці видів сировини. На перше місце у вітчизняній електротехніці ставиться швидке удосконалення якості матеріалів, їх правильний вибір, коли вони використовуються як провідники, діелектрики, напівпровідники або магнітні матеріали. Тому для розуміння властивостей матеріа-лів, а також інших особливостей потрібно досліджувати їх струк-туру і будову. Поєднання основних вимог з реальними можливос-тями виробництва забезпечить якість матеріалів, їх технологічність і високі параметри.
Розділ 1. Фізичні процеси в електроізоляційних матеріалах
1.1. Будова речовини. Класифікація електроізоляційних матеріалів
Всі відомі речовини в природі складаються з елементарних частинок: протонів, нейтронів і електронів. З протонів і нейтронів складаються атомні ядра. Електрони заповнюють оболонки атомів, утворюючи додатній заряд ядра. В квантовій механіці рух електрона описується хвильовою функцією, що володіє в ізольованому атомі сферичною симетрією.
У речовинах об’єднання декількох атомів умолекулу досягається за рахунок електронів, що є загальними для всіх атомів. При цьому електронна оболонка між додатно зарядженими ядрами є найбільшою, що зв’язує їх в молекулу (ковалентний зв’язок).
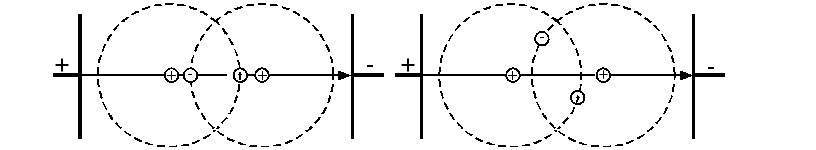
Для оцінки електричних властивостей, а також гігроскопіч-ності, адгезійних властивостей та інших дуже важливий поділ матеріалів на полярні (дипольні), молекули яких завжди мають деякий, відмінний від нуля електричний момент інеполярні (нейтральні), молекули яких здатні отримувати індукований електричний момент тільки під дією зовнішнього електричного поля (рис.1.1.). Якщо центри додатніх і від'ємних зарядів в електричному полі співпадають з напрямом силових ліній, то молекули нейтральні. Якщо центри зарядів не співпадають і знаходяться на деякій відстані один від одного, то такі молекули є полярними або дипольними (рис.1.2.).
|
Рис.1.1. Нейтральний ковалентний зв'язок. |
Рис.1.2. Полярний ковалентний зв'язок. |
За агрегатним станом електроізоляційні матеріали поділяю-ться на тверді (найбільш чисельна група), рідкі і газоподібні. Особ-лива група – твердіючі матеріали, які у вихідному стані при введенні їх у виготовлювану ізоляцію, є рідинами, але потім твердіють і в готовій ізоляції є твердими тілами (лаки, компаунди).
За хімічним складом електроізоляційні матеріали поділя-ються на органічні – з’єднання вуглецю з воднем, азотом, киснем і деякими іншими елементами, а також неорганічні.
Багато з органічних електроізоляційних матеріалів Володі-ють цінними механічними властивостями – гнучкістю,та еластич-ністю. З них можуть бути виготовлені волокна, плівки та вироби інших різноманітних форм, тому вони знайшли широке засто-сування в техніці. Однак такі матеріали,як правило,мають віднос-но низьку нагрівостійкість.
Неорганічні матеріали в більшості випадків не мають гнуч-ких та еластичних властивостей. Вони є хрупкими, що робить тех-нологію їх обробки неможливою. Але неорганічні ізоляційні мате-ріали мають набагато вищу нагрівостійкість, а тому успішно засто-совуються в тих електротехнічних установках, де необхідно за без-печити високу робочу температуру ізоляції.
Особлива група – елементоорганічні, в основу будови яких входять, крім вище названих елементів, елементи, які не входять до звичайних органічних речовин – це атоми Si,Mg,Al,Tiта інші. Як правило неорганічні матеріали мають більш високу нагрівостійкість, ніж органічні матеріали.
Важливий також поділ діелектриків на гетерополярні(іон-ні),молекули яких досить легко дисоціюють на іони ігомеополярні, для яких дисоціація на іони не характерна.
Розглянемо найважливіші види зв’язків, за рахунок яких відбувається об’єднання атомів у молекули.
Ковалентний зв’язок характеризуєтьсяутвореннямстійких електронних пар із електронів, що раніше належали окремим атомам. Ці пари стають спільними для атомів, що входять в склад молекул. Електрони при русі по молекулярній орбіті найчастіше знаходяться поміж ядрами, де створюється надлишок від’ємного заряду, що сприяє зближенню атомів.Якщо двохатомна молекула складається із атомів одного елементу (Н2,N2, Сl2), то електронна пара належить обом атомам. В цих випадках молекулу та існуючий в ній ковалентний зв’язок називають неполярними. Якщо двохатомна молекула складається з атомів різних елементів, то електронна пара може бути зміщена до одного з атомів. В таких випадках ковалентний зв’язок називається полярним, а молекули з полярним зв’язком, в яких центри додатних і від’ємних зарядів не співпадають називаються полярними або диполярними.
Дипольна молекула характеризується величиною електричного дипольного моменту М
![]() (1.1)
(1.1)
де q– величина заряду;l– віддаль між центрами додатного і від’ємного заряду.
Багатоатомні молекули також можуть бути неполярними (при симетричному розташуванні),наприклад,поліетилен або полярними – при асиметричному розташуванні зарядів (наприклад, полівінілхлорид).
Речовини, що утворені молекулами з ковалентним зв’язком, характеризуються високою твердістю. Вони тугоплавкі і хімічно інертні, що пояснюється міцністю ковалентних зв’язків. Ковален-тний зв’язок існує в молекулах алмазу, кремнію і деяких неорганічних сполуках.
Донорно-акцепторний зв’язок є різновидом ковалентного зв’язку.Він виникає між атомами елементів, один з яких здатний віддавати електрон (донор), а другий здатний приймати ці елект-рони (акцептор). Прикладом є арсенід галію (GaAs), а також сполуки між елементами третьої і п’ятої групи періодичної системи Менделєєва.
Іонний зв’язок зумовлений силами електростатичного притягання між додатними і від’ємними іонами. Тверді тіла іонної структури характеризуються підвищеною механічною міцністю і відносно високою температурою плавлення. Сюди відносять коло-їдні системи лужних металів. Іонні сполуки утворюють різні завластивостями матеріали – типові метали і типові неметали (хлори-стий цезій і титанат барію).
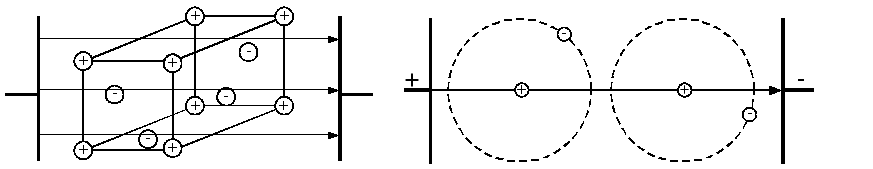
Металічнийзв’язок між атомами (рис.1.3.) спостерігається в металах. Метали розглядаються як системи, побудовані з додатніх іонів, що знаходяться у вузлах кристалічної решітки. Наявність вільних електронів призводить до високої електропровідності і теплопровідності і є також причиною блиску металу при зрізі. Ковкість металів пояснюється переміщенням і ковзанням окремих шарів іонів.
|
Рис.1.3. Металічний зв’язок. |
Рис.1.4. Молекулярний зв'язок. |
Молекулярнийзв’язок (зв’язок Ван-дер-Ваальса) (рис.1.4.) існує в деяких речовинах між молекулами з ковалентними внутрі-молекулярними зв’язками. Міжмолекулярне притягання в цьому випадку зумовлюється узгодженим рухом валентних електронів у сусідніх молекулах. В будь-який момент часу електрони максима-льно віддалені один від одного і максимально наближені до пози-тивних зарядів. При цьому сили притягання валентних електронів додатньо зарядженими сусідніми молекулами є сильнішими сил взаємного відштовхування електронів зовнішніх орбіт. Такий вид зв’язку характерний для парафіну, що має низьку температуру плавлення із-за неміцності кристалічної решітки.
