
Metod_Medical_chem_1_Med_M-2
.pdf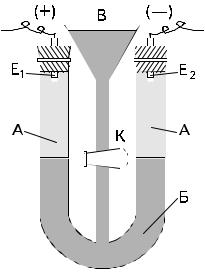
Рис 7.1 Схема приладу для електрофорезу:
А – проміжна рідина; Б – золь; В – лійка; Е і Е – електроди; К – кран.
4)За допомогою дротинки прочистити нижній кінець трубки під лійкою В та видалити можливі бульбашки повітря.
5)Злегка відкрити кран К, щоб золь з лійки повільно витікав в низ U- подібної трубки та в обох колінах сформувати чітку межу між золем і проміжною рідиною, яка легша за нього.
6)Додавши в лійку ще трохи золю, вивести межу поділу між ними і проміжною рідиною напроти цифрових поділок на шкалі Ш.
7)Закрити кран К і записати положення межі золю в обох колінах відповідно до шкал Ш (вони можуть не співпадати).
8)Ввімкнути струм. Коли стрілка вольтметра покаже напругу між електродами, відзначити на годиннику час початку електрофорезу.
9)Записати величину напруги Е за прямими показами вольтметра, або розрахувати її, якщо шкала цього приладу має умовні поділки. При цьому звернути увагу, яка саме напруга (300, 450 В чи інша) подається від випрямляча на електрофорез та на якій саме поділці зупинилася стрілка вольтметра.
10)Закінчити електрофорез, вимкнути струм через 5–10 хв (коли межа золю в коліні опуститься на 5–7 мм – шкала Ш). Записати час закінчення електрофорезу та визначити тривалість проходження струму t.
11)За різницею положень межі золю визначити зміщення частинок золю (S). Відзначити, в якому напрямку, до якого електрода зміщувалась межа золю при електрофорезі. Зробити висновок про знак заряду на гранулах дослідженого колоїдного розчину.
12)Після вимкнення струму виміряти за допомогою нитки та лінійки відстань l між електродами (за ходом струму в U-подібній трубці.
13)Вилити розчин з U-подібної трубки, сполоснути її водою.
14)Коротко описати хід виконаної роботи й обчислити результати.
15)Перевести усі виміряні величини у систему СІ, підставити їх у формулу
71

Гельмгольца-Смолуховського для обчислення z-потенціалу:
ζ = η × l × S
τ × D × E ×ε .
Крім уже згаданих величин 1 (м), S (м), t (с), Е (В), взяти в’язкість η = 10–3 Па×с та діелектричну константу D = 81 для води, а також абсолютну діелектричну проникність вакууму ε = 8,85×10–12 Ф/м.
16)Перерахувати одержане значення z у вольтах на мілівольти (мВ).
17)Зробити висновок про знак заряду гранул для дослідженого золю та вказати, чи він стійкий, порівнявши одержане значення дзета-потенціалу з критичним значенням (30 мВ).
5.Підведення підсумків та зарахування роботи
Заняття № 8
Тема: Стійкість колоїдно-дисперсних систем. Електролітна коагуляція та колоїдний захист
1. Актуальність теми
Ліофобні золі, для яких характерні високорозвинена поверхня і слабка взаємодія дисперсної фази і дисперсійного середовища, відрізняються нестійкістю та схильністю до зменшення дисперсності. Стабілізація лікарських форм, що використовуються у вигляді мікстур, суспензій, золів, емульсій і мазей, досягається після набуття частинками дисперсної фази однойменних зарядів, або з допомогою інших факторів. У ряді випадків для боротьби із забрудненням навколишнього середовища, необхідно порушити стійкість дрібних нейтральних частинок, тобто здійснити коагуляцію.
Коагуляція є важливим колоїдно-хімічним процесом як у технології, так і в біологічних явищах (вилучення каучуку з латексів, осадження білків, утворення відкладень у кровоносних судинах, нирках і т.д.).
Важливим фізіологічним явищем живого організму є фактор колоїдного захисту, що запобігає утворенню каміння в органах, а в практичній діяльності допомагає стабілізувати препарати золів срібла, ртуті, радіоактивних ізотопів і т.д.
2. Навчальні цілі:
–навчитися визначати поріг коагуляції золів;
–вміти розраховувати коагуляційну дію електролітів із йонами, що мають різні заряди;
–вміти встановлювати кількісну оцінку захисної дії ВМР при коагуляції гідрофобних золів.
72
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Кінетична (седиментаційна) та агрегативна стійкість дисперсних систем. Фактори стійкості. Коагуляція. Механізм коагулюючої дії електролітів. Поріг коагуляції. Правило Шульце-Гарді. Взаємна коагуляція. Процеси коагуляції при очистці питної води та стічних вод.
3.2. Блок інформації
Стійкість дисперсної системи – це здатність її протягом певного часу зберігати незмінним склад та основні властивості: дисперсність, концентрацію, розподіл частинок дисперсної фази у певному об’ємі дисперсійного середовища та характер взаємодії між частинками.
Коагуляція – це процес злипання, агрегації частинок дисперсної фази і в кінцевому висновку випадання фази в осад. Коагуляцію можна викликати дією різних зовнішніх чинників – підвищенням чи зниженням температури, перемішуванням, опромінюванням, додаванням хімічних речовин та іншими.
Найбільш вивченим процесом є коагуляція ліофобних золів. Коагулюючу дію мають йони з протилежним відносно гранули зарядом, або однаковий з протийонами (правило Шульце-Гарді). Кожний електроліт характеризується пороговою концентрацією, тобто тією найменшою концентрацією, вираженою в ммолях, яку необхідно додати до 1 л колоїдного розчину, щоб викликати коагуляцію (Ск). Величина, обернена до порогу коагуляції, називається коагулюючою здатністю: Р = 1/Ск.
Згідно з правилом Шульце-Гарді, критична концентрація йона коагулянта (Ск) зменшується зі збільшенням його валентності, а коагулююча дія збільшується:
PAl3+ > PCa 2+ > PK+ .
Такий же ліотропний ряд можна записати і для аніонів:
PPO34− > PSO 24− > PCl − .
У ряді неорганічних йонів із однаковим зарядом їх коагулююча дія збільшується зі зменшенням радіуса гідратованого йона.
Ліотропні ряди, або ряди Гофмейстера:
коагулююча дія |
|
коагулююча дія |
|
|
|
Li+ < Na+ < K+ < Rb+ < Cs+ |
CI– < Br– < I– < CNS– |
|
ступінь гідратації |
|
ступінь гідратації |
Згідно з правилом Траубе, в гомологічних рядах з органічними йонами коагулююча здатність рівномірно збільшується з появою нових СН2 – груп.
Стабілізація золів в умовах дії електролітів досягається додаванням до них невеликої кількості високомолекулярних речовин (ВМР). Захисна дія ВМР відносно певного золю характеризується захисним числом, тобто кількістю
73
міліграмів сухої ВМР, яку необхідно додати до 10 см3 досліджуваного золю, щоб захистити його від коагуляції одним мілілітром 10% розчину хлориду натрію.
3.3.Література
1.Мороз А.С. , Луцевич Д.Д. , Яворська Л.П. Медична хімія (2-ге вид.).– Вінниця: Нова Книга, 2008.– С. 658–675.
2.Медицинская химия/ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук.– К.: Медицина, 2008.– С. 285–304.
3.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994. – С. 216-230.
4.Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая хи-
мия. – Київ: Вища школа, 1986.– С.222-237.
3.4.Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.Що таке коагуляція? Які фактори можуть її спричинити?
2.Що таке поріг коагуляції? В яких величинах виражають його значення?
3.Сформулюйте правило Шульце-Гарді, поясніть його на окремих прикладах.
4.Яке явище називається колоїдним захистом? Що є кількісною характеристикою захисної дії?
5.Яка роль колоїдного захисту в біології, медицині, фармації? Наведіть приклади.
6.Які ефекти спостерігаються при коагуляції сумішшю електролітів?
7.Чим пояснити взаємну коагуляцію золів?
8.Які причини сенсибілізації при додаванні до золю високомолекулярної речовини?
б) Задачі для самоконтролю
Алгоритми розв’язування типових задач
Задача 1. Для коагуляції 2 см3 золю AgI необхідно додати 0,4 см3 0,005 М розчину BaCl2. Знайти поріг коагуляції цього золю.
Алгоритм розв’ язання
5.Розраховуємо кількість ммоль BaCl2, що міститься в 0,4 см3 0,05 М розчину.
ν= 0,05 моль/л × 0,4 см3 = 0,02 ммоль.
6.Загальний об’єм розчину після коагуляції:
V= 2 + 0,4 = 2,4 см3 = 2,4×10–3 л.
7.Знайдемо поріг коагуляції – мінімальну кількість ммолів BaCl2, що необхідна для коагуляції 1 л золю:
|
ν |
0,02 |
|
|
|
|
|
= |
|
= 8,3 |
ммоль/л. |
|
V |
2,4 ×10−3 |
|||
74

Задача 2. У скільки разів зменшиться поріг коагуляції золю As2S3, якщо для коагуляції, замість 0,5 М розчину NaCl (його потрібно 1,2 см3 на 10 см3 золю) використати 0,4 см3 0,036 М розчину MgCl2 або 0,1 см3 0,001 М розчину AlCl3 на досягнення коагуляції тих же 10 см3 золю.
Алгоритм розв’ язання
1.Кількість ммоль (ν) кожного електроліту, що витрачається на коагуляцію
10 см3 золю Ag2S3:
ν1 = С1×V1 = 0,5 × 1,2 = 0,6 ммоль NaCl;
ν2 = С2×V2 = 0,036 × 0,4 = 0,0144 ммоль MgCl2; ν3 = С3×V3 = 0,01 × 0,1 = 0,001 ммоль AlCl3.
2. Загальні об’єми розчинів золю й електроліту-коагулянта (V):
V1 = Vзолю + V1 = 10 + 1,2 = 11,2 см3 = 11,2×10–3 л;
V2 = Vзолю + V2 = 10 + 0,4 = 10,4 см3 = 10,45×10–3 л; V3 = 10,1×10–3 л. 3. Пороги коагуляції для кожного електроліту:
П1 |
= |
|
|
ν1 |
= |
|
0,6 |
|
|
= 53,6 ммоль/л NaCl; |
||
V11 |
11,2 ×10 |
−3 |
||||||||||
|
|
|
|
|||||||||
П = |
|
ν2 |
|
= |
0,0144 |
|
= 1,4 ммоль/л MgCl ; |
|||||
|
|
|
|
|
|
|
|
|||||
2 |
V21 |
|
10,4 ×10 |
−3 |
2 |
|||||||
|
|
|
||||||||||
П = |
ν3 |
|
= |
0,001 |
|
|
= 0,1 ммоль/л AlCl . |
|||||
|
|
|
|
|
|
|
||||||
3 |
|
V31 |
|
10,1×10−3 |
3 |
|||||||
|
|
|
|
|||||||||
4. У скільки разів пороги коагуляції золю As2S3 для електролітів MgCl2 і AlCl3 менші, ніж для NaCl ?
П1 |
= |
53,6 |
= 38,3 раза для MgCl2; |
|
|
||
П2 |
1,4 |
|
|
П1 = 53,6 = 536 разів для AlCl3.
П3 0,1
Задача 3. До 10 см3 0,03 % розчину NaCl додали 25 см3 0,002 М розчину AgNO3. Для вивчення процесу коагуляції до отриманого золю додали такі електроліти: KBr, Ba(NO3)2, K2CrO4, AlCl3, K3PO4. Який з доданих електролітів має найменший поріг коагуляції, а який – найменшу коагуляційну здатність?
Алгоритм розв’ язку
1.Переведемо в молярну концентрацію масову частку (0,03 %) розчину NaCl, враховуючи r = 1 г/мл і М(NaCl) = 58,5 г/моль.
С1 = 0,003×100 = 0,00513 ммоль/см3. 58,5
75

2. Знайдемо об’єм змішуваних розчинів (V):
V = V1 + V2 = 10 + 25 = 35 см3.
3.3. Розраховуємо кількість ммолів (ν) кожної з реагуючих солей:
ν1 = С1×V1 = 0,00513 × 10 = 0,0513 ммоль NaCl; ν2 = С2×V2 = 0,001 × 25 = 0,025 ммоль AgNO3.
4.Згідно з рівнянням реакції:
NaCl |
+ AgNO3 ® AgCl + NaNO3 |
0,0513 |
0,025 |
у надлишку буде сіль NaCl і, отже, вона виступатиме пептизатором золю
AgCl:
{[m(AgCl) × nCl– ]n– × (n – x) Na+}x– × xNa+.
5.У відповідності з правилом Шульце-Гарді, коагуляцію цього золю будуть викликати катіони K+, Ba2+, Mg2+, Al3+, причому поріг коагуляції тим ниж-
чий, чим вищий заряд катіонів. Отже, для солі AlCl3 поріг коагуляції мінімальний. При однаковій нормальності розчинів KBr, K2CrO4 і K3PO4 їх коагуляційна здатність найменша.
Задача 4. Визначити захисне число і поріг коагуляції для золю |
Al2S3 з |
|
від’ємним зарядом гранул, якщо до 5,5 см3 цього золю додали |
||
3,0 |
см3 0,5 % водного розчину декстрину і після додавання 1,5 см3 |
|
2,5 |
М розчину NaCl спостерігали перші ознаки коагуляції. |
|
Алгоритм розв’ язання |
|
|
1. Знайдемо |
кількість мг декстрину, що міститься у 3,0 см3 |
розчину |
(r = 1 г/см), оскільки він розведений. |
|
|
3×0,5 = 0,015 г = 15,0 мг ВМР (декстрину). 100
2.Розраховуємо кількість мг ВМР (декстрину), необхідного для захисту від коагуляції не 5,5, а 10 см3 золю:
на 5,5 см3 золю потрібно 15 мг ВМC
на 10 см3 |
– |
х |
х = 15×10 = 27,3 мг. 5,5
3.Обчислимо масу (m) солі, яка міститься в 1,5 см3 (тобто 0,0015 л) 2,5 М розчину, знаючи молярну масу NaCl (58,5 г/моль):
m = C×V×M = 2,5 × 0,0015 × 58,5 = 0,219 г NaCl;
4.Визначимо захисне число, тобто кількість мг ВМР, яка потрібна для захисту 10 см3 золю від дії 1 см3 10 % розчину (або »0,1 г NaCl). Складаємо про-
порцію:
на 0,219 г NaCl |
треба |
23,3 мг ВМР, |
а на 0,1 г |
– |
х |
76

x = |
27,3×0,1 |
= 12,5 |
(мг ВМР). |
|
|||
0,219 |
|
|
|
5. Розраховуємо фактичний поріг коагуляції золю за умовою задачі:
П = C ×V1 ,
V
де: С – початкова концентрація коагулюючого електроліту, моль/л; V1 – об’єм його розчину, що затрачається, см3 ;
V – сумарний об’єм розчину в момент коагуляції, см3 .
П = |
C ×V1 |
= |
|
2,5 ×1,5 |
|
= 0,375 |
моль/л. |
Vзолю +VВМС +V1 |
|
+ 3,0 + |
|
||||
|
5,5 |
1,5 |
|
|
|||
в) Задачі для самостійного розв’язання
1.Як зміниться величина порогу коагуляції, якщо до 10 см3 золю AgI, замість
1,5 см3 1 М розчину КNO3, витратили 0,5 см3 0,1 М розчину Сa(NO3)2, або
0,2 см3 0,01 М розчину Al(NO3)3 ?
Відповідь: поріг коагуляції зменшиться в 27,4 і 665,2 рази відповідно.
2.Коагуляція від’ємно заряджених гранул золю сульфіду арсену (III) викли-
кана електролітами KNO3, MgCl2 і AlCl3, пороги коагуляції яких становлять відповідно 50,0; 0,72; 0,093 ммоль/л. Як співвідносяться між собою коагулюючі здатності катіонів різного заряду.
Відповідь: співвідношення 1 : 69,4 : 537,6.
3.Яке захисне число для золю гідроксиду феруму (III), якщо на захист 2,0 см3 цього золю від коагуляції 0,2 см3 10 % NaCl витратили 5,0 мг порошкоподібного крохмалю?
Відповідь: 125 мг.
4.Матеріал для аудиторної роботи
4.1. Перелік практичних завдань, які необхідно виконати на практичному занятті:
–написання рівнянь реакції гідролізу;
–вміння титрувати;
–вміння написати будову міцел золів із різними зарядами гранул, які використовують на практичному занятті ;
–вміти проводити розрахунки порогу коагуляції;
–вміти пояснити суть правила Шульце-Гарді.
4.2. Інструкції для виконання практичних завдань
4.2.1. Визначення порогів коагуляції гідроксиду феруму (ІІІ)
Золь гідроксиду заліза Fe(OH)3 виготовлений з позитивним зарядом гранул. Запишіть будову його міцели, якщо золь утворився при гідролізі солі
FeCl3.
Для коагуляції золю Fe(OH)3 використовують електроліти з аніонами різної валентності, наприклад KCl, K2SO4, K3PO4 або K3[Fe(CN)6] із відповідними
77
концентраціями в моль/л: 2,5; 0,1; 0,01. Пояснити чому?
У три пробірки відміряти піпеткою по 5,0 см3 названого викладачем золю і методом титрування додавати з бюретки краплинами при інтенсивному помішуванні одного із трьох розчинів електролітів до перших ознак коагуляції: помутніння розчину, зміни забарвлення (потемніння), випадання осаду. Одержані дані занести в таблицю 8.1.
Таблиця 8.1
№ |
|
Концентрація |
Коагулюючий |
Об’єм розчину |
Поріг коагуля- |
|||
про- |
Формула еле- |
електроліту С, |
йон |
електроліту V, |
|
ції |
||
|
C ×V |
|
||||||
бірки |
ктроліту |
моль/л |
та його заряд |
см3 |
П = |
|||
Vз + V |
||||||||
|
|
|
|
|
|
|||
1. |
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
Зробити висновок із одержаних даних: який йон і електроліт мають найбільшу коагулюючу дію. Поясніть, чому. Розрахуйте відношення порогів коагуляції для йонів різного заряду.
4.2.2. Визначення порогів коагуляції для золів із від’ємним зарядом гранул (золь срібла, MnO2, коларгол та інші)
Запишіть будову міцели відповідного золю, якщо він одержаний при надлишку відповідних електролітів K[Ag(OH)2], KMnO4, K[AgO] та ін.
Для коагуляції золю необхідно використати розчини кожної із солей, що містять катіони різної валентності (NaCl, BaCl2, AlCl3) у порядку зменшення концентрацій.
У три пробірки набрати піпеткою по 5,0 см3 заданого золю і титрувати кожну пробірку одним із трьох електролітів із бюретки до появи перших ознак коагуляції. Дослід провести аналогічно попередньому, скласти відповідну таблицю і зробити висновок.
4.2.3. Перевірка захисної дії ВМC при коагуляції гідрофобного золю
У 4 пробірки відміряти піпеткою по 2,0 см3 золю, вказаного викладачем (Fe(OH)3). Для коагуляції взяти дві пробірки, вибрати відповідні два електроліти з дво- і тризарядними йонами, титрувати з бюретки кожну пробірку різним розчином. У третю і четверту пробірки додати спочатку по 1,0 см3 0,5 % розчину ВМC (желатини, крохмалю тощо) й аналогічно провести коагуляцію тими ж електролітами, що і в перших двох пробірках. Порівняти кількості витрачених розчинів. Результати записати в таблицю 8.2.
|
|
|
|
|
|
Таблиця 8.2 |
|
|
Концентрація |
Витрачено на коагуляцію |
Поріг коагуляції |
|
|||
Формула |
розчину |
V, см3 |
|
П, ммоль/л |
|
||
електроліту |
електроліту |
без ВМР |
|
з ВМР |
без ВМР |
з ВМР |
|
|
С, моль/л |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
78 |
|
|
|
|
|
Розрахувати пороги (П) коагуляції за формулою:
П = |
C ×V1 |
|
|
Vзолю +VВМС +V1 |
|||
|
|||
де: С – концентрація електроліту, ммоль/л; |
|||
Vзолю; VВМР; V – об’єми розчинів золю, ВМC і електроліту відповідно, |
|||
см3. |
|
|
|
Як пояснити, що на коагуляцію золю в присутності ВМР витратилося більше електроліту? Поясніть цю відмінність за допомогою умовної схемималюнка: гранула + коагулюючі йони.
4.2.4. Взаємна коагуляція золів
Налити в пробірку 2,0 см3 золю Fe(OH)3 з позитивним зарядом гранул (запишіть будову міцели, якщо стабілізатором є FeCl3). В пробірку додати 2,0 см3 золю берлінської блакиті з від’ємним зарядом гранул. Складіть формулу міцели, якщо стабілізатор – K 4[Fe(CN)6]. Що спостерігається після змішування двох золів? Дайте пояснення цим явищам.
5. Підведення підсумків та зарахування теми
Заняття № 9
Тема: Властивості розчинів ВМР. Визначення ступеня набрякання гелів та вивчення впливу різних факторів на набрякання. Визначення ізоелектричної точки білків
1. Актуальність теми
До високомолекулярних сполук (ВМР) належать як природні, що становлять основу всієї живої матерії, так і синтетичні сполуки, молекулярна маса яких сягає кількох мільйонів. Синтетичні полімери широко застосовуються в народному господарстві, зокрема медицині, для виготовлення протезів, судин, суглобів, серцевих клапанів, кришталиків ока, різних тканин. Волокна із синтетичних полімерів використовуються як шовний матеріал у хірургічній практиці. У фармації полімери використовують для виготовлення оболонок капсул, у які поміщують лікарські речовини, як покриття і складові частини таблеток та як допоміжні речовини для створення мазей і пластирів.
Багато ВМР проявляє біологічну активність і застосовуються як замінники плазми крові (полівінілпіролідон, полівінол), при лікуванні опіків (полівінілбутанол), як пролонгатори дії ліків (похідні целюлози, поліетиленгліколі, полікислоти), для стабілізації лікарських колоїдних препаратів, суспензій та емульсій.
Знайомство з суттю явищ набрякання і желатинування сприяє кращому розумінню багатьох фізіологічних процесів: запалення, утворення набряків, ре-
79
генерації тканин та ін.
Високомолекулярні речовини (ВМР) із живої природи називаються біологічними або біополімерами. Біополімери (білки, вуглеводи, нуклеїнові кислоти) утворюються у процесі біосинтезу в клітинах і є важливими складовими частинами всіх живих організмів.
Синтетичні полімери широко застосовуються в медицині для виготовлення протезів судин, суглобів, серцевих клапанів, кришталиків ока, як шовний матеріал у хірургічній практиці. Розчини ВМР відіграють суттєву роль при дослідженні деяких властивостей макромолекул, а також у практичному застосуванні полімерів. У медичній практиці розчини деяких полімерів використовуються як плазмозамінники, що тимчасово виконують роль крові як своєрідного “ рідкого органу”. Ряд розчинів полімерів використовують для пролонгованої дії лікарських речовин. Наприклад, препарат йодинол – 1 % водний розчин йодного комплексу з полівініловим спиртом – має високу бактерицидну активність і знайшов широке застосування в медицині та ветеринарії. Ряд полімерів у медичній практиці застосовуються у вигляді гелів.
Вивчення структури та властивостей біополімерів, процесів набрякання і желатинування сприяє кращому розумінню найважливіших біологічних процесів, що протікають на клітинному та молекулярному рівнях.
2. Навчальні цілі:
–знати основні методи одержання ВМР;
–знати будову молекул природних і синтетичних ВМР;
–вміти експериментально визначати ступінь набрякання ВМР;
–вміти передбачити вплив електролітів на ступінь набрякання ВМР та біологічних тканин живого організму;
–засвоїти основні властивості поліелектролітів;
–вміти експериментально визначати ізоелектричну точку (ІЕТ) поліелектролітів за набряканням та знати вплив різних факторів на процес набрякання;
–навчитись визначати ІЕТ поліелектролітів за в’язкістю та осіданням.
Матеріал доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
Набухання та розчинення полімерів. Механізм набухання. Вплив рН середовища, температури та електролітів на набухання. Роль набухання в фізіології організму. Драглювання розчинів ВМС. Механізм драглювання. Вплив рН середовища, температури та електролітів на швидкість драглювання. Тиксотропія. Синерезис. Дифузія в драглях. Висолювання біополімерів з розчинів. Коацервація та її роль у біологічних системах.
Аномальна в’язкість розчинів ВМС. В’язкість крові. Мембранна рівновага Доннана.
80
