
Metod_Medical_chem_1_Med_M-2
.pdf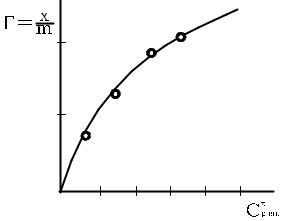
Рис. 6.1 Ізотерма адсорбції Фрейндліха. |
9)Зробити висновок про залежність адсорбції від рівноважної концентрації кислоти.
4.2.5. Розділення суміш кольорових солей
1)У колонку – скляну трубку зі звуженим кінцем, закриту ватним тампоном,
насипати через лійку порошок Al2O3 (НФ) на висоту 1,5-2 см. Утрамбувати сорбент легким постукуванням об стіл.
2)Піпеткою набрати 0,5–1 см3 заданого викладачем розчину, який повільно (краплинами) впускати по внутрішній стінці колонки.
3)Спостерігати, як при русі рідини по колонці формуються кольорові хроматографічні зони, в котрих можуть бути такі катіони: Fe3+ (коричневі), Ni2+ (зелені), Cu2+ (голубі), Co2+ (рожеві).
4)Зарисуйте колонку з отриманими кольоровими хроматографічними зонами та вкажіть, які саме солі були у взятій суміші, якщо її одержали змішуван-
ням 0,1 % розчинів FeCl3, NiSO4, CuSO4 і CoCl2. .
5)Враховуючи радіуси катіонів і їх заряди, пояснити отриману послідовність розташування хроматографічних зон на полярному адсорбенті Al2O3.
6)Коротко описати хід роботи і зробити висновки.
5. Підведення підсумків та зарахування роботи
Заняття № 7
Тема: Одержання ліофобних золів та їх властивості
1. Актуальність теми.
Реальний світ, що нас оточує – рослинні і тваринні організми, багато об’єктів неживої природи, продукти харчування, одяг, будівельні матеріали і б.і. – все це різні дисперсні системи. Складні життєві процеси, що відбуваються у тваринних і рослинних організмах, значною мірою мають колоїдно-
61
хімічний характер. Біологічні рідини – кров, плазма, спинномозкова рідина, багато лікарських препаратів – є колоїдними системами і тому вивчення властивостей цих систем і способів їх одержання дає можливість визначати раціональну технологію їх виготовлення, умови зберігання, а також запропонувати можливий механізм терапевтичної дії. М’язові і нервові клітини, волокна, гени, віруси – все це колоїдні утворення. Дослідження оптичних властивостей дисперсних систем дає цінні відомості про їх структуру, розмір і форму частинок, а також дозволяє визначити концентрацію дисперсної фази. Вивчення явищ стабілізації дисперсних систем та їх поведінки в електричному полі становить велике зацікавлення для біологів, медиків і фармацевтів. Стійкість різних дисперсних систем – золів, емульсій, суспензій та аерозолів забезпечується переважно наявністю електричного заряду в завислих частинках.
Величина електрокінетичного (дзета-) потенціалу ліофобних золів є найважливішою характеристикою їх стійкості та прояву фізіологічної дії. Методом електрофорезу та електроосмосу користуються для визначення величини електрокінетичного потенціалу дисперсних частинок, для очищення і розділення білків, ферментів та інших речовин. Електрофоретичний аналіз застосовується у клінічних лабораторіях із метою діагностики, а електрофорез – як одна з дуже ефективних фізіотерапевтичних процедур у лікувальній справі. Вивчення фізико-хімії дисперсних систем, закономірностей, характерних для них, є одним із ключів до пізнання самого життя.
2. Навчальні цілі:
–вміти одержувати ліофобні золі;
–знати їх властивості;
–знати міцелярну будову колоїдних частинок;
–вміти експериментально визначати знак заряду колоїдних частинок лікарських засобів методом капілярного аналізу;
–знати закони світлорозсіювання в колоїдних частинках.
−знати електричні властивості колоїдних систем;
−вміти складати формули міцел в ізоелектричному стані;
−вміти експериментально встановлювати знак заряду гранул колоїдних частинок, лікарських засобів;
−вміти розв’язувати ситуаційні задачі та аналізувати значення дзетапотенціалу для характеристики стійкості ліофобних золів і прояву їх фізіологічної дії;
–знати застосування явища електрофорезу в медичних та фармацевтичних дослідженнях
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Організм як складна сукупність дисперсних систем. Класифікація дисперсних систем за ступенем дисперсності. Колоїдний стан. Ліофільні та ліофобні
62
колоїдні системи. Будова колоїдних часток. Подвійний електричний шар. Електрокінетичний потенціал колоїдної частки.
Очистки колоїдних розчинів. Діаліз, електродіаліз, ультрафільтрація, компенсаційний діаліз, вівідіаліз. Гемодіаліз та апарат "штучна нирка".
Молекулярно-кінетичні властивості колоїдних систем. Броунівський рух, дифузія, осмотичний тиск. Оптичні властивості колоїдних систем.
Електрокінетичні явища. Електрофорез. Рівняння Гельмгольца-Смолу- ховського. Застосування електрофорезу в дослідницький та клініколабораторній практиці. Електрофореграми.
3.2. Блок інформації
Колоїдні розчини (золі) – це високодисперсні системи з розмірами частинок від 10–7 до 10–9 м. Методи одержання: -конденсаційні, які полягають в утворенні колоїдних частинок внаслідок агрегації молекул або йонів; - диспергаційні – у подрібненні великих частинок. Пептизація – це дезагрегація частинок осаду розпушеної структури, між якими є прошарок дисперсійного середовища. Очищення колоїдних розчинів із метою надання їм стійкості та вивчення властивостей здійснюють методами діалізу або ультрафільтрацією. Діаліз полягає у вимиванні низькомолекулярних речовин водою або іншим розчинником за допомогою напівпроникних мембран, які не пропускають частинок дисперсної фази. Ультрафільтрація – це фільтрування під надлишковим тиском через ультрафільтр, виготовлений із напівпроникної мембрани.
Згідно міцелярної теорії будови колоїдних розчинів золь складається з двох частин: міцел і інтерміцелярної рідини. Міцела – структурна колоїдна частинка дисперсної фази, яка має складну будову.
Основу міцели становить агрегат із багатьох дрібнесеньких кристалів, що складаються з молекул або атомів нерозчинної в даному дисперсійному середовищі речовини. Поверхня агрегату набуває позитивного або негативного заряду за рахунок адсорбції потенціалвизначальних йонів стабілізатора. Агрегат з адсорбованими йонами утворює ядро міцели. Потенціалвизначальними йонами є йони стабілізатора, що входять до складу агрегату або ізомерні з ними.
До зарядженого ядра притягаються протилежно заряджені йони стабілізатора – протийони. Частина протийонів, які містяться поблизу поверхні ядра, створює адсорбційний шар. Ядро разом з адсорбційним шаром становить гранулу, знак заряду якої визначається потенціалвизначальними йонами. Решта протийонів утворюють дифузійний шар.
Електрокінетичні явища – це явища, що грунтуються на взаємозв’язку між електричними і кінетичними властивостями дисперсних систем і пов’язані з існуванням на межі розділу фаз подвійного електричного шару (ПЕШ). До них належать: електроосмос, електрофорез, потенціал перебігу та потенціал седиментації. У всіх випадках на межі двох фаз виявляється особлива форма електричного потенціалу, який називається електрокінетичним або (дзета-) потенціалом. Отже ζ-потенціал виникає на межі адсорбційного та дифузного шарів. Величина його визначається різницею між загальним числом зарядів потенці-
63

алвизначальних йонів і числом зарядів протиіонів, що містяться в адсорбційному шарі. В ізоелектричному стані, коли загальний заряд протиіонів дорівнює зарядові потенціалвизнальних йонів, z -потенціал дорівнює нулю.
Дзета-потенціал найчастіше визначають за допомогою електроосмосу або електрофорезу.
Електроосмос – це явище спрямованого переміщення дисперсійного середовища відносно нерухомої дисперсної фази в постійному електричному полі.
Електрофорез – явище спрямованого переміщення частинок дисперсної фази в електричному полі.
Величина z-потенціалу частинок ліофобних золів є характеристикою їх стійкості. Стійкими є золі з зарядом частинок в межах 30–90 мВ.
Електрокінетичний потенціал кулькоподібних частинок золю вираховується за формулою Гельмгольца-Смолуховського:
=η × l × S
ζτ × D × E ×ε , де:
η– в’язкість дисперсійного середовища (води) 0,001 Па×с; D – діелектрична проникність води 81;
E – напруга, В;
ε – |
коефіцієнт, що дорівнює 8,85×10–12 Ф/м; |
l – |
віддаль між електродами у приладі для електрофорезу; |
S – |
шлях який пройшли частинки золю, м; |
τ– час експерименту, с.
3.3.Література
1.Мороз А.С. , Луцевич Д.Д. , Яворська Л.П. Медична хімія (2-ге вид.).– Вінниця: Нова Книга, 2008.– С. 603–658.
2.Медицинская химия/ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук.– К.: Медицина, 2008.– С. 252– 285.
3.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994. – С. 188-216.
4.Садовничая Л. П., Хухрянский В. Г., Цыганенко А. Я. Биофизическая химия. – К.: Вища школа, 1986.– С. 187-210, 218-222.
3.4.Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.Які системи називаються дисперсними та за якими ознаками їх класифікують?
2.Дати визначення колоїдних розчинів (золів) та показати їх відмінність від істинних розчинів.
64
3.Які є основні групи методів одержання ліозолів? У чому полягає відмінність методу пептизації від диспергаційних і конденсаційцних методів одержання золів?
4.Назвати складові частини міцели. Правило Панета-Фаянса. Що таке потенціалвизначальні йони, адсорбційний та дифузійний шари?
5.На прикладі гідрозолів AgCl, As2S3, PbS розглянути умови утворення золів із позитивними і негативними зарядами гранул. Скласти схеми будови міцел.
6.У яких випадках відбувається розсіювання, а коли вбирання чи відбиття світла? Суть ефекту Тиндаля.
7.Записати рівняння Релея і зробити його аналіз. Які параметри впливають на інтенсивність розсіювання світла?
8.Що можна визначати за результатами світлорозсіювання?
9.Навести основні методи очищення колоїдних розчинів та показати їх застосування в медицині. Принцип роботи апарату «штучна нирка».
10.Принцип дії: а) нефелометра; б) ультрамікроскопа; в) електронного мікроскопа. Їх застосування в медико-біологічних дослідженнях.
11.Що називається електрофорезом, а що – електроосмосом?
12.Нарисувати схему найпростішого приладу для електрофорезу та електроосмосу.
13.Як можна виявити електричний заряд та його знак на гранулах колоїдних частинок лікарських засобів?
14.Що називаємо електрокінетичним (дзета-) потенціалом?
15.Запишіть формулу міцели золю Fe(OH)3, одержаного у присутності елект- роліту-стабілізатора Fe(NO3)3. Покажіть на формулі місце виникнення дзе- та-поткенціалу. Складіть формулу цієї ж міцели в ізоелектричному стані.
16.Що називають критичним потенціалом і яка його роль у стійкості золю?
17.Що таке катафоретична рухливість? Який її зв’язок із градієнтом напруги та дзета-потенціалом?
18.Яке значення електрофорезу в біології та медицині?
б) Задачі для самоконтролю
Алгоритми розв’язування типових задач
Задача 1. Для одержання золю берлінської блакиті до 12 см3 0,01 М розчину FeCl3 додали 10 см3 0,05 н. розчину K4[Fe(CN)6]. Написати формулу міцели цього золю. Який заряд гранули?
Алгоритм розв’ язання
1.Перерахувати молярну (СМ) на нормальну (СN.) концентрацію розчину
FeCl3:
СN = СМ×3 = 0,01×3 = 0,03 (моль-екв/л).
2.Записати рівняння реакції одержання берлінської блакиті:
4FeCl3 + 3K4[Fe(CN)6] ® Fe4([Fe(CN)6])3¯ + + 12KCl
3. Знайти, яка з вихідних речовин взята в надлишку, тобто є стабілізатором:
65
кількість ммоль-екв FeCl3 = 12×0,02 = 0,24 ммоль-екв; кількість ммоль-екв K4[Fe(CN)6] = 10×0,05 = 0,5 ммоль-екв.
4.У розчині є надлишок K4[Fe(CN)6], який є стабілізатором. Тому гідрофобні частинки Fe4([Fe(CN)6])3 будуть адсорбувати йони [Fe(CN)6]4– (правило Панета-Фаянса), і надаватимуть гранулі від’ємного заряду. Протийонами будуть йони К+.
5.Схема будови міцели берлінської блакиті в цьому випадку буде такою:
{[(mFe4([Fe(CN)6])3) × n[Fe(CN)6]4– ]4n– × 4(n – x) K +}4x– × 4x K+ (mFe4([Fe(CN)6])3) – агрегат;
[(mFe4([Fe(CN)6])3) × n [Fe(CN)6]4– ]4n– – ядро; {[(mFe4([Fe(CN)6])3) × n[Fe(CN)6]4– ]4n– × 4(n – x) K+}4x– – гранула; n[Fe(CN)6]4– – потенціалвизначальні йони;
4(n – x) K+ – адсорбційний шар; 4xK+ – дифузійний шар.
Задача 2. Визначити |
діаметр частинок аерозолю (диму), якщо в |
об’ємі |
V0 = 4×10–11 |
м3 підраховано 120 частинок. Концентрація |
золю |
С = 1×10–4 кг/м3, а густина дисперсної фази становить 2,2×103 кг/м3.
Алгоритм розв’ язання
Прийнявши форму частинки за кулеподібну, за формулою вираховуємо середній радіус частинок:
|
|
|
r = 3 |
|
3 ×C ×V0 |
|
|
, звідки: |
||
|
|
|
4π × n × ρ |
|||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||
r = 3 |
|
3 ×1×10−4 × 4 ×10−11 |
|
|
=1,535×10–7 м; |
|||||
4 |
×3,14 ×120 × 2,2 ×103 |
|
|
|
||||||
D = 2r = 1,535×10–7 × 2 |
= 3,07×10–7 м. |
|||||||||
Задача 3. Розрахувати електрокінетичний потенціал частинок золю коларголу, якщо за 5 хв. при напрузі 300 В його частинки перемістилися на 10 мм при відстані між електродами 20 см (η = 10–3 Па×с, D = 81, ε = 8,85×10–12 Ф/м).
Алгоритм розв’ язання
Використовуємо формулу Гельмгольца-Смолуховського, куди підставляємо значення відомих величин у системі CI:
ζ = |
l × S ×η |
10 ×10−3 × 20 ×10−2 ×10−3 |
|||
|
= |
|
= 0,031 B = 31 мВ. |
||
τ × D × E ×ε |
|||||
5 × 60 ×300 ×81×8,85 ×10−12 |
|||||
Відповідь: Дзета-потенціал частинок золю коларголу становить 31 мВ.
66

Задача 4. Обчислити градієнт напруги між електродами, якщо електрокінетичний потенціал часточок золю броміду срібла становить 61,5 мВ, а електрофоретична швидкість його часточок 5,24×10–6 м/с. В’язкість середовища η = 10–3 Па×с, де діелектрична константа D = 81.
Алгоритм розв’ язання
1.Градієнт потенціалу (Н) – це відношення напругиміж електродами (Е) до відстані між ними (1):
H = E ; l
2.Електрофоретична швидкість (V) – це шлях, який проходять частинки золю за час t при градієнті потенціалу Н = 1 В/м.
V = S ;
H
3. Використавши |
формулу Гельмгольца-Смолуховського ζ = |
η × l × S |
, |
||||||||||
τ × D × E ×ε |
|||||||||||||
знайти градієнт потенціалу: |
|
|
|
|
|
|
|||||||
|
|
S ×η |
|
|
|||||||||
|
|
|
|
E |
|
|
|
|
|||||
|
|
|
|
|
|
= |
|
, |
|
|
|
||
|
|
|
|
l |
τ × D ×ε × ζ |
|
|
||||||
|
|
η |
= 5,24×10–6 × |
|
|
10−3 |
|
|
|||||
H =V × |
|
|
|
|
|
= 118,9 В/м. |
|
||||||
|
|
|
|
|
|
|
|||||||
|
D ×ε × ζ |
|
81×8,85×10−12 ×61,5×10−3 |
|
|
||||||||
Відповідь: Градієнт потенціалу становить118,9 В/м.
в) Задачі для самостійного розв’язання
1.Для одержання золю хлориду срібла до 15 см3 0,025 М розчину хлориду калію додали 85 см3 0,005 М розчину нітрату срібла. Написати формулу міцели одержаного золю. Який заряд гранули?
Відповідь: позитивний.
2.Які об’єми 0,029 % розчину NaCl (r = 1 г/см3) та 0,001 н. розчину AgNO3 потрібно змішати, щоб одержати незаряджені частинки золю AgCl? Склас-
ти формулу міцели в ізоелектричному стані.
Відповідь: V(NaCl):V(AgNO3) = 1:4,96.
3. При ультрамікроскопічному дослідженні гідрозолю золота в об’ємі V0 = 1,6×10–11 м3 підраховано 70 частинок (n). Концентрація золю С = 7×10– 6 кг/м3, густина золота 19,3×103 кг/м3. Визначити середній радіус (в м) частинок дисперсної фази, прийнявши їх форму за сферичну.
Відповідь: 2,705×10–8 м.
4.Золь AgI одержано при поступовому додаванні до 20 см3 0,01 М розчину
KI 15 см3 0,2 % розчину AgNO3 (r = 1 г/мл). Написати формулу міцели одержаного золю. Визначити напрям руху його частинок в електричному полі.
67
5.Скільки см3 0,005 М розчину ZnCl2 потрібно долити до 20 см3 0,015 М розчину (NH4)2S, щоб одержати золь ZnS з позитивно зарядженими гранулами? Написати формулу міцели цього золю.
Відповідь: 60 см3.
6.Обчислити дзета-потенціал частинок білка, які при електрофорезі за 20 хв переміщаються на 22,5 мм між електродами, якщо відстань між ними 15 см при напрузі 200 В. Для цього розчину в’язкість η = 10–3 Па×с, а константи D
= 81 і ε = 8,85×10–12 Ф/м.
Відповідь: 19,6 мВ.
7.Розрахувати електрофоретичну швидкість (V) гранул гідрозолю протарголу, якщо z-потенціал 50 мВ а при електрофорезі за 180 с межа золю змістилась на 5,2 см. Градієнт зовнішнього поля Н = 8×10–2 В/м, в’язкість середовища η = 10–3 Па×с, а константи D = 81, ε = 8,85×10–12 Ф/м.
Відповідь: 2,87×10–6 мм/с.
4. Матеріал для аудиторної роботи
4.1. Перелік практичних завдань, які необхідно виконати на практичному занятті:
–одержати золі методом фізичної конденсації (заміни розчинника);
–одержати золі методом хімічної конденсації за реакціями: подвійного обміну, гідролізу, ОВР;
–одержати золі методами безпосередньої і посередньої пептизації;
–визначити знак заряду колоїдних частинок лікарських засобів методом капілярного аналізу;
–визначити знак заряду гранул та величину дзета-потенціалу частинок лікарського засобу (гідрофобного золю, за вказівкою викладача).
4.2. Інструкції для виконання практичних завдань
4.2.1. Одержання золів методом фізичної конденсації (заміною розчинника) а) Одержання золю каніфолі.
У пробірку налити 5 см3 дистильованої води і при перемішуванні краплями додавати спиртовий розчин каніфолі. Записати спостереження. Звернути увагу на опалесценцію – характерну особливість колоїдних розчинів. Яким методом утворений золь?
б) Одержання золю сірки.
У пробірку налити 5 см3 дистильованої води і при перемішуванні додати 0,5 см3 насиченого спиртового розчину сірки. Що спостерігається?
4.2.2. Одержання золів методом хімічної конденсації а) Одержання золю йодиду аргентуму за реакцією подвійного обміну.
До 100 см3 0,002 М розчину КІ додати при перемішуванні 1 см3 0,01 М розчину AgNO3. Відмітити забарвлення золю і написати будову міцели (надмір
68
КІ). Який заряд гранули?
Написати будову міцели AgI, одержаного при надлишку AgNO3. б) Одержання золів берлінської блакиті з різними зарядами гранул.
Приготувати у двох пробірках золі берлінської блакиті з 0,005 М розчину FeCl3 і 0,005 М розчину K4[Fe(CN)6] у таких співвідношеннях:
1)3 см3 розчину FeCl3 і 1 см3 розчину K4[Fe(CN)6];
2)3 см3 розчину K4[Fe(CN)6] і 1 см3 розчину FeCl3.
Написати рівняння реакції і будову міцели для обох золів. Від чого залежить заряд гранули?
в) Одержання золю гідроксиду феруму (ІІІ) за реакцією гідролізу.
Нагріти в колбочці до кипіння 50 см3 дистильованої води. Додати в киплячу воду краплями 5% розчин FeCl3. Що спостерігається? Записати рівняння хімічних реакцій і будову міцели одержаного золю.
г) Одержання золю гексаціано(ІІ)ферату купруму за реакцією подвійного обміну.
До 5 см3 1 % розчину CuSO4 додати декілька крапель 0,01 % розчину K4[Fe(CN)6]. Записати рівняння реакції та будову міцели одержаного золю. Написати будову міцели золю, одержаного при надмірі K4[Fe(CN)6].
г) Одержання золю кремнієвої кислоти.
До 5 см3 5 % розчину Na2SiO3 додати при перемішуванні 0,5 см3 0,1 М розчину HCl. Яка будова міцели одержаного золю?
д) Одержання золю металічного срібла за реакцією відновлення.
До 10 см3 0,001 М розчину AgNO3 додати 2–3 краплі 1 % розчину K2CO3 і 1 см3 свіжовиготовленого розчину таніну (альдегід), нагріти. Утворюється жо- вто-коричневий золь металічного срібла.
AgNO3 + K2CO3 = AgOK + KNO3 + CO2
стабілізатор
2AgOK + R–COH + H 2O = 2Ag↓ + R–COOH + 2KOH
Написати будову міцели одержаного золю і зробити висновок про метод його одержання.
е) Одержання золю діоксиду мангану за допомогою окисно-відновної реакції.
У колбу з 25 см3 0,1 М розчину KMnO4 додавати з бюретки невеликими порціями 10 % розчин H2O2 до тих пір, поки взята скляною паличкою і нанесена на фільтрувальний папір крапля розчину не перестане забарвлювати папір у рожевий колір. Записати будову міцели золю.
ж) Одержання золю сульфіду плюмбуму.
До 3 см3 1 % розчину Pb(CH3COO)2 додати краплями 3 см3 5 % розчину Na2S. Записати спостереження, рівняння реакції і будову міцели одержаного золю. Яка будова міцели золю PbS, одержаного при надмірі Pb(CH3COO)2?
69
4.2.3. Одержання золів методом пептизації а) Одержання золю Fe(OH)3.
Одержати осад Fe(OH)3 при взаємодії FeCl3 з NH4OH. Для цього 1 см3 насиченого розчину FeCl3 розвести водою до 20 см3. До одержаного розчину повільно додавати 5 % розчин NH4OH до знебарвлення рідини над осадом. Написати рівняння реакції. Відмітити колір осаду.
Рідину над осадом злити і декілька разів промити дистильованою водою (декантація). Промитий осад розділити у 3 пробірки і додати:
уІ – 10 см3 дистильованої води;
уІІ – 10 см3 2 % розчину FeCl3;
уІІІ – 10 см3 0,02 М розчину HCl.
Через 10 хвилин записати спостереження. Пояснити, що відбулося з осадом у ІІ і ІІІ пробірках? Який тип і механізм пептизації? Написати будову міцел одержаних золів.
б) Одержання золю берлінської блакиті.
До 5 см3 2 % розчину FeCl3 додати 1 см3 насиченого розчину K4[Fe(CN)6]. Осад відфільтрувати і промити дистильованою водою. Після промивання осаду на фільтрі 0,1 М розчином оксалатної кислоти (Н2С2О4) фільтрується синій золь берлінської блакиті. Записати рівняння реакції та будову міцели золю, враховуючи, що осад пептизується оксалатною кислотою за рахунок адсорбції йонів С2О42– .
4.2.4. Визначення знаку заряду колоїдних частинок лікарських засобів У забарвлених золях знак заряду частинок можна визначити методом капі-
лярного аналізу. Він оснований на тому, що целюлозні стінки капілярів фільтрувального паперу заряджені негативно, а вода, що просочує папір, – позитивно. На клапоть фільтрувального паперу нанести краплю досліджуваного золю. Після всмоктування краплі золь із позитивно зарядженими частинками адсорбується на папері і дає забарвлену в центрі і безбарвну по краях пляму; золь із негативно зарядженими частинками не адсорбується папером і утворює рівномірно забарвлену пляму.
4.2.5 . Визначити знак заряду гранул та величину дзета-потенціалу лікарського засобу (гідрофобного золю, за вказівкою викладача: протарголу або коларголу).
1)У прилад для електрофорезу (рис. 7.1), що закріплений у штативі, налити в коліно А (див. малюнок) проміжної рідини для заданого золю до рівня на 3–5 мм вище від верхнього зрізу крана К. Кран при цьому повинен бути відкритий, щоб через нього виходило повітря.
2)Закрити кран К і в обидва коліна вставити електроди Е, але не затискати корки, щоб з-під них могла потім витікати рідина.
3)Налити заданого золю через лійку В доверху.
70
