
Metod_Medical_chem_1_Med_M-2
.pdf
процесом окиснення-відновлення, то теоретично будь-який електрод є окисновідновним. Проте окисно-відновними називають такі електроди, провідник яких не бере участі в окисно– відновній реакції, а є тільки переносником електронів, процес же окиснення-відновлення відбувається між речовинами, що містяться у розчині, в який занурено даний провідник. Отже, окисновідновними, або редокс-електродами, називають напівелементи, які складаються з інертного провідника (платина, золото, графіт тощо), зануреного в розчин, де є окиснена та відновлена форми однієї і тієї ж речовини (неорганічних йонів, або органічних сполук) , наприклад,
Pt Fe3+, Fe2+.
Величину потенціалу окисно-відновних електродів обчислюють за рівнянням Нернста– Петерса:
ϕок/відн = ϕок0 |
/відн + |
RT |
ln |
aок |
, |
|
|
||||
|
|
nF |
aвідн |
||
де аок і авідн – відповідно активність окисленої і відновленої форм. Йонселективні електроди. Одним із сучасних фізико-хімічних методів
аналізу, що дозволяє контролювати стан оточуючого середовища та слідкувати за зміною концентрації електролітів у біологічних рідинах є йонометрія – потенціометричний метод дослідження складу розчинів за допомогою йонсе-
лективних електродів.
Йонселективні електроди – це електрохімічні датчики, потенціал яких залежать від активності певного виду йонів у розчині, які називають потенціа-
лоутворюючими.
Йонселективний електрод (рис. 3.1) складається з корпуса 1, внутрішнього допоміжного електрода 2, зануреного у внутрішній розчин 3 і мембрани 4. Тому такі електроди часто називають мембранними і їх класифікують за типом мембрани: скляні, кристалічні, рідкі та плівкові. Суттєвим для цих електродів є те, що до складу їх мембран входять електродноактивні речовини, які і забезпечують процес селективного обміну йонами між мембраною та розчином.
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.1 Схема йоноселективного |
Рис. 3.2 Скляний електрод |
||||
|
електрода |
|
|
|
|
При зануренні йонселективного електрода у досліджуваний розчин електродна мембрана відокремлює його від зовнішнього розчину. Між мембраною
31

та обома розчинами починається процес обміну йонами, які рухаються у бік фази з меншою активністю йонів даного виду. Оскільки мембрана частину йонів не пропускає, то по обидва її боки через певний проміжок часу виникає стрибок потенціалу, які перешкоджає подальшому переходу йонів між фазами. Таким чином досягається рівноважний розподіл заряджених часточок між розчинами та мембраною. Гальванічний елемент з йонселективним електродом схематично можна зобразити так:
Електрод порів- |
Досліджуваний |
Мембрана |
Внутрішній |
Електрод порівняння |
|
няння (зовнішній) |
розчин |
|
розчин |
|
(внутрішній) |
|
|
Йон |
селективний |
електрод |
|
Електрорушійна сила такого гальванічного елемента залежить від активності потенціалоутворюючих йонів ах:
E = E 0 + θ lgax , Z x
де θ – кутовий коефіцієнт залежності потенціалу електрода від логарифма активності потенціалоутворюючого йона.
Йонселективні електроди класифікують за агрегатним станом електродноактивного матеріалу.
а) Йонселективні електроди зі скляною мембраною (рис. 3.2) складаються зі скляної трубки 1, до якої припаяна куляста мембрана 3 із електродного скла: натрієвого або літієвого. У корпусі електрода знаходиться розчин НСl з певною концентрацією йонів Н3О+ 4, в який занурений допоміжний електрод 2, найчастіше хлорсрібний.
Рівняння для потенціалу скляного електрода має вигляд
ϕскл = ϕ 0 + |
RT |
lna |
|
|
, |
|
H3O |
+ |
|||
|
F |
|
(роз) |
||
тобто потенціал залежить від активності йонів гідроксонію в розчині. Такі електроди називають скляними електродами з водневою функцією і їх викори-
стовують для потенціометричного визначення рН розчинів.
У йонному процесі, який відбувається на скляній мембрані, у залежності від сорту скла можуть брати участь йони лужних металів і тоді між поверхнею скла і розчином встановлюється така рівновага:
Н+скло + Ме+розч Н+розч + Ме+скло
де Ме+ – йон лужного металу, який входить до складу скла.
У цьому випадку рівняння для потенціалу скляного електрода набуває вигляду
ϕскл = ϕ 0 + RT lna Ме+ .
F
Електроди, потенціал яких залежить від активності катіонів лужного металу, називають скляними електродами з металевою функцією. У йонометрії їх використовують як індикаторні для визначення активності катіонів цих металів.
б) Йонселективні електроди з твердими мембранами. Прикладом такого
32
електрода є електрод з полікристалічною мембраною на основі йодиду срібла, внесеного у полімерну матрицю, що забезпечила мембрані механічну міцність та еластичність. У цьому електроді йонну провідність здійснюють йони Ag+.
в) Йонселективні електроди з рідкими та плівковими мембранами. Рідкі та плівкові мембрани є розчином електродноактивної речовини – органічного йонообмінника або нейтрального комплексоутворювача в органічній рідині, який не змішується з водою.
г) Газові, ферментні та бактеріальні йооселективні електроди. Особливе місце у потенціометричних методах аналізу займають газові, ферментні, бактеріальні та імуноелектроди (біологічні сенсори), які знайшли широке застосування в медицині.
Їх відмінність від звичайних йонселективних електродів полягає у використання проміжної реакції, внаслідок якої з молекул певної речовини утворюються йони, на які реагує йонселективний електрод.
Газові електроди дозволяють визначити активну концентрацію таких сполук: CO, СО2, NH3, NO2, H2S тощо. Дія деяких електродів ґрунтується на реакції гідролізу, внаслідок якої змінюється реакція середовища, наприклад:
СО2 + 2Н2О Н3О+ + НСО3–
NH3 + H2O OH– + NH4+
Індикаторним електродом на відповідні йони (Н3О+ і ОН– ) у цьому випадку є водневий , або скляний електрод з водневою функцією.
Ферментний електрод складається з шару ферменту, нанесеного на чутливу мембрану йонселективного електрода, наприклад скляного. Фермент, що характеризується високою специфічністю, каталізує реакцію тільки з однією речовиною. Наприклад, уреаза каталізує розклад сечовини, уриказа – розклад сечової кислоти, лактатдегідрогеназа – дегідрування молочної кислоти тощо.
Якщо, наприклад, на електрод нанести фермент глюкозооксидазу, то одержимо селективний електрод для визначення концентрації глюкози. При зануренні цього електрода в розчин глюкози, у шарі ферменту відбувається така реакція:
глюкоза + Н2 О + О2 ¾глюкозооксидаза¾¾¾¾® глюконова кислота + Н2 О.
Поява глюконової кислоти спричинює зміну рН у приелектродному шарі ферменту, яку фіксує скляний електрод з водневою функцією. Дана реакція є специфічною: глюкозооксидаза каталізує тільки реакцію окиснення глюкози і ніякі інші цукри в реакцію не вступають. Таким чином, ферментний електрод дає змогу потенціометричним методом визначити активність речовини, яка немає заряду.
Особливо великого значення набули йоноселективні електроди у медицині. За їх допомогою стало можливим спостерігати за зміною йонного складу біологічних рідин у динаміці, одержувати інформацію про зміну концентрації йонів Na+, Са2+, Сl– тощо, як у внутрішньо-, так і у позаклітинному просторі.
33
3.3.Література
1.Мороз А.С. , Луцевич Д.Д. , Яворська Л.П. Медична хімія (2-ге вид.).– Вінниця: Нова Книга, 2008.– С. 505–540.
2.Медицинская химия/ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук.– К.: Медицина, 2008.– С. 195– 216.
3.Мороз А. С., Ковальова А. Г. Фізична та колоїдна хімія. – Львів: Світ, 1994. – С.84-143.
4.Садовничая Л. П., Хухрянский В. Г., Цыганенко А. Я. Биофизическая химия. – К.: Вища школа, 1986. – С. 105-140.
5.Зеленин К. Н. Химия. – СПб: Специальная Литература, 1997. – С.184225.
3.4.Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.Як виникає електродний потенціал і від чого залежить його величина? Рівняння Нернста.
2.На прикладі елемента Якобі– Даніеля покажіть механізм виникнення ЕРС.
3.Наведіть приклади електродів першого та другого родів. Чим вони відрізняються?
4.Йоноселективні електроди: будова, класифікація, застосування.
5.Біологічна роль дифузійних та мембранних потенціалів. Потенціал пошкодження. Потенціал спокою. Потенціал дії.
6.Які електроди називають окисно-відновними? Наведіть приклади. Від чого залежить величина їх потенціалу і за яким рівнянням їх обчислюють?
7.Роль окисно-відновних реакцій в процесах життєдіяльності.
8.Значення окисно-відновних потенціалів у механізмі процесів біологічного
окиснення.
б) Задачі для самоконтролю
Алгоритми розв’язання типових задач
Задача 1. Обчислити потенціал кадмієвого електрода, з’єднаного з хлорсрібним електродом (ϕх.с.е.= 0,22 В) у гальванічний елемент.
Алгоритм розв’ язання
1.Складаємо схему гальванічного елемента:
(–)Cd | Cd(NO3)2 | KCl | КCl, AgCl | Ag (+)
2.За допомогою йоноабо рН-метру вимірюємо ЕРС цього елемента (Ее) . Е =
0,62 В.
3. Оскільки ЕРС є різницею електродних потенціалів, обчислюємо потенціал кадмієвого (ϕ– ) електрода:
Ее = ϕ+– ϕ– ; ϕ– = ϕ+ – Еел = 0,22 – 0,62 = –0,40 В.
Задача 2. Розрахувати величину стандартного електрохімічного потенціалу ϕ0 для біохімічної редокс-системи нікотинамідаденіндинуклеотиду
34
НАД+/НАД·Н, якщо відомий стандартний біохімічний потенціал ϕ0’= –0,032 В (при активностях оксидованої та відновленої форм а = 1 моль/л, 298 К і рН=7).
Алгоритм розв’ язання
1. Записуємо сумарне рівняння біохімічного окиснення НАД·Н: НАД·Н НАД+ + Н+ + 2е– .
2.Використовуємо рівняння Петерса для обчислення біохімічного потенціалу
ϕ0’:
ϕ 0′ = ϕ 0 + |
0,059 |
lg |
[НАД+ ][H + ] |
= ϕ 0 |
+ |
0,059 |
lg |
1×10 −7 |
= ϕ 0 + 0,059(-7) |
|
|
[НАД× Н] |
|
|
|||||||
|
n |
|
ϕ 0′ |
2 |
1 |
|
||||
- 0,032 = ϕ 0 |
- 0,413; |
= -0,032 + 0,413 = +0,381 В. |
||||||||
в) Задачі для самостійного розв’язання
1.Обчислити величину потенціалу алюмінієвого електрода в 0,2М розчині Al2(SO4)3 за температури 25 оС, якщо стандартний потенціал алюмінієвого
електрода (ϕо) = –1,663 B, а коефіцієнт активності йонів Алюмінію f (Al+3)
= 0,255.
Відповідь: потенціал алюмінієвого електрода дорівнює –1,674 В.
2.Запишіть схему та обчисліть ЕРС гальванічного елемента, складеного із срібного та цінкового електродів, якщо активність йонів металів дорівнює 1 моль/дм3.
Відповідь: ЕРС гальванічного елемента дорівнює 1,50 В.
3.Гальванічний елемент складений з каломельного та ОВ електрода Pt½Fe3+, Fe2+. Запишіть схему гальванічного елемента та обчисліть його ЕРС за стандартних умов.
Відповідь: ЕРС гальванічного елемента дорівнює 0,52 В.
4.Матеріал для аудиторної роботи
4.1. Перелік практичних завдань, які необхідно виконати на практичному занятті:
- визначити електрорушійну силу елемента Вестона; - визначити електрорушійну силу елемента складеного з електродів першого роду; - визначити потенціал окисно-відновного електрода.
4.2. Інструкції для виконання практичних завдань
4.2.1. Визначити ЕРС елемента Вестона за допомогою йоноабо рН-метру Стандартний елемент Вестона знайшов широке застосування у потенціо-
метрії. Величина його ЕРС залежить лише від температури. Приєднати елемент Вестона до йономіра або рН-метра і виміряти величину його електрорушійної сили. Порівняти одержане значення з табличними даними і зробити відповідний висновок.
35

4.2.2. Визначити ЕРС досліджуваного гальванічного елемента Від’єднати елемент Вестона, а на його місце, згідно з наведеною на рис.
3.3 схемою, підключити досліджуваний елемент:
(–) |
(+) |
Zn |
Cu |
|
KCl |
(–) Zn  ZnCl2
ZnCl2  KCl
KCl  CuCl2
CuCl2  Cu(+)
Cu(+)
.
Рис. 3.3 Схема з’ єднань електродів у гальванічний елемент
Користуючись рядом стандартних електродних потенціалів з’ясувати, який заряд мають електроди у даному колі і відповідно приєднати їх до йоноабо рН-метру і виміряти ЕРС елемента. Порівняти одержане значення з величиною стандартної ЕРС даного елемента.
4.2.3. Визначити потенціал електрода першого роду Скласти гальванічний елемент із заданого електрода з невідомим потенціа-
лом та зі стандартного насиченого хлорсрібного електрода, потенціал якого відомий (ϕ = +0,22 В). Записати схему гальванічного елемента, наприклад:
(–)Mе | Men+ | KCl | KCl, AgCl | Ag(+)
івиміряти йономіром величину його ЕРС (Еел):
ϕ − |
Враховуючи, що Еел = ϕ+ – ϕ– обчислити шуканий потенціал електрода |
: |
|
x |
|
ϕ − = – Еел + ϕ х с е
x . . .
Порівняти одержане значення з величиною стандартного потенціалу досліджуваного електрода і зробити відповідні висновки.
4.2.4. Визначити потенціал окисно-відновного електрода Скласти гальванічний елемент із окисно-відновного електрода з невідомим
потенціалом та зі стандартного насиченого хлорсрібного електрода. Записати схему гальванічного елемента, наприклад:
(–) Ag | AgCl, KCl | KCl | I2, 2KI | С(графіт)(+) ,
виміряти величину його ЕРС (Еел) та обчислити величину потенціалу досліджуваного електрода:
ϕ(I2 2I) = Eел + 0,22 .
36
Порівняти одержане значення з величиною стандартного потенціалу досліджуваного окисно-відновного електрода і зробити відповідні висновки.
5. Підведення підсумків та зарахування роботи
Заняття № 4
Тема: Потенціометричне вимірювання рН та потенціометричне титрування
1. Актуальність теми
Потенціометричне вимірювання рН розчинів є одним із сучасних неруйнівних електрохімічних методів аналізу. Порівняно з індикаторним, в залежності від застосованого приладу, він дає змогу вимірювати кислотність середовища з точністю 0,02–0,05 одиниць рН і дозволяє визначити рН біологічних рідин коли неможливо застосувати індикаторний метод.
Потенціометричне титрування, як один із точних методів інструментального аналізу, широко використовують у практиці клінічних та санітарногігієнічних лабораторій для визначення концентрації розчинів досліджуваних речовин, кислотності шлункового соку тощо. Отже, вивчення цього методу має велике практичне значення для лікарів широкого профілю.
2.Навчальні цілі:
–вміти користуватись потенціометрами (рН-метрами) для потенціометричних цілей;
–засвоїти методику потенціометричного визначення рН біологічних рідин (слини, плазми крові, шлункового соку, сечі тощо) за допомогою скляного електрода з водневою функцією;
–навчитись методом потенціометричного титрування визначати концентрацію кислот і основ та їх сумішей у досліджуваних розчинах;
3.Матеріали до аудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Потенціометрія. Принцип потенціометричного вимірювання рН та активності йонів. Електроди визначення (водневий, скляний з водневою функцією) та їх застосування в рН-метрії.
Методика потенціометричного титрування. Вибір індикаторного електрода. Побудова інтегральної та диференціальної кривих титрування і визначення еквівалентної точки. Розрахунок концентрації досліджуваного розчину.
3.2. Блок інформації
Метод визначення рН, який грунтується на вимірюванні електрорушійної сили певних гальванічних елементі називають потенціометричним. Оскільки
37
даний метод є неруйнівним, то його застосовують для вимірювання рН різних біологічних середовищ та органів. Контроль рН, а також можливий на основі рН-метричної техніки контроль вмісту газів у крові – необхідні елементи наукового дослідження та лікування деяких захворювань. Потенціометричне вимірювання рН застосовують також для безперервного контролю кислотності під час хірургічних втручань, при діагностиці деяких шкірних захворювань, дослідженні нових лікарських препаратів тощо.
Для визначення рН потенціометричним методом необхідно скласти гальванічний елемент з двох електродів: перший – електрод порівняння з постійним значенням електродного потенціалу, другий – електрод визначення, потенціал якого залежить від концентрації (активності) йонів Гідрогену. Найчастіше для визначення рН застосовують такі гальванічні кола.
Воднево– хлорсрібне коло. У цьому колі водневий електрод є електродом визначення, хлорсрібний електрод – електродом порівняння. Схематично його зображують так:
(–) (Pt) H |
2H O+ KCl, AgCl Ag (+). |
|||||
2 |
3 |
|
|
|
|
|
За температури 298 К ЕРС цього гальванічного елемента дорівнює |
||||||
E = ϕ хс − ϕ водн = ϕ хс + 0,059 рН , |
|
|||||
тоді |
|
|
|
|
|
|
рH = |
E − ϕ хс |
= |
E − 0,22 |
, |
(1) |
|
|
|
|||||
|
0,059 |
0,059 |
|
|
||
де ϕхс – потенціал насиченого хлорсрібного електрода, |
який за температури |
|||||
298 К дорівнює +0,22 В. |
|
|
|
|
|
|
Якщо замість насиченого хлорсрібного електрода використовують насиче-
ний каломельний електрод (ϕкалом. = +0,25 В) , величину рН обчислюють за формулою:
рН = Е − ϕ калом = E − 0,25 . 0,059 0,059
Застосування водневого електрода для вимірювання рН обмежене внаслідок складності його виготовлення. Не придатний він також і для вимірювання рН деяких біологічних рідин, тому що окремі органічні речовини, наприклад білки, осаджуються на поверхні платинової пластинки, внаслідок чого одержані значення рН будуть помилковими.
Ці недоліки відсутні у скляного електрода з водневою функцією, тому він знайшов широке застосування в сучасних медико-біологічних дослідженнях.
Хлорсрібно-скляне коло. У цьому елементі скляний електрод з водневою функцією є індикаторним, а хлорсрібний – електродом порівняння. Схему цього елемента умовно записують так:
(–) Ag AgCl, HCl скляна мембрана досліджуваний розчин з рНх KCl, AgCl Ag(+)
Величина ЕРС кола дорівнює:
38

= ϕ (+) − ϕ (-) .
E хс скл
Підставивши у це рівняння значення ϕскл, одержимо
E = ϕ (+) −ϕ 0 |
− 0,059lga |
H O+ |
|
|||
хс |
скл |
|
|
|
||
|
|
|
|
3 |
|
|
Якщо ϕ(+)хс – ϕ 0скл = ϕ 0/, то E = ϕ 0/ + 0,059 pH, звідки |
|
|||||
|
|
|
E − ϕ |
0 / |
|
(2) |
|
рH = |
|
. |
|||
|
|
|
|
|
||
|
|
0,059 |
|
|
||
Стандартний потенціал скляного електрода ϕ 0скл |
залежить від сорту елек- |
|||||
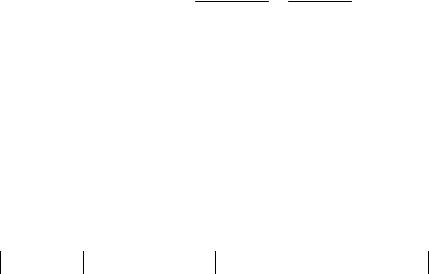
тродного скла. Він змінюється з часом, і тому рН розчинів звичайно вираховують не за рівнянням (2), а визначають за допомогою калібрувального графіка. Для цього спочатку калібрують скляний електрод за серією буферних розчинів з точно відомими значеннями рН. За одержаними даними будують калібрувальний графік у координатах Е – рН (рис. 4.1). Потім, вимірявши Ех кола з досліджуваним розчином, за калібрувальним графіком знаходять величину водневого показника.
Рис. 4.1 Калібрувальний графік для визначення рН
Для вимірювання ЕРС таких елементів використовують спеціальні прилади – потенціометри. Якщо шкала цих приладів проградуйована в одиницях рН, то відпадає необхідність у побудові калібрувального графіка. Такі потенціометри одержали назву рН– метрів. Промисловість випускає велику кількість різних рН– метрів, найбільш поширені такі прилади: рН-150М, П-261, ОР-110, ОР-113, йономіри ЕВ-74, І-160, І-130М тощо.
Потенціометричним титруванням називають метод визначення еквівалентного об’єму титранта за різкою зміною електрорушійної сили (ЕРС) відповідного гальванічного елемента.
Гальванічний елемент складається з індикаторного електрода та електрода порівняння.
Величина потенціалу індикаторного електрода повинна залежати від концентрації йонів, що приймають участь або утворюються в процесі титрування, а електрода порівняння – сталою.
Потенціометричне титрування може проводитись за реакціями нейтралізації, окислення-відновлення, комплексоутворення, осадження.
Електродну пару при титруванні занурюють у досліджуваний розчин і до-
39
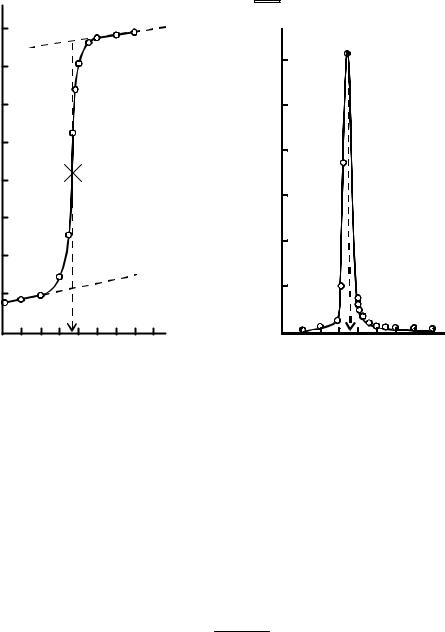
дають з бюретки титрований розчин малими порціями (0,5-1,0 см3). Після кожної порції вимірюють ЕРС елемента з допомогою високоомних потенціометрів (рН-метрів). Величина ЕРС спочатку змінюється повільно, а поблизу точки еквівалентності різко, стрибком. За даними титрування будують інтегральну криву в координатах Е – V (рис . 4.2, а).
E, мВ |
|
|
|
E , мВ/см3 |
|
|
|
200 |
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
1200 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
1000 |
|
|
|
-100 |
|
|
|
800 |
|
|
|
|
|
|
|
|
|
|
|
-200 |
|
|
т. е. |
600 |
|
|
|
|
|
|
|
|
|
|
|
-300 |
|
|
|
|
|
|
|
-400 |
|
|
|
400 |
|
|
|
|
|
|
|
|
|
|
|
-500 |
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
0 |
2 |
4 |
6 Vт, cм3 |
0 |
2 |
4 |
6 Vт, cм3 |
|
|
а |
|
|
б |
|
|
Рис. 4.2 Інтегральна (а) та диференціальна (б) криві потенціометричного титрування
Опустивши перпендикуляр з середини стрибка (точка еквівалентності) на вісь об’єму визначають еквівалентний об’єм титранта.
Точка еквівалентності може бути визначена також за диференціальною кривою титрування, що відображає залежність DЕ/DV – V (рис. 4.2, б).
Перпендикуляр, опущений з вершини кривої на вісь абсцис вказує на еквівалентний об’єм титранта.
Концентрацію досліджуваного розчину обчислюють за співвідношенням
Cx×V = Cт×Vт , звідки:
Cx = Cт × Vт V
де Сx, Ст – концентрація досліджуваного розчину і титранта; V, Vт – об’єм досліджуваного розчину та титранта.
Потенціометричне титрування може використовуватись при кількісному визначенні методами нейтралізації, осадження, комплексоутворення, окислен- ня-відновлення. При цьому вибір індикаторного електрода залежить від типу аналітичної реакції.
40
