
- •Глава 6. Химия и обмен липидов Клинико-лабораторное значение
- •В зависимости от функций в организме различают две группы липидов:
- •По химическому строению липиды разделяют на омыляемые и неомыляемые
- •Nb! Жирные кислоты - это алифатические карбоновые кислоты
- •Nb! Некоторые липиды могут гидролизоваться щелочью
- •Nb! Свойства ацилглицеролов зависят от их состава
- •Nb! Функции ацилглицеролов в организме многообразны
- •Nb! Воска выполняют защитные функции
- •Nb! Сложные липиды - главные компоненты биологических мембран
- •Nb! Фосфолипиды - сложные липиды, содержащие фосфор
- •Nb! Сфингофосфолипиды содержат в своем составе сфингозин
- •Плазмалогены - эфирные производные глицерофосфолипидов
- •Nb! Гликолипиды - сфинголипиды, содержащие углеводы
- •Nb! Сульфолипиды – гликолипиды, содержащие остаток серной кислоты
- •Nb! Неомыляемые липиды не гидролизуются щелочью
- •Высшие спирты
- •Высшие углеводороды - производные изопрена
- •Nb! Простагландины - продукты окисления жирных кислот
- •Nb! Желчные кислоты образуются в печени из эфиров холестерола
- •Nb! Переваривание липидов катализирует липаза
- •Nb! Продукты гидролиза липидов участвуют в образовании мицелл
- •Основная часть всосавшихся в тонком кишечнике липидов принимает участие в ресинтезе таг.
- •Nb! Липиды транспортируются в крови в составе липопротеинов
- •Такая конфигурация является высоко устойчивой и облегчает растворимость микрокапель неполярных липидов. Номенклатура и характеристика лп
- •Nb! Липиды, поступившие из кишечника (экзогенные), транспортируются в кровотоке в составе хм
- •Nb! Липиды, синтезированные в печени (эндогенные), транспортируются в форме лпонп и лпвп
- •Роль липопротеинов плазмы крови в развитии атеросклероза
- •Липопротеин (а)
- •Наследственные нарушения обмена липопротеинов плазмы крови
- •Источники, депонирование, высвобождение и транспорт жирных кислот в организме
- •Расходование жирных кислот
- •Окисление жирных кислот
- •Nb! Энергетический выход -окисления жирных кислот зависит от длины углеводородной цепи.
- •Регуляция -окисления
- •Биосинтез жирных кислот
- •Особенность синтеза жирных кислот грудного молока
- •Происхождение ненасыщенных жирных кислот в клетках организма, метаболизм арахидоновой кислоты
- •Эйкозаноиды, или липидные гормоны
- •Синтез фосфолипидов
- •Сурфактант легких
- •Разрушение веществ в лизосомах и лизосомальные заболевания, вызванные недостатком ферментов
- •Общие аспекты обмена холестерола в организме, биосинтез холестерола
- •Образование и утилизация кетоновых тел
Липопротеин (а)
В последнее время была установлена взаимосвязь атеросклероза еще с одним видом липопротеинов - липопротеином (а) (ЛП(а)) . В крови больных с предрасположенностью к атеросклерозу и отсутствием других факторов риска находится большое количество ЛП (а). Высокий уровень его в крови сопутствует приступам стенокардии, инфарктам, сужению сосудов и занимает одно из ведущих мест среди наследуемых факторов риска коронарной болезни сердца. Специальная диета и другие мероприятия, которые используются обычно для снижения факторов риска, не оказывают влияние на уровень ЛП (а). Концентрация ЛП (а) чрезвычайно стабильна в течение всей жизни в отличие от уровня ЛПНП и ЛПВП.
ЛП (а) (рис 6.26) представляет собой сферические частицы, флотирующие в диапазоне плотности между ЛПНП и ЛПВП (1,050–1,085 г/мл). По своей структуре он похож на ЛПНП. Частица содержит ХС, ФЛ и одну молекулу апоВ-100. Основным отличительным признаком является наличие дополнительного большого белка, получившего название апо(а), который связан с апоВ-100.
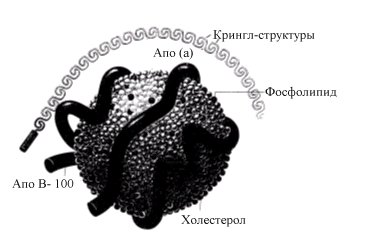
Рис.6.26. Строение ЛП (а)
Между апо(а) и плазминогеном существует близкое структурное сходство. Плазминоген является предшественником протеазы крови – плазмина. Субстратом для него служит фибрин, главный белковый компонент кровяного сгустка. Так как плазминоген сам по себе не является активным ферментом, он может циркулировать в крови, не оказывая своего действия. Как правило, на атеросклеротических бляшках формируются сгустки крови. Это способствует повреждению сосудов, сужению их просвета и возникновению клинических проявлений атеросклероза. Поэтому пациентам с ишемической болезнью сердца вводят активаторы плазминогена, чтобы ускорить разрушение кровяных сгустков.
Апо (а) и плазминоген содержат аминокислотные последовательности, богатые цистеином, которые образуют петли, получившие название кринглов. Каждый крингл (а их всего 38) состоит из нескольких десятков аминокислот и имеет три внутренних дисульфидных мостика. Каждая крингл-структура имеет свое функциональное значение.
Предполагается, что у здорового человека ЛП (а) участвует в восстановлении повреждений сосудистой стенки. Когда возникает дефект, сгустки крови, богатые фибрином, постепенно закрывают его и препятствуют вытеканию крови из сосуда. На стадии заживления ран, когда сгусток начинает растворяться, частичное разрушение фибринового сгустка демаскирует центры, которые способствуют ассоциации ЛП (а) со сгустком крови.

Рис. 6.27. Возможные точки приложения действия ЛП (а) на стенку сосуда
Роль ЛП (а) в атерогенезе. Оказалось, что по структуре апо(а) похож на "фактор роста гепатоцитов", стимулирующий размножение многих типов клеток. Возникла гипотеза, что ЛП (а), подобно последнему, стимулирует деление клеток, тем самым способствует их атеросклеротической пролиферации в сосудистой стенке(рис.6.27) С другой стороны, апо(а) благодаря своему сходству с плазминогеном конкурирует с ним за доступ к фибрину, к центрам связывания на поверхности клеток и к активаторам плазминогена. В то же время апо(а) не может растворять фибрин, как это делает активный плазминоген. Это свойство мешает проявлению плазминогеном оптимальной активности и тем самым нарушает равновесие между образованием сгустка и его разрушением. В норме конкуренция между плазминогеном и апо(а) не имеет большого значения, так как концентрация плазминогена в крови значительно превышает концентрацию апо(а). При формировании же атеросклероза, которое занимает годы, даже небольшая задержка во времени растворения сгустка может оказать решающее влияние на развитие заболевания.
Подходы к лечению. Чтобы добиться частичной регрессии атеросклеротической бляшки, необходимо снизить общий ХС плазмы до идеального уровня (150–160 мг%) и поддерживать этот уровень, по меньшей мере, 1,5-2 г. Делипидация атеросклеротических бляшек будет протекать быстрее, если дополнительно удастся повысить уровень ЛПВП в плазме крови.
