- •Глава 6. Химия и обмен липидов Клинико-лабораторное значение
- •В зависимости от функций в организме различают две группы липидов:
- •По химическому строению липиды разделяют на омыляемые и неомыляемые
- •Nb! Жирные кислоты - это алифатические карбоновые кислоты
- •Nb! Некоторые липиды могут гидролизоваться щелочью
- •Nb! Свойства ацилглицеролов зависят от их состава
- •Nb! Функции ацилглицеролов в организме многообразны
- •Nb! Воска выполняют защитные функции
- •Nb! Сложные липиды - главные компоненты биологических мембран
- •Nb! Фосфолипиды - сложные липиды, содержащие фосфор
- •Nb! Сфингофосфолипиды содержат в своем составе сфингозин
- •Плазмалогены - эфирные производные глицерофосфолипидов
- •Nb! Гликолипиды - сфинголипиды, содержащие углеводы
- •Nb! Сульфолипиды – гликолипиды, содержащие остаток серной кислоты
- •Nb! Неомыляемые липиды не гидролизуются щелочью
- •Высшие спирты
- •Высшие углеводороды - производные изопрена
- •Nb! Простагландины - продукты окисления жирных кислот
- •Nb! Желчные кислоты образуются в печени из эфиров холестерола
- •Nb! Переваривание липидов катализирует липаза
- •Nb! Продукты гидролиза липидов участвуют в образовании мицелл
- •Основная часть всосавшихся в тонком кишечнике липидов принимает участие в ресинтезе таг.
- •Nb! Липиды транспортируются в крови в составе липопротеинов
- •Такая конфигурация является высоко устойчивой и облегчает растворимость микрокапель неполярных липидов. Номенклатура и характеристика лп
- •Nb! Липиды, поступившие из кишечника (экзогенные), транспортируются в кровотоке в составе хм
- •Nb! Липиды, синтезированные в печени (эндогенные), транспортируются в форме лпонп и лпвп
- •Роль липопротеинов плазмы крови в развитии атеросклероза
- •Липопротеин (а)
- •Наследственные нарушения обмена липопротеинов плазмы крови
- •Источники, депонирование, высвобождение и транспорт жирных кислот в организме
- •Расходование жирных кислот
- •Окисление жирных кислот
- •Nb! Энергетический выход -окисления жирных кислот зависит от длины углеводородной цепи.
- •Регуляция -окисления
- •Биосинтез жирных кислот
- •Особенность синтеза жирных кислот грудного молока
- •Происхождение ненасыщенных жирных кислот в клетках организма, метаболизм арахидоновой кислоты
- •Эйкозаноиды, или липидные гормоны
- •Синтез фосфолипидов
- •Сурфактант легких
- •Разрушение веществ в лизосомах и лизосомальные заболевания, вызванные недостатком ферментов
- •Общие аспекты обмена холестерола в организме, биосинтез холестерола
- •Образование и утилизация кетоновых тел
Nb! Липиды, синтезированные в печени (эндогенные), транспортируются в форме лпонп и лпвп
Одновременно в печени интенсивно протекает синтез липидов из изначальных субстратов (уксусной кислоты, глицерола, жирных кислот и т.д.). Транспорт новосинтезированных липидов из печени в кровь, а оттуда – к органам и тканям осуществляют два других типа липопротеиновых частиц, формирующихся в печени - ЛПОНП и ЛПВП. Принципы устройства этих частиц аналогичны таковым у ХМ. Разница состоит в том, что размеры ЛПОНП и еще более ЛПВП меньше, чем у ХМ. Доля белкового компонента в их составе выше (10,4 % и 48,8 % от массы частицы соответственно), а содержание ТАГ – ниже (31,4 % и 1,8 % от массы частицы соответственно). Вследствие этого плотность ЛПОНП и ЛПВП выше, чем у ХМ.
Таблица 6.6.Ферменты обмена ЛП
|
Фермент |
Источник |
Функция |
|
ЛПЛ |
Адипоциты Миоциты |
Частичное разрушение ХМ и ЛПОНП посредством высвобождения ЖК из ТАГ и ФЛ |
|
Печеночная липаза |
Гепатоциты |
Высвобождение ЖК из ТАГ, ФЛ в составе ЛППП и ЛПВП |
|
Лецитин-холестерол-ацилтрансфераза (ЛХАТ) |
Гепатоциты |
Необходим для обратного транспорта холестерола; осуществляет эстерификацию холестерола за счет переноса ЖК с лецитина на свободный холестерол |
ЛП, содержащие апоВ-100. Главным липидным компонентом ЛПОНП являются ТАГ. Однако, в отличие от ХМ, эти ТАГ синтезируются в клетках печени. Поэтому они называются эндогенными, в то время как в составе ХМ – экзогенными (поступившими с пищей). Основной функцией ЛП, содержащих апоВ, является транспорт ТАГ из печени к периферическим тканям, особенно в жировую и мышечную. Для синтеза ЛПОНП в гепатоцитах требуется апоВ-100, ЭХ, ТАГ и ФЛ.
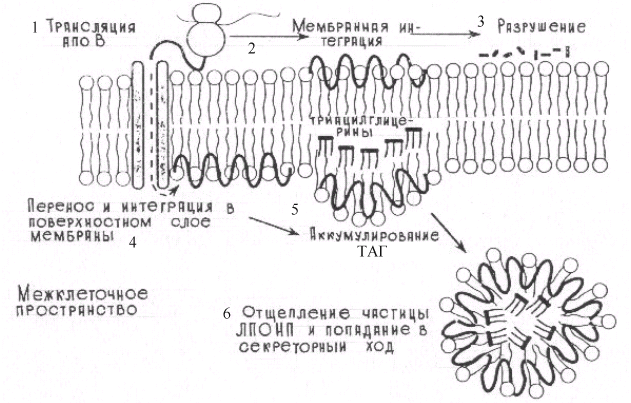
АпоВ-100 - это большой гидрофобный белок (4536 аминокислотных остатков), который синтезируется в печени. На его долю приходится 30–40% от общего количества белка в составе ЛПОНП и более 95 % белка ЛПНП. Сборка ЛП, содержащих апоВ-100, идет в ЭР; каждая частица ЛПОНП содержит один апоВ-100(рис 6.18).
Важным качеством апоВ-100 является его способность контролировать прохождение частицы ЛПОНП через мембрану ЭР. Она зависит от степени гидрофобности его аминокислотной последовательности. Гидрофобные сегменты, включающие обычно более 16 аминокислотных остатков, образуют трансмембранные "пропускающие" домены.
ТАГ для ЛПОНП синтезируются путем эстерификации жирных кислот, поступающих в гепатоциты из плазмы крови (источником их является, например, липолиз в жировой ткани) или синтезирующихся de novo в печени. Уровень синтеза ЛПОНП регулируется также наличием холестерола, в особенности, образованием эфиров холестерола под действием ацил-КоА:холестеролацилтрансферазы (АХАТ). Этот фермент локализован в ЭР близко к месту синтеза ЛПОНП. Его функцией является образование эфиров холестерола.
Сборка ЛПОНП регулируется на уровне посттрансляции за счет контроля наработки апоВ-100. Значительное количество этого белка подвергается разрушению; такой контроль на уровне посттрансляции тесно взаимосвязан с обменом липидов в печени. Дело в том, что единственным видом липидов, которые сразу образуют стабильный комплекс с апоВ, являются фосфолипиды. Только комплекс апоВ с ФХ обладает способностью проходить через мембрану ЭР. Ассоциация апоВ с ФХ сразу после трансляции обеспечивает возможность образования развернутой структуры белковой молекулы, необходимой для прохождения через мембрану. Если этого комплексирования не происходит, апоВ не может пройти через мембрану, и он неизбежно подвергается разрушению в ЭР.
Другие липиды выступают в качестве регуляторов образования и секреции ЛП. Так, количество жирных кислот, подвергшихся всасыванию в кишечнике или синтезировавшихся de novo, влияет на уровень образования ТАГ, их использования для сборки ЛП. Влияние на секрецию состоит не только в увеличении количества секретируемых липопротеиновых частиц. У вновь образованных ЛПОНП может существенно варьировать размер ядра. Наряду с ядерной частью ЛП нарастает и поверхностный монослой, так как параллельно ТАГ увеличивается синтез ФЛ.
В регуляции сборки ЛПОНП чрезвычайно важную роль играют фосфатидилхолины. Об этом свидетельствует тот факт, что у животных с дефицитом холина развивается так называемое жировое перерождение печени. Это такое состояние, при котором клетки печеночной ткани переполняются ТАГ из-за нарушения их секреции. Примечательно, что блокируется секреция только ЛПОНП, в то время как секреция ЛПВП не изменяется. Внесение холина в питательную среду для культивирования гепатоцитов, выделенных у крыс с дефицитом холина, восстанавливало способность к образованию и секреции ЛПОНП. Холин необходим не только для синтеза ФХ, но и для образования апо В.
|
|
Рис.6.18. Схематическое изображение сборки ЛПОНП в клетках печени. Гипотеза, предполагающая 6 основных этапов сборки ЛПОНП в ЭР: 1–трансляция апоВ на мембраносвязанных рибосомах; 2–достройка белка на цитоплазматической стороне мембран ЭР. В последующем образовавшийся белок или разрушается (3), или проходит через мембрану ЭР и ассоциируется с наружной его стороной (4). Сборка частицы ЛПОНП происходит в своеобразном кармане, который образуется в наружном слое ЭР. Карман представляет собой место, куда проникают ТГ для образования ЛПОНП (5). На последнем этапе сформировавшиеся частицы ЛПОНП отщепляются от мембраны и секретируются из клетки (6)
Апопротеины ЛПОНП. Все белки, которые входят в состав ЛП, на пути своего образования проходят схожие этапы. Они сводятся к следующим процессам: 1) трансляция иРНК на рибосомах; 2) перемещение через ЭР; 3) посттрансляционная модификация – процессинг (образование дисульфидных мостиков, гликозилирование, фосфорилирование); 4) сборка в транспортные формы; 5) секреция из клетки. Новосинтезированная частица ЛПОНП содержит одну молекулу апоВ-100. АпоС-II, апоС-III и апоЕ поступают на нее от ЛПВП после того, как ЛПОНП попадают в плазму крови. Они требуются для ускорения метаболизма ЛПОНП.
Обмен ЛПОНП (рис.6.19). ЛПОНП секретируются из печени в кровь. На эндотелии сосудистой стенки в периферических тканях ТАГ в составе ЛПОНП, как и в случае ХМ, подвергаются действию фермента ЛПЛ. Необходимым кофактором для проявления активности ЛПЛ является апоС-II. Высвобождающиеся ЖК поступают в клетки органов и тканей.
Вместе с апопротеинами, ЛПОНП получают от ЛПВП ЭХ. ЛПВП участвуют в механизме разгрузки клеток от избытка холестерола и образование ЭХ – важный элемент их функции. Этот процесс происходит с помощью фермента ЛХАТ4.

Рис.6.19. Обмен ЛПОНП.
Перенос ЭХ с ЛПВП на ЛПОНП осуществляется специальным белком, переносящим липиды (ЛПБ5). ЛПБ также известен как белок, переносящий ЭХ (ЭХПБ), или апоD. ЛХАТ и ЛПБ являются основными участниками процесса “обратного транспорта холестерола”, результатом которого является перенос холестерола из тканей в печень и последующее его выделение из организма. Однако в плазме крови ЛПВП часть “своего” холестерола в форме ЭХ передают ЛПОНП по мере того, как в составе последних уменьшается количество ТАГ.
ЭХ – более предпочтительная форма транспорта холестерола в составе ЛП, поскольку они обладают выраженными гидрофобными свойствами. Сложноэфирная связь в ЭХ образуется за счет присоединения ацильной группы, отщепляемой от -углеродного атома остатка глицерола в составе лецитина ЛПВП, к гидроксильной группе у С-3 холестерина. Этот процесс катализирует ЛХАТ. Перенос образовавшихся ЭХ между частицами липопротеинов осуществляет ЛПБ.
Таким образом, общая динамика катаболизма ЛПОНП заключается в потере ТАГ и приобретении ЭХ. Метаболизм ЛПОНП тесно связан с обменом ЛПВП и ЛПЛ.
Липопротеины промежуточной плотности (ЛППП). Из ЛПОНП в ходе описанных выше превращений образуются ЛППП. Они не могут эффективно связываться с ЛПЛ, их последующий обмен ЛППП происходит с помощью другого липолитического фермента, печеночной липазы (ПЛ)6. Этот фермент синтезируется в гепатоцитах. В синтезе его также принимает участие синусоидальный эндотелий. ПЛ более эффективно, чем ЛПЛ, катализирует гидролиз ФЛ.
О регуляции ПЛ известно немного. Увеличение ее активности происходит под влиянием тестостерона, других андрогенов и при беременности. Примечательно, что в обоих случаях для организма характерен атерогенный липидный состав крови. Ингибируется фермент эстрогенами. В отличие от ЛПЛ печеночная липаза нечувствительна к приему пищи и инсулину. Имеется обратная зависимость между активностью ПЛ и уровнем ЛПВП.
Около 75% ЛППП попадает в печень после связывания апоЕ с рецепторами для ЛПНП или рецепторами для апоВ/апоЕ. Таким образом, чем больше ЛППП удаляется из кровотока, тем меньше риск развития атеросклероза, поскольку уменьшается уровень ЛПНП в крови. Около 25% ЛППП превращается в ЛПНП. Это единственный источник образования ЛПНП у человека. Полагают, что в этом процессе может принимать участие ПЛ.
Метаболизм ЛПНП. ЛПНП являются основным средством доставки холестерола в клетки органов и тканей. В процессе своего образования в плазме ЛПНП теряют апоЕ, и единственным белковым компонентом в их структуре становится апоВ-100, который обеспечивает специфическое узнавание ЛПНП рецепторами клеток (апоВ/Е рецепторы). Количество таких рецепторов на поверхности клетки составляет от 15 000 до 70 000. Путем эндоцитоза, опосредованного рецепторами, ЛПНП поступают в клетки. Доля такого механизма в удалении ЛПНП из плазмы составляет 75%. Остальная часть их удаляется с помощью рецепторов, имеющих низкое сродство с ЛПНП. Такой путь получил образное название “мусорный путь”. Он обнаружен в макрофагах и ретикулярном эндотелии.
Таблица 6.7. Свойства клеточных рецепторов ЛП крови
|
Характеристики |
Рецептор к апоЕ (рецептор “обломков”) |
Рецептор “мусорщик” |
Рецептор апоВ/Е (к ЛПНП) |
|
Тканевая локализация |
Печень |
Макрофаги/моноциты, эндотелиальные клетки синусоидных капилляров печени |
Фибробласты, гладкомышечные клетки, адипоциты, печень, надпочечники, яичники, семенники, лимфоциты, макрофаги |
|
Липопротеиновые лиганды |
Обломки ХМ, ЛПВП, обогащенные апоЕ |
Химически измененные ЛПНП; бактериальный липополисахарид |
ЛПНП, ЛПВП, обогащенные ХС, ЛПОНП, обломки ХМ |
|
Функции |
Поглощение обломков ХМ и ЛПВП, обогащенных ХС; доставка ХС в печень для выведения |
Поступление в клетки и разрушение измененных ЛП; защита от эндотоксического шока |
Регуляция уровня ЛПНП; перераспределение ХС; утилизация ХС |
Обладая низким сродством к нативным ЛПНП, данные рецепторы хорошо связываются с измененными (окисленными) формами ЛПНП, которые являются более атерогенными, чем интактные ЛПНП. Рецепторы ЛПНП находятся в ворсинчатых углублениях на поверхности клеток и представдяют собой мембранные гликопротеины, состоящие из 5 доменов, которые располагаются в следующей последовательности, начиная с N-конца полипептидной цепи (рис.6.20): 1) лигандсвязывающий домен состоящий из 7 повторяющихся последовательностей по 40 аминокислот. На С-конце каждой из этих последовательностей имеется отрицательный заряд за счет моноаминодикарбоновых кислот. К отрицательно заряженным участкам присоединяются положительно заряженные остатки аминокислот, находящиеся в составе апо В или апо Е на поверхности ЛПНП; 2) домен, гомологичный предшественнику эпидермального фактора роста - считается, способствует связыванию апо В лигандным доменом. Он также вовлекается в процесс диссоциации рецептора и ЛПНП после проникновения комплекса в клетку; 3) домен, богатый гидпроксиаминокислотами - треонином и серином, к которым присоединены олигосахариды. Функция не известна; 4) трансмембранный домен обусловливает прикрепление рецептора к мембране; 5) домен, который вовлекается в процесс избирательного попадания рецептора в ворсинчатое углубление на поверхности клеточных мембран.

Рис.6.20. Строение рецептора ЛПНП
На следующем этапе связанная с рецептором частица ЛПНП подвергается поглощению клеткой (рис.6.21). Внутри образовавшихся эндосом, липопротеины отщепляются от рецепторов. В дальнейшем ЛПНП поступают в лизосомы, где они разрушаются. В лизосомах происходит гидролиз эфиров холестерола, находящихся в составе ЛПНП. В результате образуется свободный холестерол или окисленные его формы. Свободный холестерол используется для различных целей. Он служит структурным компонентом клеточных мембран, субстратом для синтеза стероидных гормонов и желчных кислот. Продукты же его окислительного превращения оказывают регуляторное воздействие на организм.

Рис 6.21. Схема поступления в клетки ЛПНП
Контролирующие механизмы координируют использование внутри- и внеклеточных источников холестерола. При достаточном количестве ЛПНП клетки млекопитающих, с помощью рецепторов, преимущественно используют их в качестве источника холестерола. В это время внутриклеточная система синтеза холестерола находится как бы в резерве, не функционирует в полную силу. Дело в том, что внутриклеточное высвобождение из ЛПНП свободного холестерола или окисленных его форм, происходящее таким путем, воздействует на ряд процессов по принципу обратной связи и защищает клетку от чрезмерного накопления ХС. Во-первых, уменьшается активность 3-гидрокси-3-метилглютарил-КоА (ГОМГ-КоА) синтетазы и ГОМГ-КоА редуктазы, двух ключевых ферментов внутриклеточного биосинтеза ХС (см. параграф "Биосинтез ХС"). Во-вторых, стеролы активируют фермент ацил-КоА-холестерол- ацилтрансферазу (рис.6.22), который катализирует этерификацию ХС. Это позволяет клеткам депонировать избыток ХС в форме своеобразных внутриклеточных капель, содержащих гидрофобные ЭХ. В-третьих, уменьшается синтез новых рецепторов к ЛПНП7, что снижает поступление в клетку этих липопротеиновых частиц.
Обратный транспорт холестерола из периферических тканей к печени осуществляется посредством ЛПВП. Эти липопротеиновые частицы удаляют избыток свободного (неэстерифицированного) холестерола с поверхности клеток.
ЛПВП - это целый класс липопротеиновых частиц, которые существенно отличаются друг от друга по липидному и апопротеиновому составу, размерам и функциям. Образуются ЛПВП в печени. Оттуда они секретируются в кровоток в "незрелом" виде, то есть они имеют дисковидную форму. Такая форма обусловлена отсутствием у них ядра из нейтральных липидов. Основным их липидным компонентом являются фосфолипиды.
|
|
Рис.6.22. Реакция внутриклеточного образования ЭХ, катализируемая АХАТ |

Рис.6.23. Основные пути транспорта эфиров холестерола в организме
Таблица 6.8. Происхождение свободного и эстерифицированного холестерола в плазме крови
|
Липопротеин |
Свободный холестерол |
Эфиры холестерола |
|
ХМ |
Синтез в слизистой кишечника |
Свободный холестерол |
|
ЛПОНП |
Гепатоциты |
АХАТ гепатоцитов |
|
ЛПНП |
Гепатоциты |
АХАТ гепатоцитов – 60 % ЛХАТ плазмы – 40 % |
|
ЛПВП |
Периферические клеточные мембраны – 70 % ЛПОНП, ЛПНП – 30 % |
ЛХАТ плазмы – 100 % |
Переход свободного холестерола из клеток на ЛПВП обусловлен разницей его концентраций на поверхности клеточных мембран и липопротеиновых частиц. Следовательно, он продолжается до тех пор, пока не выровняется концентрация холестерола между донором (поверхность мембран) и акцептором (ЛПВП). Поддержание градиента концентрации обеспечивается постоянным превращением свободного холестерола, поступающего на ЛПВП, в эфиры холестерола. Эта реакция, как уже указывалось, катализируется ферментом лецитин-холестерол-ацилтрансферазой (ЛХАТ8). Образующиеся эфиры холестерола являются полностью гидрофобными соединениями (в отличие от свободного холестерола, у которого имеется гидроксильная группа, сообщающая ему гидрофильность). В силу своей гидрофобности эфиры холестерола теряют способность к диффузии и не могут вернуться обратно в клетку. Они формируют гидрофобное ядро внутри частиц, благодаря которому ЛПВП приобретают сферическую форму. Здесь, в кровотоке из таких ЛПВП, осуществляется транспорт вновь образованных неполярных ЭХ из ЛПВП на ХМ, ЛПОНП, ЛППП, который ускоряется за счет белков-переносчиков (рис.6.23). Затем происходит опосредованное рецепторами поступление ЛПВП, как и других богатых ЭХ ЛП, в гепатоциты с последующим их катаболизмом. В частности, высвобождающиеся ЭХ служат исходным субстратом для образования желчных кислот.