
Основы иммунологии
.pdf
патологических состояний. Дефицит С1, С2, С4 и С5 проявляется синдромом схожим с системной красной волчанкой. Дефицит С3 характеризуется возвратными гнойными инфекциями.
Кроме недостаточности основных компонентов встречаются дефициты ингибиторов системы комплемента: С1-ингибитора и С3инактиватора. Клинически недостаточность С1-ингибитора проявляется наследственным ангионевротическим отеком. Отеки гортани, конечностей и другие возникают из-за увеличения концентрации фрагмента С2-компонента, обладающего вазоактивным действием. Обычно такие больные гетерозиготны и у них синтезируется небольшое количество ингибитора. Уровень его можно повысить, вводя анаболические стероиды, либо проводя заместительную терапию самим ингибитором.
Направления лечения первичных иммунодефицитов
-Пересадка костного мозга, неонатального тимуса, эмбриональной печени – с целью замещения недостающих клеток и создания условий для их полноценной дифференцировки. Трансплантация используется при тяжелых комбинированных ИД.
-Заместительная терапия иммуноглобулинами, ферментами, гормонами тимуса, медиаторами, витаминами и другими факторами.
-Антибактериальная терапия при сопутствующей инфекции.
-Генная терапия: введение в клетки СИ (лимфоциты) больных нормальных генов. Первым был введен ген аденозиндезаминазы в лимфоциты больных с недостаточностью этого фермента.
Вторичные иммунодефициты
Вторичные (приобретенные) ИД формируются под действием окружающей среды, встречаются гораздо чаще, чем первичные.
Признаки вторичных ИД:
отсутствие наследственной обусловленности
91

возникновение на фоне нормальной реактивности организма
связь с причинным фактором, обусловившим ИД
Причины вторичных ИД
1.Экологические неблагоприятные воздействия на организм и систему иммунитета (физические, химические, биологические).
2.Заболевания, поражающие систему иммунитета:
–вирусные (чаще)
–бактериальные инфекции, паразитарные инвазии
–аллергические и аутоаллергические, онкологические
–нарушения обмена веществ, пролиферации клеток, потеря белка
–прочие тяжелые заболевания
3. Иммунодепрессивные методы лечения:
–лекарственная иммуносупрессия
–лучевая и другие виды энергии в больших дозах
–хирургические вмешательства и наркоз
–реакция «трансплантат против хозяина» (РТПХ) после аллотрансплантации костного мозга
4. Физический и эмоциональный стресс
5. Недостаточное питание и истощение (белковая, жироуглеводная, витаминная, микроэлементная недостаточность).
6.Профессиональные вредные факторы (химические, физические, психоэмоциональные).
7.Возрастные: недоношенность детей и патология старения («синдром пожилых»)
Вторичный, как и первичный, ИД может быть скрытым, не иметь клинических признаков и выявляется только при лабораторном обследовании. ИД с клиническими признаками является
иммунодефицитной болезнью. Клинически она проявляется хроническими гнойно-воспалительными инфекциями кожи, верхних дыхательных путей, легких, мочеполовой системы, желудочнокишечного тракта и других органов. От преходящих (транзиторных) сдвигов в системе иммунитета они отличаются сохранением нарушений в системе иммунитета после окончания действия причинного фактора.
92
По тяжести клинического течения различают легкие, средней тяжести, субкомпенсированные и тяжелые декомпенсированные вторичные иммунодефицитные болезни (ВИБ).
Вирусные вторичные иммунодефицитные болезни
Вирусы часто персистируют в организме человека без проявлений патологии, т.е. отмечается широко распространенное вирусоносительство. Это касается вирусов герпеса, цитомегаловируса, аденовирусов, вируса Эпштейн-Барр и многих других. При снижении уровня и дефицитах в системе интерферонов они способны индуцировать иммунодефицит и, следовательно, ВИБ несколькими путями:
–трансформируя геном клеток СИ;
–непосредственно разрушая иммунокомпетентные клетки,
–индуцируя апоптоз;
–связываясь с рецепторами и изменяя их активность, хемотаксис, активируя супрессоры;
–связывая или выделяя цитокины, т.е. модифицируя иммунореактивность.
Некоторые вирусы обладают способностью к репликации в самих иммунокомпетентных клетках. Примером такого механизма может быть известный тропизм к В-лимфоцитам вируса ЭпштейнБарр или избирательное поражение Т-хелперов вирусом ВИЧ. Вирусы многих острых инфекций, в частности, кори, гриппа, краснухи, ветряной оспы, паротита, герпеса – могут вызывать преходящую анергию на другие антигены. Клинически транзиторная иммуносупрессия выражается в развитии вирусно-бактериальных осложнений, нередко наблюдаемых при этих инфекциях. Персистенция вирусов гепатита может приводить к иммуномодуляции, супрессии Т-клеток.
Трансплацентарно передаваемые вирусы (цитомегалии, краснухи) оказывают повреждающее действие на различные ткани, в том числе и на клетки СИ. Наиболее значительные дефекты описаны при врожденной краснухе и цитомегалии. У части детей обнаружено отсутствие гуморального и клеточного иммунного ответа на
93
антигены, у других – селективный дефицит IgA. Последний дефект объясняют способностью вируса блокировать развитие клеток на промежуточной стадии дифференцировки.
Иммунодепрессия при активной цитомегаловирусной инфекции у детей проявляется снижением числа СD3+, CD4+-Т-лимфоцитов, угнетением фагоцитарной активности нейтрофилов. Такие дети предрасположены к развитию бактериальных и вирусных суперинфекций.
Нарушения в составе Т- и В-лимфоцитов наблюдаются при герпетической инфекции, когда увеличивается количество Т- активированных лимфоцитов на фоне общей Т- и В-лимфоцитопении и снижение экспрессии молекул HLA-системы. Хроническая персистенция вируса герпеса в лейкоцитах и нервных ганглиях приводит к развитию ИД.
Между вирусной инфекцией и недостаточностью СИ существует сложная патогенетическая взаимосвязь. С одной стороны, вирусная инфекция может индуцировать вторичный иммунодефицит, с другой
– у пациентов с недостаточностью иммунитета вирусная суперинфекция становится причиной тяжелых, угрожающих жизни, состояний, т.е. усиливает этот ИД.
Персистирующие вирусы и внутриклеточный иммунитет
Многие вирусы – герпеса, цитомегаловирус (ЦМВ), ЭпштейнаБарр, риновирусы, энтеровирусы постоянно присутствуют в клетках организма и, периодически активируясь, индуцируют различные клинические проявления. Ярким примером служат вирусы герпеса 1- 8 типов, которые персистируют в нервных ганглиях и вызывают поражения кожи и слизистых оболочек соответственно уровню локализации ганглиев – лябиальный, таракальный (опоясывающий герпес), сакральный (генитальный). Вирусы герпеса 8 типа персистируют в Т-лимфоцитах, Эпштейна-Барра – в В-клетках и других, ЦМВ – в макрофагах, лейкоцитах, клетках эпителия. У большинства людей, их носителей, они не вызывают инфекций, что, по-видимому, обусловлено достаточно высоким иммунитетом, прежде всего интерфероновым, т.к. их репликации не происходит.
Ярким примером вирусиндуцированного ИД служит ВИЧинфекция. Вирус иммунодефицита человека (ВИЧ) вызывает инфекционное заболевание, связанное с первичным поражением СИ
94
и развитием тяжелого вторичного иммунодефицита, на фоне которого активируется условно-патогенная и непатогенная микрофлора.
Вторичные иммунодефициты при заболеваниях
Все тяжелые заболевания приводят к развитию иммунологической недостаточности.
Одной из причин вторичного иммунодефицита служат нарушения обмена веществ. При сахарном диабете, например, угнетаются хемотаксис и фагоцитирующая активность нейтрофилов, в результате чего возникают кожные пиодермии, абсцессы.
При ожогах ИД возникают в связи с большой потерей иммуноглобулинов и белков комплемента с плазмой крови. Если площадь поражения кожи превышает 30%, развиваются нарушения клеточного иммунитета.
Опухоли выделяют иммуномодулирующие факторы и цитокины, подавляющие иммунитет. Наблюдается снижение количества Т- лимфоцитов, увеличение активности клеток-супрессоров, угнетение фагоцитоза. Особенно выраженные изменения возникают при распространенных опухолевых процессах с метастазированием.
Вторичные иммунодефициты при различных патофизиологических состояниях и стрессе
При хроническом голодании иммунодефициты возникают из-за недостатка белков, витаминов и микроэлементов. В этих случаях прежде всего страдает клеточная система иммунитета: снижается ответ лимфоцитов на митогены, наблюдается атрофия лимфоидной ткани, нарушается функция нейтрофилов.
Тяжелые физические нагрузки и сопутствующий стресс у спортсменов-профессионалов в зависимости от длительности нагрузки вызывают временные или стойкие иммуномодуляции. Отмечается снижение уровня иммуноглобулинов, субпопуляций Т- лимфоцитов, активности фагоцитоза. В этот «иммунодефицитный период» спортсмены высокочувствительны к различным инфекциям.
95
Показатели СИ обычно нормализуются в период отдыха, однако не всегда.
Вторичные ИД при хирургических операциях связаны с мощной стрессовой реакцией и с действием препаратов для наркоза. Развивается временное иммунодефицитное состояние, при котором падает количество Т- и B-лимфоцитов, снижается их функциональная активность. Нарушенные показатели восстанавливаются только через месяц, если отсутствуют факторы, угнетающие иммунитет.
При старении организма ИД являются результатом иммуномодуляций, возникающих от воздействия неблагоприятных факторов и от болезней, особенно вирусных. У здоровых пожилых людей (90-100 лет) показатели СИ близки их величинам у людей среднего возраста, хотя и имеют свои особенности.
Новорожденные и дети раннего возраста имеют показатели СИ иные, чем взрослые; у них циркулирует материнский IgG, полученный через плаценту, уровень которого снижается в 3-6 месяцев, что не является ИД. Недоношенные дети рождаются с различными дефектами СИ, связанными как с ее незрелостью, так и нередко с внутриутробными инфекциями. Искусственное вскармливание детей вызывает дефицит секреторного IgA и других защитных факторов (лизоцим и др.) материнского молока.
Аллергия и аутоиммунные заболевания
Аллергия
Термин "аллергия" (allos – другой, ergon – действие) применил в 1906 г. К. Пирке, который обозначил этим понятием приобретенное изменение специфической реакции организма на антигены. Близким этому является понятие «атопия» (от греч. «атопос» – отклоняющийся от нормы, необычный), которое ввели А. Кок и Р. Кук (1923 г.) для обозначения наследственных клинических форм повышенной чувствительности, обусловленной «реагинами», непреципитирующими и неагглютинирующими антителами.
П. Портье и Ш. Рише (1902 г.) описали феномен, названный «анафилаксией», который наблюдался после повторных инъекций
96
собакам чужеродных белков щупалец морских актиний, что приводило их к гибели (клиника анафилактического шока).
В настоящее время известно, что все перечисленные феномены отражают одно явление – аллергию на антигены.
Аллергия – это специфическая повышенная вторичная
иммунная реакция на аллерген, которая сопровождается повреждением тканей.
При первом контакте с антигеном – будущим аллергеном, развивается обычная иммунная реакция.
Специфичность аллергической реакции зависит от появления в организме антител (обычно иммуноглобулинов класса Е или, реже, IgG) а также иммунных Т-лимфоцитов (Тх 2 или Тх 1) к определенному аллергену. Они возникают после первого контакта с антигеном и уровень их увеличивается при новых контактах. Основные отличия аллергической реакции от обычной вторичной иммунной реакции – количественные и качественные, характеризуются накоплением антител.
Аллергия развивается не сразу, а через определенный период сенсибилизации – это время с момента первого контакта с антигеном до возникновения способности организма отвечать повышенной аллергической реакцией на новый контакт с ним. Период сенсибилизации длится от нескольких дней (не менее 7) до нескольких месяцев, в течение которых развивается обычная иммунная реакция и появляются IgE-антитела и сенсибилизированные Т- лимфоциты. В результате аллергической реакции выделяется большое количество биологически активных веществ – медиаторов и цитокинов аллергии, которые повреждают ткани и обусловливают клинические проявления аллергии – наступает «аллергический прорыв». Ему способствуют вирусные инфекции, выхлопные газы дизельных двигателей, сернистые соединения, курение.
Наследственная, генетическая предрасположенность
определяет развитие аллергии на конкретный аллерген. Гены, ответственные за аллергию, локализуются в 5-й и 11-й хромосомах. Они контролируют синтез ИЛ-4 и других цитокинов, участвующих в аллергических реакциях. У лиц с аллергией активность «проаллергических» генов повышена, что приводит к избыточной продукции цитокинов воспаления.
97
Аллергены – это антигены или гаптены, которые при повторном проникновении в сенсибилизированный организм вызывает аллергическую реакцию.
Различают неинфекционные и инфекционные аллергены.
К неинфекционным относятся: вещества растений (пыльца – пыльцевая аллергия, плоды – пищевая аллергия); животных и птиц – пищевые аллергены (молоко, яйцо), эпидермальные (шерсть, перо); бытовые аллергены – домашняя пыль (постельные клещи – дерматофагоиды, библиотечная пыль, шерсть домашних животных, синтетические изделия и др.); лекарственные и медикаментозные – практически все лекарства и медикаменты; аллергены насекомых (яды и др.); профессиональные – различные химические вещества (в том числе синтетические изделия), лаки, краски, неорганическая и органическая пыль, аэрозоли веществ.
Аллергены вызывают аллергию, присутствуя в очень низких концентрациях (ниже предельно допустимых концентраций вредных веществ в промышленности). Суммарная доза аллергенной пыльцы, полученной больным за период цветения растения, может составлять 1 мкг.
Инфекционными аллергенами могут служить антигены бактерий, грибов, вирусов и паразитов (см. выше).
Механизмы иммунопатологических реакций
По механизму развития иммунопатологические реакции делятся на два вида: реакции немедленного и замедленного типов. Оба вида
– результат иммунного аллергического воспаления.
Немедленные аллергические реакции зависят от наличия антител различных классов к аллергену (в первую очередь – IgE). Они развиваются быстро: от нескольких секунд (анафилактический шок) до 12 часов (крапивница), а чаще всего через 30 минут. Это
повышенная чувствительность немедленного типа – ПЧНТ (синоним – гиперчувствительность немедленного типа или ГНТ). К
реакциям немедленного типа относятся анафилактические, цитотоксические, иммунокомплексные, антирецепторные, гранулоцит- и тромбоцитопосредованные реакции.
Реакции, развивающиеся через 4-12 часов после контакта с аллергеном, называют отсроченными, "поздними".
98

Замедленные реакции гиперчувствительности развиваются через 24-72 часа и обусловлены взаимодействием антигена с сенсибилизированными, иммунными Т-лимфоцитами – это
повышенная чувствительность замедленного типа (ПЧЗТ) или гиперчувствительность замедленного типа (ГЗТ).
Все аллергические реакции имеют четыре стадии развития: иммунологическую (взаимодействие антител или Т-клеток с аллергеном), патохимическую, медиаторную (выделение медиаторов), патофизиологическую (нарушение функций тканей и органов), клиническую (проявление аллергии).
Исследователи P.G. Gell и R.A. Coombs выделили несколько типов аллергических реакций. Впоследствии оказалось, что по аналогичным механизмам развиваются также аутоиммунные (аутоаллергические) болезни. Часть этих иммунопатологических реакций относится к гиперчувствительности немедленного типа, часть – к гиперчувствительности замедленного типа.
Реакции повышенной чувствительности немедленного типа
I тип реакций. Анафилактические реакции (реагиновые, IgEзависимые).
У здорового человека в сыворотке крови содержится от 0 до 100 кЕ/л IgE. При аллергических реакциях и гельминтозах количество общего IgE в сыворотке крови обычно увеличивается. Однако более 90% синтезированного в организме IgE секретируется через эпителий слизистых оболочек и удаляется со слизью. Возможно он участвует в защите слизистых оболочек от инфекций. При глистных инвазиях его количество резко увеличивается (до 1000 кЕ/л).
Антитела этого класса против различных аллергенов участвуют в аллергических реакциях. Их выявление имеет диагностическое значение.
Продукция IgE регулируется разными цитокинами: ИЛ-4, ИЛ-25 и ИЛ-10, выделяемые Тх 2-го типа, стимулируют, а гаммаинтерферон и ИЛ-2, секретируемые Тх 1-го типа, угнетают его синтез.
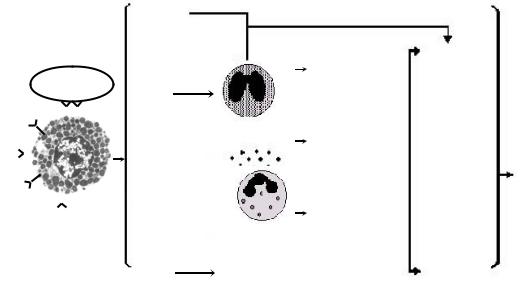
На этапе сенсибилизации под влиянием аллергена образуются IgE-антитела, которые связываются высокоаффинными Fc -RI рецепторами мембран базофилов (рис. 4.2).
рецепторами мембран базофилов (рис. 4.2).
99
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лейкотриены |
|
|
|
Основной белок |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Простагландины |
|
|
|
|
аллерген |
|
|
|
|
|
|
|
|
Лейкотриены |
Сокращение |
Анафилактический |
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
ЭХФ |
|
|
|
|
|
|
Тромбоксан А |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
гладкой |
шок, |
||||
|
|
|
|
|
ИЛ-5 |
|
|
|
|
|
|
Цитокины |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
мускулатуры, |
приступ |
||||
|
|
|
|
|
|
|
|
|
|
Эозинофилы |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
бронхоспазм, |
бронхиальной |
|||
|
|
|
|
|
|
|
|
|
|
Тромбоциты |
Гистамин |
|||||
|
|
|
|
|
|
|
|
|
|
увеличение |
астмы, |
|||||
|
|
|
|
|
ТАФ |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
сосудистой |
ринит, |
||
|
|
|
|
|
|
НХФ, |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
проницае- |
|
|
|
|
|
|
|
|
ИЛ-4,6,8 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Ферменты |
мости, отек |
отек Квинке, |
||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
гранул |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
крапивница |
||
Базофил с |
Нейтрофилы |
|
|
|
||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|||||||||||||
антителами |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
ПАФ |
|
|
|
простагландины |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭХФ – эозинофильный хемотаксический фактор; ТАФ – тромбоцитактивирующий фактор; НХФ – нейтрофил-активирующий фактор; ПАФ – простагландинактивирующий фактор; ИЛ-4, 5, 6, 8-интерлейкины.
Рис. 4.2. Реагиновый тип аллергической реакции
Для активации рецептора и передачи сигнала внутрь клетки необходимо, чтобы минимум две молекулы IgE, ранее связавшиеся базофилами (тучными клетками), фиксировали своими Fabфрагментами два эпитопа (детерминанты) аллергена. Это обычно происходит при повторном его попадании в организм
(иммунологическая, специфическая стадия реакции). Такое взаимодействие аллергена и IgE-антител индуцирует трансмембранный сигнал, который уже в течение минуты активирует базофил.
Когда наступает патохимическая, медиаторная стадия, гранулы базофила передвигаются по направлению к периферии клетки и покидают ее через поры мембраны. Процесс дегрануляции не сопровождается разрушением мембраны и базофил сохраняет свою жизнеспособность. Из гранул базофила освобождаются гистамин, лейкотриены, триптаза, тромбоцитактивирующий фактор, серотонин, факторы хемотаксиса эозинофилов и нейтрофилов, группа интерлейкинов (ИЛ-4, 5, 6, 8), вовлекающих другие лейкоциты. Эти
100
