41
Гормоны – это биологически высокоактивные вещества, синтезирующиеся и выделяющиеся во внутреннюю среду организма эндокринными железами, или железами внутренней секреции, и оказывающие регулирующее влияние на функции удаленных от места их секреции органов и систем организма. Эндокринная железа – это анатомическое образование, лишенное выводных протоков, единственной или основной функцией которого является внутренняя секреция гормонов. К эндокринным железам относятся гипофиз, эпифиз, щитовидная железа, надпочечники (мозговое и корковое вещество), паращитовидные железы. В отличие от внутренней секреции, внешняя секреция осуществляется экзокринными железами через выводные протоки во внешнюю среду. В некоторых органах одновременно присутствуют оба типа секреции. Инкреторная функция осуществляется эндокринной тканью, т.е. скоплением клеток с инкреторной функцией в органе, обладающем функциями, не связанными с продукцией гормонов. К органам со смешанным типом секреции относятся поджелудочная железа и половые железы. Одна и та же железа внутренней секреции может продуцировать неодинаковые по своему действию гормоны. Так, например, щитовидная железа продуцирует тироксин и тирокальцитонин. В то же время продукция одних и тех же гормонов может осуществляться разными эндокринными железами. Например, половые гормоны продуцируются и половыми железами, и надпочечниками.
Классификация гормонов и БАБ по химической структуре:
Белковые гормоны подразделяют на пептидные: АКТГ, соматотропный (СТГ), меланоцитостимулирующий (МСГ), пролактин, паратгормон, кальцитонин, инсулин, глюкагон, и протеидные – глюкопротеиды: тиротропный (ТТГ), фолликулостимулирующий (ФСГ), лютеинизирующий (ЛГ), тироглобулин. Гипофизотропные гормоны и гормоны желудочно-кишечного тракта принадлежат к олигопептидам, или малым пептидам.
К стероидным (липидным) гормонам относятся кортикостерон, кортизол, альдостерон, прогестерон, эстрадиол, эстриол, тестостерон, которые секретируются корой надпочечника и половыми железами. К этой группе можно отнести и стеролы витамина D – кальцитриол. Производные арахидоновой кислоты являются, как уже указывалось, простагландинами и относятся к группе эйкозаноидов.
Производные аминокислот: производные тирозина: тироксин, трийодтиронин, дофамин, адреналин, норадреналин; производные триптофана: мелатонин, серотонин; производные гистидина: гистамин.
Производные жирных кислот: арахидоновая кислота и ее производные: простагландины, простациклины, тромбоксаны, лейкотриены.
Белковые гормоны гидрофильны и могут переноситься кровью как в свободном, так и в частично связанном с белками крови состоянии. Стероидные и тироидные гормоны липофильны (гидрофобны), отличаются небольшой растворимостью, основное их количество циркулирует в крови в связанном с белками состоянии.
Классификация гормонов и БАВ по химической структуре:
Производные аминокислот:
производные тирозина: тироксин, трийодтиронин, дофамин, адреналин, норадреналин;
производные триптофана: мелатонин, серотонин;
производные гистидина: гистамин.
Белково-пептидные гормоны:
полипептиды: глюкагон, кортикотропин, меланотропин, впзопрессин, окситоцин, пептидные гормоны желудка и кишечника;
простые белки (протеины): инсулин, соматотропин, пролактин, паратгормон, кальцитонин;
сложные белки (гликопротеиды): тиреотропин, фоллитропин, лютропин.
Стероидные гормоны:
кортикостероиды (альдостерон, кортизол, кортикостерон);
половые гормоны: андрогены (тестостерон), эстрогены и прогестерон.
Производные жирных кислот:
арахидоновая кислота и ее производные: простагландинм: простациклины, тромбоксаны, лейкотриены.
Классификация гормонов по функциям:
1. Эффекторные гормоны, они прямо действуют на рабочие мишени. Это меланоцитстимулирующий гормон, соматотропный гормон, пролактин, окситоцин и вазопрессин, и все гормоны периферических эндокринных желез: инсулин, половые, тиреоидные гормоны и т.д.
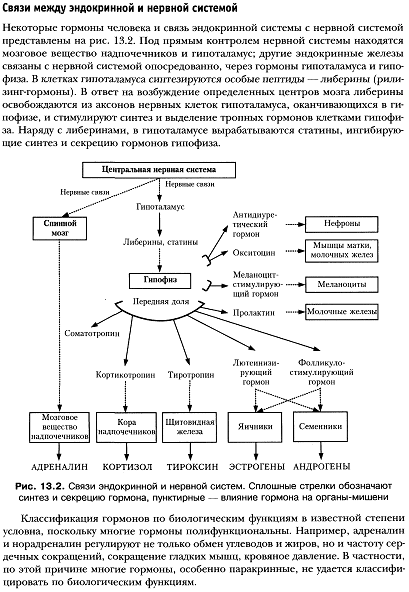
2. Тропные гормоны, они влияют на выделение эффекторных гормонов. Их всего четыре, все они синтезируются в гипофизе. Это тиреотропный гормон, адренокортикотропный гормон, фолликулстимулирующий гормон, лютеинизирующий гормон.
3. Рилизинг-факторы. Выделяются в гипоталамусе, влияют на выделение тропных гормонов из гипофиза.

По эффекту (знаку действия) - возбуждающие и тормозящие.
По времени жизни: мало- (до1мин), средне- (1мин-1ч), долго-живущие(1ч-1сут)
По гидро- Липофильности: Липофильные гормоны проникают в клетку, а затем поступают в ядро. Гидрофильные гормоны оказывают действие на уровне кпеточной мембраны.
По месту синтеза: гипофизарны, гипоталамические, половые, кортикостероиды, горм щитовидной железы и т.д.
Общие свойства гормонов:
1. Строгая специфичность (тропность) физиологического действия.
2. Высокая биологическая активность: гормоны оказывают свое физиологическое действие в чрезвычайно малых дозах.
3. Дистантный характер действия: клетки-мишени располагаются обычно далеко от места образования гормона.
4. Многие гормоны (стероидные и производные аминокислот) не имеют видовой специфичности.
5. Генерализованность действия.
6. Пролонгированность действия.
Номенклатура: По рекомендации International Union of Pure and Applied Chemistry (IUPAC), International Union of Biochemistry and Molecular Biology (IUB), (IUPAC-IUB Commission on Biochemical Nomenclature (CBN) наименование каждого гипоталамического высвобождающего гормона следует образовывать путем прибавления словообразовательной единицы «-либерин» («-liberin») или «-статин» («-statin») к корню - названия гормона, высвобождаемого гипофизом под влиянием данного гипоталамического высвобождающего гормона. Например, гипоталамический гормон стимулирующий выведение (высвобождение) соматотропного гормона гипофиза называется соматолиберин, а гипоталамический гормон тормозящий выведение (высвобождение) соматотропного гормона гипофиза называется соматостатин. Другие примеры см. в таблице ниже:
42
43
Гормональный эффект опосредован следующими основными этапами: синтезом и поступлением в кровь, формами транспорта, клеточными механизмами действия гормонов. От места секреции гормоны доставляются к органам-мишеням циркулирующими жидкостями: кровью, лимфой.
В крови гормоны циркулируют в нескольких формах:
1) в свободном состоянии;
2) в комплексе со специфическими белками плазмы крови;
3) в форме неспецифического комплекса с плазменными белками;
4) в адсорбированном состоянии на форменных элементах крови.
В состоянии покоя 80% приходится на комплекс со специфическими белками. Биологическая активность определяется содержанием свободных форм гормонов. Связанные формы гормонов являются как бы депо, физиологическим резервом, из которого гормоны переходят в активную свободную форму по мере необходимости.
Обязательным условием для проявления эффектов гормона является его взаимодействие с рецепторами. Гормональные рецепторы представляют собой особые белки клетки, для которых характерны:
1) высокое сродство к гормону;
2) высокая избирательность;
3) ограниченная связывающая емкость;
4) специфичность локализации рецепторов в тканях.
На одной и той же мембране клетки могут располагаться десятки разных типов рецепторов. Количество функционально активных рецепторов может изменяться при различных состояниях и в патологии. Так, например при беременности в миометрии исчезают М-холинорецепторы, и возрастает количество окситоциновых рецепторов. При некоторых формах сахарного диабета имеет место функциональная недостаточность инсулярного аппарата, т.е. уровень инсулина в крови высокий, но часть инсулиновых рецепторов оккупирована аутоантителами к этим рецепторам. В 50% случаев рецепторы локализуются на мембранах клетки- мишени; 50% - внутри клетки.
Рецепторы к гормонам. Механизмы действия гормонов. Существуют два основных механизма действия гормонов на уровне клетки: реализация эффекта с наружной поверхности клеточной мембраны и реализация эффекта после проникновения гормона внутрь клетки.
В первом случае рецепторы расположены на мембране клетки. В результате взаимодействия гормона с рецептором активируется мембранный фермент - аденилатциклаза. Этот фермент способствует образованию из аденозинтрифосфорной кислоты (АТФ) важнейшего внутриклеточного посредника реализации гормональных эффектов - циклического 3,5-аденозинмонофос-фата (цАМФ). цАМФ активирует клеточный фермент протеинкиназу, реализующую действие гормона. Установлено, что гормонозависимая аденилатциклаза - это общий фермент, на который действуют различные гормоны, в то время как рецепторы гормонов множественны и специфичны для каждого гормона. Вторичными посредниками кроме цАМФ могут быть циклический 3,5-гуанозинмонофосфат (цГМФ), ионы кальция, инозитол-трифосфат. Так действуют пептидные, белковые гормоны, производные тирозина - катехоламины. Характерной особенностью действия этих гормонов является относительная быстрота возникновения ответной реакции, что обусловлено активацией предшествующих уже синтезированных ферментов и других белков.
Во втором случае рецепторы для гормона находятся в цитоплазме клетки. Гормоны этого механизма действия в силу своей липофильности легко проникают через мембрану внутрь клетки-мишени и связываются в ее цитоплазме специфическими белками-рецепторами. Гормон-рецепторный комплекс входит в клеточное ядро. В ядре комплекс распадается, и гормон взаимодействует с определенными участками ядерной ДНК, следствием чего является образование особой матричной РНК. Матричная РНК выходит из ядра и способствует синтезу на рибосомах белка или белка-фермента. Так действуют стероидные гормоны и производные тирозина - гормоны щитовидной железы. Для их действия характерна глубокая и длительная перестройка клеточного метаболизма.
Инактивация гормонов происходит в эффекторных органах, в основном в печени, где гормоны претерпевают различные химические изменения путем связывания с глюкуроновой или серной кислотой либо в результате воздействия ферментов. Частично гормоны выделяются с мочой в неизмененном виде. Действие некоторых гормонов может блокироваться благодаря секреции гормонов, обладающих антагонистическим эффектом.
Различают три типа рецепторов.
1. Рецепторы первого типа являются белками, имеющими одну трансмембранную полипептидную цепь. Это аллостерические ферменты, активный центр которых расположен на внутренней стороне мембраны. Многие из них являются тирозиновыми протеинкиназами. К этому типу принадлежат рецепторы инсулина, ростовых факторов и цитокинов.
Связывание сигнального вещества ведет к димеризации рецептора. При этом происходит активация фермента и фосфорилирование остатков тирозина в ряде белков. В первую очередь фосфорилируется молекула рецептора (автофосфорилирование). С фосфотирозином связывается SН2-домен белка-переносчика сигнала (см. с. 378), функция которого состоит в передаче сигнала внутриклеточным протеинкиназам.
2. Ионные каналы. Эти рецепторы второго типа являются олигомерными мембранными белками, образующими лиганд-активируемый ионный канал. Связывание лиганда ведет к открыванию канала для ионов Na+, К+ или Cl-. По такому механизму осуществляется действие нейромедиаторов, таких, как ацетилхолин (никотиновые рецепторы: Na+- и К+-каналы) и γ-аминомасляная кислота (А-рецептор: Cl--канал).
3. Рецепторы третьего типа, сопряженные с ГТФ- связывающими белками. Полипептидная цепь этих белков включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков на белки-эффекторы, которые являются сопряженными ферментами или ионными каналами. Функция этих белков заключается в изменении концентрации ионов или вторичных мессенджеров. Таким образом, связывание сигнального вещества с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: рецепторные тирозинкиназы активируют внутриклеточные протеинкиназы, активация лиганд-активируемых ионных каналов ведет к изменению концентрации ионов и активация рецепторов, сопряженных с ГТФ-связывающими белками, индуцирует синтез веществ-посредников, вторичных мессенджеров. Все три системы передачи сигнала взаимосвязаны. Так, например, образование вторичного мессенджера цАМФ (сАМР) (см. с. 374) приводит к активации протеинкиназ А [ПК-А (PK-A)], вторичный мессенджер диацилглицерин [ДАГ (DAG)] активирует [ПК-С (PK-C)], а вторичный мессенджер инозит-1,4,5-трифосфат [ИФ3 (InsP3)] вызывает повышение концентрации ионов Са2+ в цитоплазме клетки.
Механизм дейсвия:
Механизм действия стероидных (жирорастворимых) гормонов
Проникновение стероида (С) в клетку
Образование комплекса СР. Все Р стероидных гормонов представляют собой глобулярные белки примерно одинакового размера, с очень высоким сродством связывающие гормоны
Трансформация СР в форму, способную связываться ядерными акцепторами [СР] Любая клетка содержит всю генетическую информацию. Однако при специализации клетки большая часть ДНК лишается возможности быть матрицей для синтеза иРНК. Это достигается путем сворачивания вокруг белков гистонов, что ведет к препятствию транскрипции. В связи с этим генетический материал клетки можно разделить на ДНК 3-х видов:
транскрипционно неактивная
постоянно экспрессируемая
индуцируемая гормонами или другими сигнальными молекулами.
Связывание [СР] с хроматиновым акцептором.
Следует отметить, что этот этап действия С полностью не изучен и имеет ряд спорных моментов. Считается что [СР] взаимодействует со специфическими участками ДНК так, что это дает возможность РНК-полимеразе вступить в контакт к определенным доменам ДНК.
Интересным является опыт, который показал, что период полужизни иРНК при стимуляции гормоном увеличивается. Это приводит к многим противоречиям: становится непонятно ¾ увеличение количества иРНК свидетельствует, о том что [СР] повышает скорость транскрипции или увеличивает период полужизни иРНК; в то же время увеличение полужизни иРНК объясняется наличием большого числа рибосом в гормон-стимулированной клетке, которые стабилизируют иРНК или другим действием [СР] неизвестным для нас на сегодняшний момент.
Избирательная инициация транскрипции специфических иРНК; координированный синтез тРНК и рРНК
Можно полагать, что основной эффект [СР] состоит в разрыхлении конденсированного хроматина, что ведет к открыванию доступа к нему молекул РНК-полимеразы. Повышение количества иРНК приводит к увеличению синтеза тРНК и рРНК.
Процессинг первичных РНК
Транспорт мРНК в цитоплазму
Синтез белка
Посттрансляционная модификация белка
Тиреоидные гормоны (Т3 – Т4)
Под действием ТТГ в клетку поступают ионы Са, которые связываясь с кальмодулином вызывают движение лизосом из базальной части клетки к апикальной. Здесь происходит слияние лизосомы с каплей коллоидного раствора и образующаяся в результате фаголизосома движется в обратном направлении. При этом имеющийся в ней набор гидролаз разщепляет пептидные связи и образуются тироксин и трийодтиронин, которые и попадают в кровь.
Второй стадией действия ТТГ-рецепторного комплекса является выработка тиреоглобулина. В данном случае эффект ТТГ на фолликулярную клетку похож на действие СТГ. В ходе усиления синтеза РНК, повышения проникновения глюкозы в клетку синтезируется I-содержащий белок тиреоглобулин. Также необходимо проводить различие между ролью тиреоидных гормонов в процессе дифференцировки и их ролью в поддержании функций полностью дифференцированных клеток.
1. Периферическое дейодирование Т4
Биологическим эффектом обладает Т3, поэтому существуют механизмы дейодирования тироксина. Тироксин попадает в клетки гипофиза, где под действием дейодиназы происходит синтез Т3. В то же время в тканям существует два вида дейодиназ: дейодиназа наружного кольца с образованием Т3 и дейодиназа внутреннего кольца с образованием рТ3 который не соединяется с рецепторами и поэтому не вызывает иологического эффекта. Таким образом ткани сами немного регулируют действие на них тиреоидных гормонов.
2. Дейстие на плазматическую мембрану
Хотя при изучении тиреоидных гормонов основное влияние уделяется процессам, происходящим в клеточном ядре, все же на плазматической мембране клеток, чувствительных к тиреоидным гормонам ,обнаружены высокоаффинные участки связывания последних. Их эффектом служит стимуляция транспорта аминокислот.
3. Действие на митохондрии
В митохондриях найдены рецепторы к Т3. Установлено, что при гипотиреозе транспорт АДФ в митохондрию понижается, а при гипертиреозе увеличивается. Это ведет к изменению синтеза АТФ, что и сказывается на обмене веществ.
4. Ядро
На ядерной мембране обнаружены рецепторы тиреоидных гормонов. Доказано, что связываясь с рецепторами тиреоидные гормоны усиливают транскрипцию не всех, а определенных для данных клеток иРНК.
С учетом того, что тиреоидные гормоны действуют на увеличение транспорта аминокислот, увеличение количества АТФ, то синтез новых белков происходит достаточно быстро. Избирательная стимуляция синтеза определенных иРНК ведет к дифференциации клетки в детстве, а в зрелом возрасте в поддержании ее нормального функционирования. Этот эффект очень сильно заметен по отношению к ЦНС, потому что нарушение образования тиреоидных гормонов в первую очередь стает заметным по изменениям поведения, психики и эмоциональности.
Механизм действия катехоламинов
В результате взаимодействия гормона с рецептором активируется мембранный фермент - аденилатциклаза. Этот фермент способствует образованию из аденозинтрифосфорной кислоты (АТФ) важнейшего внутриклеточного посредника реализации гормональных эффектов - циклического 3,5-аденозинмонофос-фата (цАМФ). цАМФ активирует клеточный фермент протеинкиназу, реализующую действие гормона. Установлено, что гормонозависимая аденилатциклаза - это общий фермент, на который действуют различные гормоны, в то время как рецепторы гормонов множественны и специфичны для каждого гормона. Вторичными посредниками кроме цАМФ могут быть циклический 3,5-гуанозинмонофосфат (цГМФ), ионы кальция, инозитол-трифосфат. Так действуют пептидные, белковые гормоны, производные тирозина - катехоламины. Характерной особенностью действия этих гормонов является относительная быстрота возникновения ответной реакции, что обусловлено активацией предшествующих уже синтезированных ферментов и других белков.
Механизм действия пептидных гормонов
рецепторы расположены на мембране клетки. В результате взаимодействия гормона с рецептором активируется мембранный фермент - аденилатциклаза. Этот фермент способствует образованию из аденозинтрифосфорной кислоты (АТФ) важнейшего внутриклеточного посредника реализации гормональных эффектов - циклического 3,5-аденозинмонофос-фата (цАМФ). цАМФ активирует клеточный фермент протеинкиназу, реализующую действие гормона. Установлено, что гормонозависимая аденилатциклаза - это общий фермент, на который действуют различные гормоны, в то время как рецепторы гормонов множественны и специфичны для каждого гормона. Вторичными посредниками кроме цАМФ могут быть циклический 3,5-гуанозинмонофосфат (цГМФ), ионы кальция, инозитол-трифосфат. Так действуют пептидные, белковые гормоны, производные тирозина - катехоламины. Характерной особенностью действия этих гормонов является относительная быстрота возникновения ответной реакции, что обусловлено активацией предшествующих уже синтезированных ферментов и других белков.
Общая схема синтеза гормонов
Белково-пептидные гормоны.В процессе образования белковых и пептидных гормонов в клетках эндокринных желез происходит образование полипептида, не обладающего гормональной активностью. Но такая молекула в своем составе имеет фрагмент(ы), содержащий(е) аминокислотную последовательность данного гормона. Такая белковая молекула называется пре-про-гормоном и имеет в своем составе (обычно на N-конце) структуру, которая называется лидерной или сигнальной последовательностью (пре-). Эта структура представлена гидрофобными радикалами и нужна для прохождения этой молекулы от рибосом через липидные слои мембран внутрь цистерн эндоплазматического ретикулума (ЭПР). При этом, во время перехода молекулы через мембрану в результате ограниченного протеолиза лидерная (пре-) последовательность отщепляется и внутри ЭПР оказывается прогормон. Затем через систему ЭПР прогормон транспортируется в комплекс Гольджи и здесь заканчивается созревание гормона. Вновь в результате гидролиза под действием специфических протеиназ отщепляется оставшийся (N-концевой) фрагмент (про-участок). Образованная молекула гормона, обладающая специфической биологической активностью поступает в секреторные пузырьки и накапливается до момента секреции.
Гормоны- производные аминокислот. (катехоламины) Из тирозина синтезируются гормоны мозгового слоя надпочечников адреналин и норадреналин, а также йодсодержащие гормоны щитовидной железы. В ходе синтеза адреналина и норадреналина тирозин подвергается гидроксилированию, декарбоксилированию и метилированию с участием активной формы аминокислоты метионина.
При синтезе гормонов из числа сложных белков гликопротеинов (например, фолликулостимулирующего (ФСГ) или тиреотропного (ТТГ) гормонов гипофиза) в процессе созревания происходит включение углеводного компонента в структуру гормона.
Может происходить и внерибосомальный синтез. Так синтезируется трипептид тиролиберин (гормон гипоталамуса).
Синтез стеродных гормонов
Стероидные гормоны синтезируются из холестерина (27 углеродных атомов), а холестерин синтезируется из ацетил-КоА.
Холестерин превращается в стероидные гормоны в результате следующих реакций:
отщепление бокового радикала;
образование дополнительных боковых радикалов в результате реакции гидроксилирования с помощью специальных ферментов монооксигеназ (гидроксилаз) - чаще всего в 11-м, 17-м, и 21-м положениях (иногда в 18-м). На первом этапе синтеза стероидных гормонов сначала образуются предшественники (прегненолон и прогестерон), а затем другие гормоны (кортизол, альдостерон, половые гормоны). Из кортикостероидов могут образоваться альдостерон, минералокортикоиды.
Синтез тиреодных гормонов
В щитовидной железе происходит синтез йодсодержащих гормонов трийодтиронина и тироксина (тетрайодтиронина). В ходе синтеза происходит йодирование фенольной группы тирозина. Особый интерес представляет метаболизм иода в щитовидной железе. Молекула гликопротеина тиреоглобулина (ТГ) имеет молекулярную массу более 650 кДа. При этом в составе молекулы ТГ около 10 % массы - углеводы и до 1 % - йод. Это зависит от количества иода в пище. В полипептиде ТГ - 115 остатков тирозина, которые иодируются окисленным с помощью специального фермента - тиреопероксидазы - йодом. Эта реакция называется органификацией йода и происходит в фолликулах щитовидной железы. В результате из остатков тирозина образуются моно- и ди-иодтирозин. Из них примерно 30 % остатков в результате конденсации могутпревратитьться в три- и тетра- иодтиронины. Конденсация и иодирование идут с участием одного и того же фермента - тиреопероксидазы. Дальнейшее созревание гормонов щитовидной железы происходит в железистых клетках - ТГ поглощается клетками путем эндоцитоза и образуется вторичная лизосома в результате слияния лизосомы с поглощенным белком ТГ.
Протеолитические ферменты лизосом обеспечивают гидролиз ТГ и образование Т3 и Т4, которые выделяются во внеклеточное пространство. А моно- и дииодтирозин деиодируются с помощью специального фермента деиодиназы и иод повторно может подвергаться органификации. Для синтеза тиреоидных гормонов характерным является механизм торможения секреции по типу отрицательной обратной связи (Т3 и Т4 угнетают выделение ТТГ).
Прогормоны — сложные вещества, производимые гормонообразующими клетками в процессе биосинтеза гормонов, являющиеся непосредственными биологическими предшественниками гормонов, сами не обладающие гормональными свойствами или обладающие низкой гормональной активностью и превращающиеся в гормоны либо непосредственно в секреторных клетках, либо в периферических тканях.
К прогормонам не относят исходные субстраты для биосинтеза гормонов, в частности, предшественники стероидных гормонов (такие, как прегненолон) или тирозин.
К прогормонам, в частности, относят:
препроинсулин
проинсулин
проопиомеланокортин
липокортин
В некотором смысле прогормонами являются также тироксин, конвертируемый непосредственно в тканях в более активный трийодтиронин, и тестостерон, конвертируемый в дигидротестостерон.
Антигормоны - защитные вещества, вырабатываемые организмом при длительном введении в него больших количеств белковых гормональных препаратов. Канадский учёный Дж. Коллип в 1934 выдвинул теорию, согласно которой в организме по отношению к каждому гормону (См. Гормоны) вырабатывается А. В дальнейшем было доказано, что образование А. является реакцией не гормональной, а иммунологической (см. Иммунитет) на введение извне чужеродных белковых препаратов. По отношению к собственным гормонам организм не образует А. Однако могут быть синтезированы вещества, близкие по строению к гормонам, которые при введении в организм действуют как Антиметаболиты гормонов.
44
феномен десенситизации
Регуляция рецепторов: десенситизация (тахифилаксия)
Рецепторы, столь тесно связанные с регуляцией метаболических процессов в клетке, в то же время сами являются объектом регуляции. Это видно на примере снижающей регуляции популяций рецепторов на плазматической мембране в условиях постоянного присутствия агониста. Феномен снижающей регуляции рецепторов — это лишь один из аспектов более общей проблемы десенситизации (или тахифилаксии), которую можно определить как снижение чувствительности клетки к стимуляции, когда на нее длительно воздействует стимулирующий агент. Феномен десенситизации наблюдается у разнообразных видов — от бактерий до человека. Исследование системы β-адренорецептор-G-белок-аденилатциклаза позволило построить механистическую модель десенситизации, которая видимо, имеет и более общее значение (Sibley, Lefkowitz).
Десенситизация к природному лиганду клетки (гомологичная десенситизация) протекает через ряд отдельных стадий. Вначале (от секунд до нескольких минут) происходит разобщение рецептора и комплекса Gc-белок—аденилатциклаза без снижения числа рецепторов на поверхности клетки. Имеются некоторые данные, указывающие на фосфорилирование рецептора цАМФ-незавнсимой протеинкипазой как на причину такого разобщения. Спустя некоторое время наблюдается удаление или секвестрация рецепторов (без G-белка или аденилатцикла-зы) с клеточной поверхности. Не совсем ясно, находятся ли в эндоцитозных пузырьках фосфорилированные рецепторы. На самом деле фосфорилирование может предварять эндоцитоз. После секвестрации пузырек, содержащий рецептор, подвергается процессингу либо в аппарате Гольджи, откуда он возвращается обратно в плазматическую мембрану, либо в фаголизосомах, где полностью распадается. Наконец, когда прошедшие через аппарат Гольджи рецепторы вновь встраиваются в плазматическую мембрану, происходит восстановление чувствительности (ресенситизация). При кратковременном воздействии агониста весь этот процесс не требует синтеза белка. При более длительном воздействии, когда в фаголизосомах разрушается большая доля подвергшихся эндоцитозу рецепторов, для восстановления полного набора рецепторов на поверхности клетки синтез белка становится необходимым.
Другой тип десенситизации (гетерологичная) имеет место в тех случаях, когда комплекс G-белок-аденилатциклаза реагирует не на один, а на несколько гормонов. При введении гормона А снижается реакция на гормон В, хотя число рецепторов В на поверхности клетки при этом и не уменьшается. Как было установлено на реконструированной мембранной системе (т. е. системе, где белок Gc встроен в лишенную его мембрану), в таких случаях нарушается функция белка Gc. Молекулярная природа повреждения Gс-белка выяснена не полностью, но может заключаться в его фосфорилировании. Известно, что сам рецептор подвергается фосфорилированию (он служит субстратом почти всех протеинкиназ, включая цАМФ-зависимую и протеинкиназу С), и это нарушает его способность взаимодействовать с Gc.


45
Цитокины — небольшие пептидные информационные молекулы. Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники:[1] например, интерлейкин-1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
Факторы роста — это естественные субстанции, способные стимулировать рост, пролиферацию и/или дифференцировку живых клеток[1]. Как правило, это пептидные или стероидные гормоны. Факторы роста функционируют как сигнальные молекулы для взаимодействия между клетками. Примерами являются цитокины и гормоны, связываемые специфическими клеточными рецепторами. Итальянский нейробиолог Рита Леви-Монтальчини за открытие факторов роста, в частности, фактора роста нервов, получила вместе с Стэнли Коэном Нобелевскую премию по физиологии и медицине 1986 года. Другими широко известными факторами роста являются эритропоэтин и инсулиноподобный фактор роста 1.
Классификация цитокинов в основном проводится по их биологическим свойствам. К цитокинам относятся ИФН, колониестимулирующие факторы, хемокины, трансформирующие ростовые факторы; группа ФНО; IL со сложившимися историческими порядковыми номерами и некоторые другие [3]. IL, имеющие номера с 1 по 25, не относятся к одной подгруппе цитокинов, а могут быть разделены на прои противоспалительные цитокины, ростовые и дифференцировочные факторы лимфоцитов, отдельные регуляторные цитокины. Общие свойства цитокинов, объединяющие их в самостоятельную систему регуляции, следующие:
1) цитокины являются полипептидами или белками, часто гликозилированными, с молекулярной массой (ММ) от 5 до 50 кДа (для сравненияММ IgG равна 160 кДа);
2) цитокины не имеют антигенной специфичности биологического действия. Они влияют на функциональную активность клеток, принимаю щих участие в реакциях врожденного и приобретенного иммунитета. Тем не менее, воздействуя на Ти Влимфоциты, цитокины способны стимулировать антигензависимые процессы в иммунной системе;
3) синтез цитокинов является индуцибельным процессом. Большинство цитокинов не синтезируется клетками вне воспалительной реакциии иммунного ответа. Экспрессия генов цитокиновначинается в ответ на проникновение в организмпатогенов, антигенное раздражение или повреждение тканей. Наиболее сильными индукторамисинтеза цитокинов служат компоненты клеточных стенок бактерий: липополисахариды (ЛПС),
пептидогликаны и мурамилдипептиды;
4) цитокины синтезируются в ответ на стимуляцию через короткий промежуток времени. Синтез прекращается за счет разнообразных механизмов ауторегуляции, включая повышенную нестабильность РНК, и существования отрицательныхобратных связей, опосредуемых простагландинами, кортикостероидными гормонами и другимифакторами;
5) один и тот же цитокин может вырабатываться различными по гистогенетическому происхождению типами клеток организма в разных органах;
6) цитокины обладают плейотропностью биологического действия. Один и тот же цитокин может действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клетокмишеней [4, 5];
7) для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью;
8) биологические эффекты цитокинов опосредуются через специфические клеточные рецепторные комплексы, связывающие цитокины сочень высокой аффинностью, причем отдельныецитокины могут использовать общие субъединицы рецепторов [6–11]. Каждый цитокин связывается со своим специфическим рецепторным комплексом. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способностьсвязывать лиганды;
9) цитокины индуцируют либо подавляютсинтез самих себя, других цитокинов и их рецепторов, участвуя в формировании цитокиновой сети [5, 12–14];
10) цитокины могут быть ассоциированными смембранами синтезирующих их клеток, обладая ввиде мембранной формы полным спектром биологической активности.
Интерлейки́ны — группа цитокинов, синтезируемая в основном лейкоцитами (по этой причине было выбрано окончание «-лейкин»). Также производятся мононуклеарными фагоцитами и другими тканевыми клетками. Интерлейкины являются частью иммунной системы.
Представители
Интерлейкин 1 (альфа и бета)
медиатор воспаления и иммунитета, синтезируется многими клетками организма, в первую очередь активированными макрофагами, кератиноцитами, стимулированными B-клетками и фибробластами. Интерлейкин-1 был одним из первых открытых интерлейкинов. Первоначально он был описан как фактор, вызывающий повышение температуры, контролирующий активность лейкоцитов, увеличивающий количество клеток костного мозга и приводящий к дегенерации суставов. Позже было обнаружено, что существует два сходных интерлейкина 1: альфа и бета.
Интерлейкин 2
медиатор воспаления и иммунитета. Продуцируется Т-клетками в ответ на антигенную и митогенную стимуляцию. Интерлейкин 2 необходим для пролиферации Т-клеток и других процессов, регулирующих иммунный ответ.
Интерлейкин 3
полипептидный цитокин, относится к группе гранулоцитарно-макрофагальных колониестимулирующих факторов вместе с интерлейкином 5 и гранулоцитарно-макрофагальный колониестимулирующим фактором.
Интерлейкин 4
регулятор роста и дифференциации В-лимфоцитов(молекулярная масса 19 кД), а также процесса биосинтеза ими антител. Продуцируется активированными CD4+ Т-лимфоцитами (Th2), тучными клетками, эозинофилами.
Оказывает существенное влияние на процессы продуцирования IgE и IgG1, переключения С генов иммуноглобулинов на активацию Th2 типа, накопление эозинофилов, экспрессию на В-лимфоцитах и тучных клетках низкоаффинного рецептора для IgE (СD23). Является антагонистом процесса дифференциации CD4+ Тh1 типа и продуцирования ими цитокинов. Подавляет активность макрофагов и процесс биосинтеза ими цитокинов — ИЛ-1, ФИО, ИЛ-6, то есть оказывает противовоспалительный эффект.
Интерлейкин 5
или эозинофильный колониестимулирующий фактор, (англ. Interleukin-5, IL-5; colony-stimulating factor, eosinophil) — полипептидный цитокин, относится к группе гранулоцитарно-макрофагальных колониестимулирующих факторов вместе с интерлейкином 3 и гранулоцитарно-макрофагальный колониестимулирующим фактором. Индуцирует конечную дифференцировку поздних B-клеток в иммуноглобулин-секретирующие клетки.
Интерлейкин 6
Интерлейкин 6 (англ. Interleukin-6, IL-6) — интерлейкин, который может действовать как провоспалительный и антивоспалительный цитокин. Синтезируется активированными макрофагами и T-клетками и стимулирует иммунный ответ. Особенно его роль велика при травматическом поражении ткани, ожогах и других повреждениях, ведущих к воспалению. Интерлейкин 6 является одним из важнейших медиаторов острой фазы воспаления. В мышцах и жировой ткани он стимулирует мобилизацию энергии, которая приводит к повышению температуры тела. Секретируется макрофагами после их активации патоген-связанными молекулами, опосредованной толл-подобными рецепторами.
Интерлейкин 6 связывается на поверхности клетки с гетеродимерным рецепторным комплексом, называемым рецептор цитокинов I типа, который состоит из двух трансмембранных белков: рецептора интерлейкина 6 и gp130 (или CD130). Этот рецептор связывает несколько других интерлейкинов, относящихся по этому признаку к надсемейству интерлейкина 6.
Интерлейкин 7
основной лимфопоэтический фактор с молекулярной массой 25 кД. Включает 152 аминокислоты. Синтезируется эпителиальными клетками, эозинофилами, стромальными клетками костного мозга и тимуса. Детерминирует и дифференцирует рост В-лимфоцитов. Оказывает влияние на пролиферацию В- и Т-лимфоцитов. Способствует коммитированию предшественников ИКК в направлении образования В-лимфоцитов и тимоцитов.
Рецепторы интерлейкина 7 (ИЛ-7R) состоят из альфа-цепей (обусловливает низкую и промежуточную аффинность) и альфа/гамма-цепей (высокоаффинные). Утрата организмом гена ИЛ-7 (нокаут) вызывает опустошение тимуса, тотальную лимфопению, тяжелый иммунодефицит, снижение интенсивности (в 7-10 раз) ответа ИКК на действие стимуляторов. При этом полностью блокируется процесс формирования гамма/дельта Т-лимфоцитов, ослабляется процесс образования альфа/бета Т-клеток. При избытке ИЛ-7 уровень В- и Т-лимфоцитов в крови повышен.
Интерлейкин 8
один из основных провоспалительных хемокинов, образуемый макрофагами, эпителиальными и эндотелиальными клетками. Играет также важную роль в системе врождённого иммунитета. Относится к хемокинам подсемейства CXC. На клетках-мишенях связывается с двумя рецепторами CXCR1 и CXCR2, первый из которых характеризуется более высокой эффективностью.
Интерлейкин 9[1]
цитокин с молекулярной массой 20-30 кД, синтезирующийся Т-лимфоцитами (Th2). Является фактором роста активированных клонов Т-лимфоцитов. Регулирует пролиферацию и дифференциацию тучных клеток. Оказывает влияние на эритропоэз.
Интерлейкин 10[1]
ингибиторный цитокин с молекулярной массой 17-20 кД. Продуцируется CD4+CD45+RO, Т-клетками памяти, Т-лимфоцитами цитотоксическими, Th1 и Th2, макрофагами, В-лимфоцитами, тучными клетками, эозинофилами, кератиноцитами. Ингибирует функцию Т-лимфоцитов (Th1) и процесс биосинтеза ими гамма интерферона и ИЛ-2. Способствует развитию гуморального иммунного ответа. Обусловливает формирование противопаразитарного иммунитета и аллергической реактивности
Интерлейкин 11[1]
регуляторный цитокин с молекулярной массой 23 кД. Синтезируется фибробластами, эозинофилами, эпителиальными клетками, стромальными клетками легких, гладкими мышцами дыхательных путей. Обеспечивает развитие ранних предшественников кроветворения. Стимулирует развитие воспалительного процесса и иммунного ответа. Ингибирует активацию макрофагов. Восстанавливает функцию дыхательных путей. Является функциональным дублером ИЛ-6.
Интерлейкин 18
провоспалительн цитокин, принадлежащий к семейству интерлейкина 1. Синтезируется макрофагами и другими клетками организма. Играет значительную роль в инфекционных и аутоиммунных заболеваниях. Был впервые открыт в 1995 году в качестве интерферон-гамма-индуцирующего фактора, который увеличивал активность клеток ЕК в селезёнке, причём его активность выше, чем у интерлейкина 12.
Интерлейкин 33
принадлежащий к семейству интерлейкина 1, обладает сходством с интерлейкином 1 и фактором роста фибробластов. Экспрессируется многими клетками организма, его уровень строго коррелирует с уровнем воспаления в ткани. В отличие от провоспалительного интерлейкина-1 интерлейкин-33 обладает иммунорегуляторными свойствами.
Синтезы оксида азота, NO-синтазы (англ. NO-synthase, NOS) — группа ферментов, катализирующих образование оксида азота и цитруллина из аргинина, кислорода и NADPH. Оксид азота играет важную роль в организме млекопитающих, он вырабатывается фагоцитами в процессе борьбы с бактериями, но также участвует и в нейротрансмиссии, регулировке кровообращения, других аспектах функионирования разных органов и тканей.
В настоящее время рассматривается возможное участие генов, кодирующих синтез оксида азота в развитии патологии легких при муковисцидозе.[1]
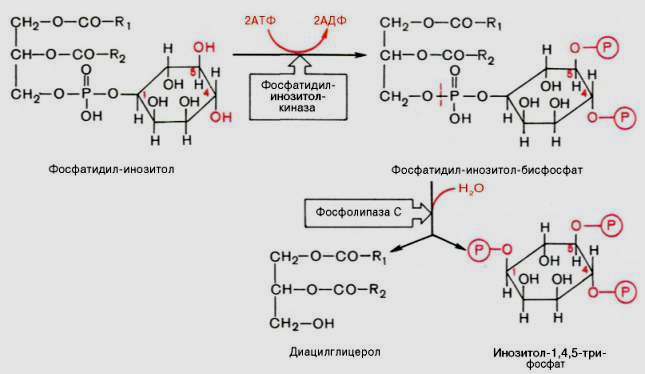
Роль Са2+ в регуляции гормональных эффектов
Са2+-мессенджерная система
К внутриклеточной системе мессенджеров относят также производные фосфолипидов мембран эукариотических клеток, в частности фосфорилированные производные фосфатидилинозитола. Эти производные освобождаются в ответ на гормональный сигнал (например, от вазопрессина или тиротропина) под действием специфической мембраносвязанной фосфолипазы С. В результате последовательных реакций образуются два потенциальных вторичных мессенджера – диацилглицерол и инозитол-1,4,5-трифосфат.
Биологические
эффекты этих вторичных мессенджеров
реализуются по-разному. Действие
диацилглицерола, как и свободных ионов
Са2+, опосредовано через мембраносвязанный
Са-зависимый фермент протеинкиназу С,
которая катализирует фосфорилирование
внутриклеточных ферментов, изменяя их
активность. Инозитол-1,4,5-трифосфат
связывается со специфическим рецептором
на эндоплазматическом ретикулуме,
способствуя выходу из него ионов Са2+
в цитозоль.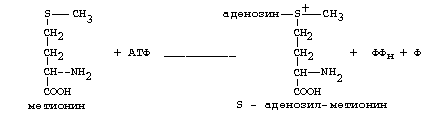
![]()
10 Обмен глицина и серина.
Это заменимые аинокислоты, которые превращаются друг в друга.
Основным путем распада глицина является его распад на СО2, Н2О и метилен-ТГФК (активный С1):
Из метилен-ТГФК могут образовываться все другие формы активного С1: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК в результате реакций окисления или восстановления метилен-ТГФК.
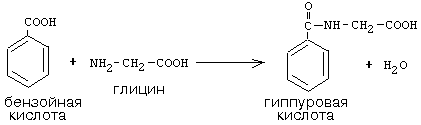
Активный С1, образовавшийся из глицина участвует в синтезе пуриновых азотистых оснований. Кроме того, глицин всей своей молекулой участвует в синтезе гема гемоглобина и других гемопротеинов, в синтезе пуриновых азотистых оснований, в синтезе парных желчных кислот (гликохолевая кислота), в синтезе креатина, в синтезе трипептида глютатиона. Также глицин в печени участвует в обезвреживании бензойной кислоты,
которая превращается в гиппуровую кислоту:
Основным
путем распада серина является его
превращение в метилен-ТГФК и глицин:
Всей своей молекулой серин участвует в синтезе сложных липидов - фосфолипидов. Он участвует в синтезе фосфатидилсерина, который декарбоксилируется и превращается в фосфатидилэтаноламин, который после метилирования превращается в фосфатидилхолин. В реакции метилирования участвует активная форма метионина - S-аденозилметионин.
Серин в составе белков-ферментов участвует в формировании каталитического центра фермента, например, в сериновых протеазах: трипсине, химотрипсине и др. Также серин участвует в формировании гидратной оболочки белков, потому что является полярной аминокислотой.
15 Обмен серусодержащих аминокислот: метионин
Метионин - это незаменимая аминокислота, а цистеин - заменимая.
Главной особенностью обмена метионина является то, что из него тоже образуется активный С1 в виде СН3-группы, которая участвует в различных синтезах. Однако, этот активный С1 образуется без участия ТГФК. Чтобы стать источником СН3- группы, метионин подвергается активации с участием АТФ. В результате этой реакции от АТФ отщепляются все три остатка фосфорной кислоты, а аденозин присоединяется к атому серы метионина. Так образуется активная форма метионина - S- аденозил-метионин.
S-аденозил-метионин участвует в реакциях трансметилирования. Наиболее важный из них синтез фосфатидилхолина из фосфатидилэтаноламина, обезвреживание биогенных аминов с участием О-метилтрансфераз, синтез адреналина из норадреналина, синтез ацетилхолина из холина и Ацетил-КоА, синтез креатина, который в виде креатинфосфата является резервной формой макроэргических связей и участвует в обеспечении нервной ткани и работающей мышцы АТФ.
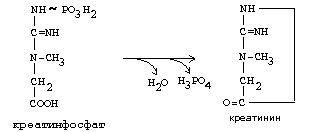
Синтез креатина.
В синтезе креатина участвуют и другие аминокислоты - аргинин и глицин. В почках из аргинина и глицина образуется гуанидинацетат, который метилируется в печени с участием S-аденозил-метионина и в результате образуется креатин:
![]()
Гомоцистеин участвует в синтезе амикислот - цистеина (гомоцистеин + серин). Креатин подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью - креатинфосфат. Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК).
Эта реакция интенсивно идет в мышцах, особенно, в сердечной мышце, и в ткани мозга. Креатинфосфат активно синтезируется в покое и распадается при мышечной работе. Это наиболее быстрый способ регенерации АТФ. Креатин, образовавшийся из креатинфосфата распадается до креатинина, который является конечным продуктом и выводится с мочой. В сутки выводится 1-2 грамма креатинина. Это количество креатинина прямо пропорционально мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин. Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации.