
- •Кафедра хімії
- •Хімічна кінетика та рівновага
- •1. Теоретична частина 4
- •1. Теоретична частина
- •1.1. Загальні уявлення
- •1.2. Швидкість хімічних реакцій
- •1.3. Закон діючих мас
- •1.4. Енергія активації
- •1.5. Вплив температури на швидкість реакції
- •1.6. Каталіз
- •1.7. Хімічна рівновага
- •1.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •2. Лабораторна робота
- •Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
- •Дослід 2. Вплив температури на швидкість реакції в гомогенній системі
- •Дослід 3. Вплив величини поверхні розділу реагуючих речовин на швидкість реакції в гетерогенній системі. Взаємодія крейди(мармуру) з соляною кислотою.
- •Дослід 4. Вплив каталізатора на швидкість реакції. Каталітичний розклад пероксиду водню.
- •Дослід 5. Вплив концентрації реагуючих речовин на зміщення рівноваги
- •Література
1.2. Швидкість хімічних реакцій
Швидкістьхімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії або розкладання за одиницю часу в одиниці об'єму (для гомогенних реакцій) або на одиницю поверхні поділу фаз (для гетерогенних реакцій).
Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу.
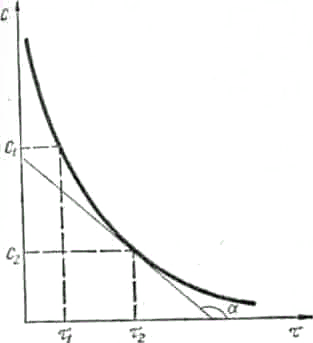
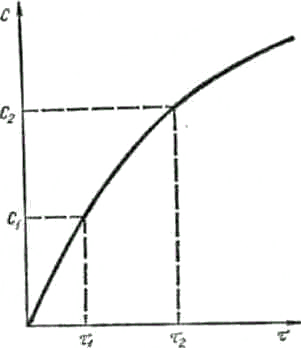
Зміна концентрацій дорівнює різниці між концентрацією С2, що відповідає моменту часу τ2, і початковою концентрацією С1в момент часу τ1. Тоді середня швидкість реакції дорівнює:
![]() (1)
(1)
Чим менший проміжок часу ∆τ, тим менша зміна концентрації ∆С і тим ближче відношення ∆С/∆τ до істинної швидкості хімічної реакції. Відомо, що концентрації речовин у хімічному процесі змінюються безперервно (рис. 1),тому правильніше описувати хімічний процес у певний момент часу за допомогою істинної швидкості реакції. Точний математичний вираз істинної швидкості реакції є перша похідна від концентрації за часом:
![]() (2)
(2)
Оскільки швидкість хімічних реакцій завжди додатна і характеризується зміною концентрацій реагуючих речовин (С2 < С1), то величина ∆С (dC) буде від'ємна і відношення ∆С/∆τ (dC/dτ) у формулах (1), (2) треба брати із знаком «мінус». Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакцій (див. рис. 1), то величина ∆С (dC)додатна і відношення ∆С/∆τ (dC/dτ) у формулах (1), (2) треба брати із знаком «плюс». Швидкість хімічних реакцій,
а б
Рис. 1. Зміна концентрацій С реагуючих речовин (а) та продуктів реакції (б).
як правило, вимірюють у моль/(дм3∙с). Істинна швидкість реакцій дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу (див. рис. 1):
![]() =
tg
α.
=
tg
α.
Значення швидкості, розраховані за зміною концентрацій вихідних речовин або продуктів реакції, можуть бути різними, якщо всі коефіцієнти в рівнянні реакції не дорівнюють одиниці. Так. швидкість реакції
Н2+І2=2НI,
виміряна за зміною концентрації НІ, вдвоє більша за швидкість, виміряну за зміною концентрації водню або йоду. Справді, концентрація НІ більша за концентрацію водню в два рази, тому
![]()
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
1.3. Закон діючих мас
Необхідною умовою перебігу хімічної реакції між двома речовинами є зіткнення їхніх молекул. Зрозуміло, що швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об'єму. Вірогідність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин.
Отже. швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції. Ця закономірність має назвузакону діючих мас, відкритого російським ученим М.М.Бекетовим і норвезькими вченими К. Гульдбергом і П. Вааге.
Для взаємодії двох молекул, наприклад водню і йоду за рівнянням
Н2+I2=2НI,
в елементарному акті якої беруть участь по одній молекулі, закон діючих мас у матемаїичній формі має вираз:
![]()
Для реакції
2NO + Сl2 = 2NOCl
швидкість дорівнює:
![]()
Для загальної реакції
аА + bB = dD +eE
швидкість дорівнює:
![]() (3)
(3)
Величина kу рівнянні (3)є коефіцієнтом пропорційності між швидкістю і концентрацією і називаєтьсяконстантою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості при сталій температурі є величина стала і характеризує природу реагуючих речовин.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степенів у законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо приклад. Фотохімічне розкладання газоподібного НВг відбувається за стехіометричним рівнянням
2НВг(г) =Н2(г) +Вг2(г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул НВг. Насправді зазначена фотохімічна реакція відбувається за таким механізмом:
НВг + hv =Н +Вг;
Н +НВг =Н2 +Вг;
Вг +Вг =Вг2.
Отже, ніякого зв'язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, взагалі немає. Збіг, який спостерігається для деяких реакцій, має випадковий характер. Перебіг більшості хімічних реакцій такий, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних або паралельних), які можна вважати елементарними реакціями.
Зрозуміло,
що швидкість реакції, яка складається
з кількох елементарних стадій,
зумовлюється швидкістю перебігу
повільнішої з них. Сума показників
степенів у рівнянні швидкості хімічної
реакції (кінетичне рівняння)
(3)є важливою характеристикою
механізму процесу і називаєтьсяпорядком
хімічної реакції. Якщо порядок
реакції нульовий (швидкість не залежить
від концентрації реагуючих речовин),
то
![]() =
const.
=
const.
Швидкість реакції першого порядкуописують кінетичним рівнянням
![]() =kC.
=kC.
Прикладом реакцій першого порядку є розкладання оксиду азоту(V):
N205 = 2NO2 +1/2O2
Для реакцій другого порядкукінетичне рівняння має вигляд
![]() =
kC2;
=
kC2;
![]() =
kC1С2.
=
kC1С2.
Прикладом реакцій другого порядку є взаємодія водню і йоду за рівнянням
Н2+ I2 =2НI
Для характеристики механізму реакцій застосовують також поняття молекулярності реакції. Під молекулярністю реакції розуміють кількість молекул, які беруть участь в елементарному акті взаємодії.
Реакція, для перебігу якої потрібна лише одна молекула, називається мономолекулярною реакцією. Це —реакція розкладання абоперегрупування, наприклад:
I2 = 2I,
НВг =Н +Вг;
N205 = 2NO2 +1/2O2
Бімолекулярна реакціяпотребує для елементарного акту двох частинок (молекул, іонів, атомів):
Н2+ I2 =2НI
У тримолекулярних реакціяхберуть участь одночасно три молекули (ці реакції відбуваються дуже рідко):
2NO +О2 =2NO2.
Реакцій, молекулярність яких більше ніж три, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул маловірогідне. Фактично всі елементарні хімічні реакції, крім сумарних, є мономолекулярними або бімолекулярними, тобто всі реальні хімічні реакції дуже прості, незважаючи іноді на складність сумарних стехіометричних рівнянь. Отже, сумарна форма рівняння хімічної реакції не виражає складності і багатостадійності процесу, який може складатися з кількох елементарних реакцій різного порядку.
