
Хімія / Общая химия конслек Модуль 2
.pdfмогою електрода порівняння (водневого, каломельного тощо) чи обчислюють за рівнянням Нернста:
E |
|
n |
|
EoMen / Me |
RT |
ln[Men ] |
(11.1) |
Me |
/ Me |
|
|||||
де EoMen /Me - |
|
|
nF |
|
|||
стандартне значення електродного потенціалу (при |
[Men+]=1 |
||||||
моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
Для водневого електрода E20H / H2 0(прийнято в якості міжна-
родного стандарту). Підставивши в рівняння (11.1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
E |
|
n |
|
EoMen / Me |
0,059 |
lg[Men ] |
(11.2) |
Me |
/ Me |
|
|||||
|
|
|
n |
|
|||
Концентрація іонів металу обчислюється за рівнянням:
[Men+]=С· z·
де С – молярна концентрація розчину; z - число іонів металу, що утворюються із однієї молекули електроліту; - ступінь дисоціації, в частках одиниці.
Значення стандартних електродних потенціалів відносно водневого електрода визначені при 298 К (25ºС) і зведені в таблиці електродних потенціалів (див. Додаток, с.22). Для будь-якої іншої концентрації електроліту електродний потенціал розраховується за рівняннями
(11.1),(11.2).
Приклад 1. Обчислити потенціал мідного електрода, якщо концентрація CuSO4 – 0,5 моль/л (ECu2 /Cu 0,34В).
0
Розв’язання. Для електродної реакції Cu2++2е-=Cu n 2 . Концентрація іонів металу [Cu2+]=0,5 моль/л. Тому
E |
2 |
|
0,34 |
0,059 |
lg0,5 0,36 В. |
/Cu |
|
||||
Cu |
|
2 |
|
||
Розмістивши метали у порядку зростання значень їхніх стандартних електродних потенціалів (Додаток 1), одержують ряд стандарт-
них електродних потенціалів (електрохімічний ряд напруг металів):
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H2,
41
Bi, Cu, Hg, Ag, Pd, Pt, Au
Електрохімічний ряд напруг характеризує властивості металів у водних розчинах:
•Чим меншим є електродний потенціал металу, тим легше він окиснюється і тим важче відновлюються його катіони у водних розчинах.
•Метали, що мають негативні значення електродного потенціалу,
тобто стоять у ряду напруг до водню, здатні витісняти його із розведених розчинів кислот (HCl. H2SO4(розб.), СH3COOH, H3PO4) .
• Кожен метал здатний витісняти (відновлювати) з розчинів солей ті метали, які мають більш високе значення електродного потенціалу.
Активні метали взаємодіють з водою за кімнатної температури, метали середньої активності — при нагріванні, малоактивні метали (Cu, Ag, Au, Pt) з водою не взаємодіють.
K, Ca, Na, Mg, Al, Mn, Zn, Fe, Ті |
Cu, Hg, Ag, Pt, Au |
|
Витісняють водень |
|
|
Ео(Меn+/Me) < -0,41В |
Не взаємодіють |
|
За звичайної |
За високих |
|
температури |
температур |
|
2Na + 2H2O → 2NaOH + H2
to
Zn + H2O ZnO + H2
Метали взаємодіють з кислотами з утворенням солей, але в залежності від активності металу, природи та концентрації кислоти продукти відновлення кислоти можуть бути різними.
Метали, що стоять у ряді напруг до водню (крім свинцю), витісняють останній із таких кислот, як H3PO4, HCN, CH3COOH, HCl, HBr, HI, H2SO4(розб.) за загальною схемою
K, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn |
Pb, Cu, Hg, Ag, Pt, Au |
H2+сіль |
Не взаємодіють |
|
|
Zn+2HCl=ZnCl2+ H2
Mg + H2SO4(розб.) = MgSO4 + H2
Свинець не взаємодіє з галогеноводневими кислотами і H2SO4(розб.) тому, що на поверхні металу утворюються нерозчинні плівки: PbCl2, PbBr2,. PbI2, PbSO4.
Із концентрованою H2SO4 метали взаємодіють за схемою:
42

K, Na, Mg, |
Al |
Mn, Zn |
Fe |
Ni, Sn, Pb, Cu, Ag |
Pt, Au |
|
|
|
|
|
|
H2S+сіль+H2O |
|
S+сіль + |
|
SО2+сіль+H2O |
Не взаємо- |
|
|
+H2O |
|
|
діють |
4Mg+5H2SO4 4MgSO4+H2S+4H2O 3Zn+4H2SO4 3ZnSO4+S+4H2O Pb+3H2SO4 Pb(НSO4)2+SО2+2H2O
Алюміній і залізо за звичайних умов не взаємодіють із концентрованою сульфатною кислотою, тому що на поверхні цих металів утворюються щільні оксидні плівки Al2O3, Fe2O3.
При сильному нагріванні алюміній і залізо взаємодіють із концентрованою H2SO4 за схемою:
2Fe+6H2SO4 Fe2(SO4)3+3SО2+6H2O 2Al+4H2SO4 Al2(SO4)3+S+4H2O
Розглядаючи взаємодію металів з нітратною кислотою необхідно пам’ятати:
в даному випадку окисником є нітрат-іон за рахунок Нітрогену в ступені окиснення +5;
Нітроген відновлюється до різних ступенів окиснення (від +4
до –3);
чим активнішим є метал і чим розбавленішою є кислота, тим повніше йде відновлення Нітрогену.
Процеси, що при цьому протікають і продукти відновлення Ні-
трогену можна представити такою схемою:
Процес |
5 |
_ |
4 |
|
N 1e N |
||||
|
||||
Продукт |
|
NO2 |
|
|
|
|
|
|
|
Процес |
5 |
_ |
1 |
|
N 4e N |
||||
|
||||
Продукт |
|
N2O |
|
|
|
|
|
|
|
5 |
_ |
3 |
5 |
_ |
2 |
N 2e N |
N 3e N |
||||
|
NO2 |
|
|
NO |
|
5 |
_ |
0 |
5 |
_ |
0 |
N 5e N |
N 5e N |
||||
|
N2 |
|
|
NH3 |
|
|
|
|
NH4NO3 |
|
|
|
|
|
|
|
|
Ag + 2HNO3(конц) –> AgNO3 + NO2 + H2O 3Ag + 4HNO3(розб) –> 3AgNO3 + NO + 2H2O 4Zn + 10HNO3(розб) –> 4Zn(NO3)2 + NH4NO3 + 3H2O
43
Деякі метали (Zn. Be, Al, Cr, Pb, Sn, Sb), що утворюють амфотерні гідроксиди, розчиняються в водних розчинах лугів, або взаємодіють з лугами при сплавлянні:
в розчинах
Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2
2Al+6NaOH+6H2O=2Na3[Al(OH)6]+3H2
при сплавленні
2NaOH+ Zn=Na2ZnO2+H2
6NaOH+2 Al=2Na3AlO3+3H2
Метали взаємодіють з розчинами солей менш активних мета-
лів:
Zn+CuSO4 → ZnSO4 + Cu.
Активні метали ( Mg, Al, Na ) взаємодіють з оксидами металів:
t°
Fe2O3 + 2Al → Al2O3.
Алюміній широко використовують у промисловості для добування багатьох металів з їхніх оксидів (алюмінотермія).
Сплави. У розплавлених металах можуть розчинятися інші метали, складні речовини та неметали. Під час охолодження таких розчинів утворюються сплави. Сплави, як і метали, у твердому стані мають кристалічну будову. Під час кристалізації деяких сплавів утворюються хімічні сполуки. Кристали інших сплавів складаються з атомів вихідних металів, які хімічно не зв'язані один з одним (тверді розчини).
У світі для потреб техніки виробляється 75 металів і близько 1500 різних сплавів. Наприклад, чавун — це залізовуглецевий сплав, у якому масова частка вуглецю понад 2.14%. Сталь — залізовуглецевий сплав з масовою часткою вуглецю меншою за 2.14%. Дюралюміній містить 95% Al, 4%Cu, 0.5%Mg і 0.5%Мn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавлення утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока
44
твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють.
Поширення у природі й одержання металів. У земних умовах більшість металів є стійкими в окисленому вигляді. У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню - Cu, Hg, Ag, Аu, Pt Переважно в природі метали існують у вигляді сполук — оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів і нітратів.
Усі промислові способи одержання металів основані на окис- но-відновних реакціях. У процесі добування металів їх переводять з хімічних сполук у нейтральні атоми.
В залежності від умов ведення процесів розрізняють піро-, гідро- та електрометалургійні способи добування металів.
Пірометалургія об'єднує хімічні способи відновлення металів їх сполук за високих температур. Для відновлення використовую вугілля, точніше, кокс - найбільш доступний та економічно вигідний відновник, оксид карбону(ІІ), водень, активні метали.
Гідрометалургія - вилучення металів з їх сполук у водних розчинах та збагачення руд різних металів із застосуванням води. Гідрометалургійні прийоми широко застосовують при добуванні золота, срібла, індію, кадмію, урану та багатьох інших металів. Наприклад:
CdSO4 + Zn = ZnSO4 + Cd.
Електрометалургія - добування металів за допомогою електричнoго струму (електролізом). Самі активні метали - від літію до мангану - добувають електролізом розплавів (електротермія), менш активні метали Zn, Ni, Cr, Sn, Cu та ін. - електролізом водних розчинів їх солей (гідроелектрометалургія). Електроліз застосовують також для нанесення декоративних і захисних металічних покриттів, для очищення (рафінування) багатьох металів від домішок тощо
11.2. Гальванічні елементи. Корозія металів
Електрохімія вивчає процеси перетворення хімічної енергії в електричну і навпаки.
Електрохімія розглядає виникнення електричного потенціалу на межі поділу двох фаз метал – розчин, утворення електрорушійної сили (ЕРС) у гальванічних елементах, а також явище електролізу.
45
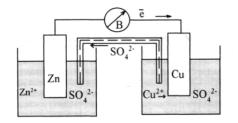
Гальванічний елемент – це прилад, в якому енергія окислюваль- но-відновної реакції перетворюється безпосередньо в електричну. Прикладом може бути гальванічний мідно-цинковий елемент (елемент Якобі–Даніеля),
(-)Zn ZnSO4 CuSO4 Cu (+)
Двома вертикальними рисками позначено межу поділу розчинів обох солей.
Рис.11.3. Схема мідно-цинкового гальванічного елемента
У цьому елементі цинковий електрод є анодом, а мідний – катодом. На аноді відбувається окислення (Zn - 2е-=Zn2+), на катоді – відновлення (Cu2++2е-=Cu). Сумарна реакція Zn+Cu2+=Zn2++Cu є джерелом електричного струму.
Електрорушійну силу (ЕРС) гальванічного елемента визначають як різницю електродних потенціалів. При цьому від потенціалу катода віднімають потенціал анода:
ЕРС=Eкатода-Eанода (11.3)
Приклад 2. Обчислити ЕРС гальванічного елемента ЯкобіДаніеля, якщо концентрація розчину ZnSO4 - 0,1 моль/л, а розчину CuSO4 - 2 моль/л.
Розв’язання. Знаходимо потенціал мідного електрода (катода):
E |
2 |
|
0,34 |
0,059 |
lg 2 0,35 В. |
/Cu |
|
||||
Cu |
|
2 |
|
||
Знаходимо потенціал цинкового електрода (анода):
E |
|
0,76 |
0,059 |
lg0,1 0,79 В; |
E |
2 |
|
0,76 В. |
2 / Zn |
|
/ Zn |
||||||
Zn |
2 |
|
Zn |
|
|
|||
Знаходимо ЕРС елемента:
ЕРС=0,35 - (-0,79)=1,14 В.
46
Гальванічний елемент, що складається із двох однакових електродів, занурених у розчин однорідної солі різних концентрацій, називається концентраційним елементом.
(-)Ag AgNO3 AgNO3 Ag (+) C2 C1
У концентраційних елементах катодом є електрод, що має більшу концентрацію солі C1, анодом – електрод з меншою концентрацією солі C2.
ЕРС таких елементів обчислюють за рівнянням:
EPC |
0,059 |
lg |
C1 |
(11.4) |
|
n |
C2 |
||||
|
|
|
До окислювально-відновних відносять гальванічні елементи, в яких реакція окислення або відновлення проходить у розчині без участі матеріалу електрода, останній служить лише провідником електронів. Прикладом окислювально-відновного електрода може бути платина, занурена в розчин солей FeCl2 і FeCl3. Якщо такий електрод з’єднати з будь-яким іншим у замкнутий елемент, то в ньому прохо-
дитиме реакція окислення-відновлення.
Fe3++e-=Fe2+
Потенціал такого електрода обчислюють за формулою:
E E0 |
|
0,59 |
lg |
[oxyd] |
(11.5) |
|
n |
[red] |
|||||
oxyd / red |
|
|
|
де [oxyd], [red] - концентрація відповідно окисленої і відновленої форми.
Катод – це електрод, на якому відбуваються відновні процеси. Анод – це електрод, на якому проходять окислювальні процеси. У гальванічних елементах катод має позитивний знак /+/; анод – негатив- ний /-/. При електролізі катод негативний, анод – позитивний.
У гальванічних елементах електродний потенціал катода завжди більший, ніж анода.
Приклад 3. Визначити катод і анод для таких двох металів: а)цинк – срібло; б) цинк – магній. Привести схеми цих елементів.
Розв’язання. а) EZn0 2 / Zn 0,76 В; EAg0 / Ag 0,80 В. Отже ци-
нковий електрод – анод, срібний – катод.
47
б) EZn0 2 / Zn 0,76 В; EMg0 2 / Mg 2,36 В. Таким чином, цинковий електрод буде катодом, а магнієвий – анодом.
Схеми таких елементів:
а) (-) Zn Zn2+ Ag+ Ag (+) б) (-) Mg Mg2+ Zn2+ Zn (+)
Корозія – це процес руйнування металу внаслідок хімічної або електрохімічної взаємодії його з навколишнім середовищем: повітрям, водою, газами, розчинами кислот, лугів і солей.
Розрізняють хімічну й електрохімічну корозії. В основі хімічної корозії лежать звичайні хімічні реакції утворення оксидів і солей у середовищах, що не проводять електричного струму (гази при високих температурах, нафтопродукти, мастила, продукти термічної деструкції полімерів).
Електрохімічна корозія виникає в системах, що проводять електричний струм у тих випадках, коли самовільно утворюються гальванічні елементи. Прикладом електрохімічної корозії є корозія чавуну і сталі у вологому середовищі: залізо іржавіє тому, що утворюються гальванічні елементи, в яких катодами є ділянки карбіду заліза Fe3C:
(-) Fe H2O, O2 Fe3C (+)
На анодних ділянках окислюється залізо:
Fe – 2e-= Fe2+
На катодних - відбувається відновлення:
2H2O+O2+4e-=4OH-
Внаслідок вторинних процесів:
Fe2++2OH-=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3=H2O+FeO(OH)
утворюється іржа – суміш нерозчинних продуктів - гідроксидів Fe(OH)2, Fe(OH)3 і оксигідроксидів заліза FeO(OH).
Приклад 4. Написати схеми гальванічних елементів, що утворюються при контактній корозії заліза, покритого цинком, і заліза, покритого оловом.
Розв’язання. У першому випадку утворюється гальванічний еле-
мент
(-) Zn H2O, O2 Fe (+)
в результаті роботи якого руйнується цинк на анодних ділянках:
48
Zn – 2e-= Zn2+
На катодних ділянках утворюються гідроксид-іони:
2H2O+O2+4e-=4OH-
Утворення гідроксиду цинку – вторинний процес
Zn2++2OH-=Zn(OH)2
У другому випадку виникає гальванічний елемент:
(-) Fe H2O, O2 Sn (+)
в результаті роботи якого руйнується залізо на анодних ділянках:
Fe – 2e-= Fe2+
На катодних ділянках утворюються гідроксид-іони, а потім бура
іржа
Fe2++2OH-=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3
У першому випадку цинк окислюється і захищає залізо від корозії (анодний захист); у другому випадку олово захищає залізо, якщо на поверхні заліза утворюється суцільна без тріщин олов’яна плівка (катодний захист).
Присутність іонів H+, Cl-, Br-, I-, CN-, NH4 помітно збільшує швидкість корозії.
Температура досить сильно впливає на швидкість корозії. Як правило, з підвищенням температури швидкість корозії збільшується.
Присутність карбонатів, фосфатів і хроматів сповільнює корозію. Велике значення у процесах корозії має склад і мікроструктура
металу (чим метал однорідніший, тим корозійна стійкість вища).
Для зменшення корозії застосовують різні методи: 1) обробляють навколишнє середовище з метою усунення речовин, які викликають корозію; 2) замінюють повітря (О2) на гелій або інший інертний газ, чи просто створюють вакуум; 3) додають різні інгібітори корозії; 4)створюють захисні плівки (оксидні, масляні, металічні або лакові); 5)вводять у метал компоненти, що підвищують його корозійну стійкість; 6) застосовують протекторний або катодний захист.
11.3. Електроліз
Електроліз – це окислювально-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розчин чи розплав електроліту.
49

Явище електролізу вперше вивчив і в 1834 р. виклав основні закономірності цього явища у вигляді законів електролізу англійський учений Фарадей.
Перший закон Фарадея. При електролізі маса речовини, що виділяється на електродах прямо-пропорційна кількості електричного
струму, що проходить крізь розчин або розплав електроліту. |
|
m=k Q |
(11.6) |
Якщо Q =1 Кл, то m=k, тобто k показує, яка маса речовини виділяється на електроді при проходженні 1 Кл електричного струму крізь еле-
ктроліт, і називається електрохімічним еквівалентом.
Відомо, що Q=I , отже |
|
m=k I |
(11.7) |
де: I - сила електричного струму, А; - тривалість електролізу, с.
Другий закон Фарадея. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
Для того, щоб виділити на електроді один еквівалент будь-якої речовини, треба затратити 96500 Кл (точніше 96487 Кл) електричного струму. Ця кількість електричного струму називається числом Фарадея і позначається F. Оскільки k=mE(X)/F, то підставляючи вираз k в рівняння (11.6), отримаємо об’єднаний вираз першого і другого законів Фарадея:
m(X) |
M(X) I |
|
mE(X) I |
(11.8) |
|
n F |
F |
||||
|
|
|
де m(X) –маса речовини, що виділилася на електроді; n - кількість електронів, що беруть участь в електродному процесі (для процесів виділення металів згідно з рівнянням Men ne Me0 , n - дорівнює зарядові іона Меn+); mE(X) – молярна маса еквівалента речовини (г/моль); M(X) – молярна маса речовини (г/моль); I – сила струму, А; τ – час проходження електролізу, с.
Приклад 5. Обчислити масу міді, що виділилась на катоді, а також масу і об’єм кисню, що виділився на аноді, при електролізі водного розчину CuSO4 з інертним анодом, якщо сила електричного струму – 1 А, тривалість електролізу – 30 хв. (t =27 С, Р=101,3 кПа).
Розв’язання. За рівнянням (11.8) визначимо масу міді, що виділилася на катоді:
50
