
Lectures.Part.2
.1.pdf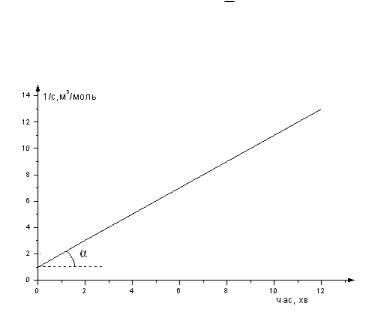
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1 |
|
|
1 |
kt |
|
|
|
(16) |
|
||||||
|
|
|
|
|
|
||||||||||
|
c |
|
|
c0 |
|
|
|
|
|
|
|
|
різні форми запису кінетичного рів- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
1 |
|
|
1 |
|
|
|
|
няння реакції другого порядку |
||
k |
|
|
|
|
|
|
|
|
-1 |
|
-1 3 |
|
|||
|
|
|
|
|
|
[с |
моль |
м ] (17) |
|
||||||
|
|
|
|
||||||||||||
|
|
|
c |
|
c0 |
|
|
|
|
|
|||||
Рівняння (16) є рівнянням прямої в координатах 1c f ( ) (рис.5). Кутовий коефіцієнт даного рівняння tg k .
Рис.5. Кінетичні дані реакції другого порядку в лінійних координатах.
Час половинного перетворення реакції першого порядку знайдемо, підставивши у рів-
няння (17) с=0,5с0:
|
1 |
|
|
1 |
|
|
1 |
|
|
|
|
1 |
|
|
2 |
|
1 |
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
1/ 2 |
|
0,5c0 |
|
c0 |
|
|
|
1/ 2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
c0 |
|
c0 |
|||||||||||
|
|
|
1 |
|
→ |
|
|
|
|
1 |
c 1 |
|
|
(18) |
|||||
1/ 2 |
|
|
1/ 2 |
|
|
|
|
||||||||||||
|
|
|
kc |
|
|
|
|
|
k |
0 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
© Ю.Павловський 2011
12
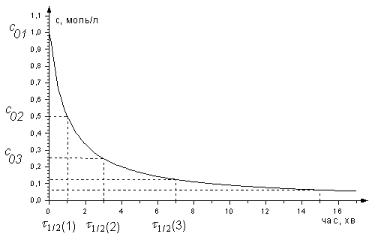
Рис.6. Кінетична крива реакції другого порядку.
З рівняння (18) видно, що час половинного перетворення реакції другого порядку обер-
нено пропорційний до початкової концентрації (пропорційний початковій концентрації речови-
ни у мінус першому степені).
За умови, що k 1 та c0 1 кінетична крива реакції другого порядку матиме вигляд як на рис. 6: час половинного перетворення при зменшенні початкової концентрації у двічі, зро-
стає у двічі.
Якщо виразити концентрації через початкову кількість молів речовини а та кількість мо-
лів що прореагувала х у реакційному об’ємі V то дістанемо:
|
1 |
|
V |
|
|
|
V |
|
V |
x |
|
||||||
k |
|
|
|
|
|
|
|
|
→ k |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||||||
|
a x |
|
|
|
a |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
a(a x) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
або |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
x |
|
|
|
||||||
|
|
|
|
k' |
|
|
|
|
|
|
|
|
(19) |
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
a(a x) |
|
|
|||||||||
|
|
|
|
Реакції третього порядку |
|
||||||||||||
Закон діючих мас для реакції другого порядку |
|
|
|
|
|
||||||||||||
|
|
|
|
w kc1 c1 c1 |
|
|
|
|
(20) |
||||||||
|
|
|
|
|
|
|
|
|
A B |
C |
|
|
|
|
|
||
Реакції третього порядку зустрічаються дуже рідко. Приклади реакцій третього порядку:
a)2NO + O2 = 2NO2
b)2CO + O2 = 2CO2
c)2FeCl3 + SnCl2 = 2FeCl2 + SnCl4
Нехай с А = сВ = cC, тоді
©Ю.Павловський 2011

13
w |
dc |
|
kc3 |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
c |
|
dc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
k d |
|
|
|
|
|
|
|
||||||||||||||||
3 |
|
|
|
|
|
|
|
||||||||||||||||||
c |
|
c |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
k( 0) |
|
|||||||||||
|
2c |
|
|
2 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2c0 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
1 |
|
|
|
1 |
|
|
2kt |
|
|
|
(21) |
|
|||||||||||||
|
c |
2 |
|
|
2 |
|
|
|
|
|
різні форми запису кінетичного |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
c0 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рівняння реакції третього по- |
|
|
|
|
|
1 |
|
|
1 |
|
|
|
1 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[с-1моль-2м6] (22) |
рядку |
||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|||||||
|
|
|
|
|
|
2 c |
|
|
|
c0 |
|
|
|
||||||||||||
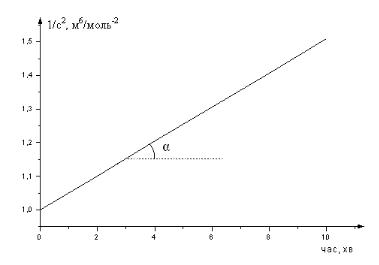
Рівняння (21) є рівнянням прямої в координатах c12 f ( ) (рис.6). Кутовий коефіцієнт даного рівняння tg 2k .
Час половинного перетворення реакції третього порядку знайдемо, підставивши у рів-
няння (22) с=0,5с0:
|
1 |
|
|
1 |
|
|
|
|
1 |
|
|
|
1 |
|
|
|
4 |
|
|
|
1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
k |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
2 1/ 2 |
|
(0,5c0 ) |
2 |
|
|
|
|
2 |
|
2 |
||||||||||||||||
|
|
|
|
|
c0 |
|
|
2 1/ 2 |
c0 |
|
|
c0 |
|
|||||||||||||
|
|
|
|
|
|
3 |
|
|
→ |
|
|
|
|
3 |
|
c 2 |
|
(23) |
||||||||
|
|
1/ 2 |
2kc2 |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
1/ 2 |
|
|
|
2k |
0 |
|
|
|
||||||||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
З рівняння (23) видно, що час половинного перетворення реакції третього порядку обер-
нено пропорційний до квадрату початкової концентрації (пропорційний початковій концентра-
ції речовини у мінус другому степені).
© Ю.Павловський 2011
14
Рис.7. Кінетичні дані реакції третього порядку в лінійних координатах.
Проаналізувавши рівняння (6,11,18,23) дістанемо для реакції n-го порядку:
1/ 2 |
|
|
|
2(n 1) |
1 |
(24) |
|
k |
n |
c(n 1) |
(n 1) |
||||
|
|
|
0 |
|
|
|
|
Методи визначення швидкості реакції та її порядку
Вимірювання швидкості реакції зводиться до експериментального визначення залежно-
сті концентрації реагуючих речовин від часу. У кожному конкретному випадку це завдання ви-
рішується з допомогою певного хімічного чи фізичного методу кількісного аналізу.
Хімічні методи аналізу дають можливість безпосередньо визначити концентрацію одно-
го з учасників реакції. Однак у цьому методі необхідно відносити аналітичні дані до фіксовано-
го моменту часу – зупиняти реакцію шляхом певного впливу на неї: різке зниження температу-
ри, нейтралізація одного х реагентів або каталізатора, додавання інгібітору та ін.
Фізичні методи, хоча і не дають можливість визначити абсолютне значення концентрації реагентів, є більш зручними, оскільки дають можливість неперервного визначення якоїсь із властивостей реагуючих речовин, що пропорційна їх концентрації. Це може бути вимірювання тиску при протіканні реакцій у газовому стані; вимірювання зміни об’єму реакційної суміші
(дилатометричний метод); вимірювання в’язкості реакційної суміші; вивчення оптичних влас-
тивостей розчину: кута обертання поляризованого світла, показника заломлення, поглинання світла (колориметрія) у видимому, ІЧ та УФ спектрах. Застосовують також електричні методи аналізу: кондуктометрію, полярографію, потенціометрію, рН-метрію тощо. Перевагою фізич-
них методів є простота та висока швидкість проведення аналізу, можливість неперервної фікса-
ції даних, інертність по відношення до реакції. Одним з недоліків фізичних методів є неліній-
© Ю.Павловський 2011
15
нійна, у багатьох випадках, залежність між фізичною властивістю, та концентрацією речовини,
що вимагає проведення калібрувальних дослідів.
При визначення порядку реакції користуються:
–методом рівних концентрацій – концентрації реагентів в початковий момент ча-
су однакові. Це дає можливість визначити загальний порядок реакції;
–методом надлишкових концентрацій – концентрації усіх речовин, крім однієї ду-
же великі і їх можна вважати незмінними під час перебігу реакції (метод ізоляції Оствальда). Цей метод використовують тоді, коли необхідно встановити порядок реакції за однією з реагуючих речовин (частковий порядок).
Взалежності від мети дослідження, у кожному з цих способів можна скористуватись од-
ним з інтегральних методів, або ж диференційним методом Вант-Гоффа.
Інтегральні методи визначення порядку реакції використовують інтегральні форми кіне-
тичних рівнянь відповідних порядків. До них відносять: метод підстановки, графічний метод,
метод визначення порядку за часом перетворення певної частки реагентів.
Метод підстановки полягає у тому, що кінетичні дані c f ( ) по черзі підставляють у кінетичні рівняння (5,9,17,22) нульового, першого, другого та третього порядків та порівнюють отримані значення константи швидкості для різних значень часу τ. Якщо розрахована за яки-
мось із цих рівнянь константа швидкості є незмінною у межах похибки експерименту, то вва-
жають, що дане рівняння адекватно описує кінетичні дані і, відповідно, реакція є саме цього порядку.
Наприклад, у реакції N2O5 = N2O4 + 0,5O2 концентрація N2O5 наступним чином зміню-
валась з часом:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
τ, с |
0 |
184 |
|
319 |
|
526 |
|
|
867 |
|
1198 |
|
1877 |
2315 |
3144 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с,моль/л |
2,33 |
2,08 |
|
1,91 |
|
1,67 |
|
|
1,36 |
|
1,11 |
|
0,72 |
0,55 |
0,34 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Розраховані за рівняннями (9,17,22) константи швидкості матимуть значення: |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
τ, с |
|
|
0 |
|
184 |
319 |
|
526 |
|
867 |
|
1198 |
|
1877 |
|
2315 |
|
3144 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
k1*104, с-1 |
|
|
- |
|
6,17 |
6,23 |
|
6,33 |
|
6,20 |
|
6,19 |
|
6,26 |
|
6,24 |
|
6,12 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
k2*104, с-1моль-1м3 |
|
- |
|
2,80 |
2,96 |
|
3,22 |
|
3,53 |
|
3,94 |
|
5,11 |
|
6,00 |
|
7,99 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
k3*104 , с-1моль-2м6 |
|
- |
|
1,28 |
1,41 |
|
1,66 |
|
2,06 |
|
2,62 |
|
4,65 |
|
6,74 |
|
13,50 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
© Ю.Павловський 2011
16
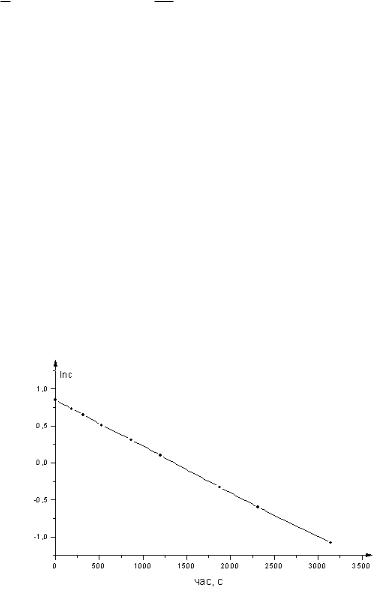
З наведених даних випливає, що дана реакція є першого порядку, бо розрахована за рів-
нянням першого порядку константа швидкості приблизно однакова, у той час , як за рівняннями другого та третього порядків – змінюється.
Графічний метод полягає у побудові кінетичних кривих у координатах першого
ln c f ( ) , другого 1c f ( ) та третього c12 f ( ) порядків. Отримана пряма свідчить про відповідність реакції даному порядку.
Застосуємо даний метод для наведеної вище реакції. За даними табл.1 розрахуємо дані для побудови графіків і занесемо їх у табл. 3.
Приведені графіки показують що лише в координатах першого порядку отримано пряму.
Отже, дана реакція є реакцією першого порядку.
|
|
|
|
|
|
|
|
|
Таблиця3 |
|
|
|
|
|
|
|
|
|
|
|
|
τ, с |
0 |
184 |
319 |
526 |
867 |
1198 |
1877 |
2315 |
3144 |
|
|
|
|
|
|
|
|
|
|
|
|
lnс |
0,85 |
0,73 |
0,65 |
0,51 |
0,31 |
0,10 |
-0,33 |
-0,60 |
-1,08 |
|
|
|
|||||||||
1/с, моль/л |
0,429 |
0,481 |
0,524 |
0,599 |
0,735 |
0,901 |
1,389 |
1,818 |
2,941 |
|
|
|
|||||||||
1/с2, (моль/л)2 |
0,184 |
0,231 |
0,274 |
0,359 |
0,541 |
0,812 |
1,929 |
3,306 |
8,651 |
|
|
|
|||||||||
Рис.9.Кінетичні дані в координатах першого порядку
© Ю.Павловський 2011
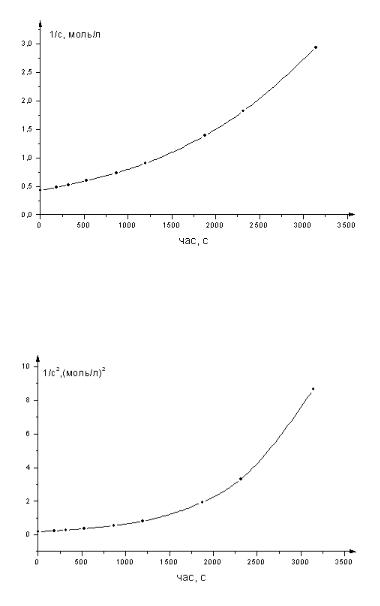
17
Рис.10.Кінетичні дані в координатах другого порядку
Рис.11.Кінетичні дані в координатах третього порядку Метод визначення порядку реакції за часом половинного перетворення. У цьому методі
встановлюють залежність часу половинного перетворення від початкової концентрації
1/ 2 f (c0 ) . Якщо час половинного перетворення не залежить від початкової концентрації – порядок реакції перший, якщо обернено пропорційний – другий, якщо обернено пропорційний до квадрату початкової концентрації – третій.
Метод Нойєса-Оствальда. В цьому методі логарифмічну форму рівняння (24):
1/ 2 |
|
|
|
2(n 1) |
1 |
|
|
|||
k |
n |
c(n 1) |
(n 1) |
|
||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
або |
|
|
|
|
|
const |
(25) |
||
|
|
1/ 2 |
|
c(n 1) |
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
0 |
|
|
|
© Ю.Павловський 2011
|
18 |
||||||
Логарифмуємо рівняння (25) і дістанемо: |
|||||||
|
|
ln( 1/ 2 ) ln const (n 1)ln c0 |
|||||
Запишемо (26) для двох початкових концентрацій: |
|||||||
ln( 1/ 2 )1 |
ln const (n 1)ln c01(а) |
||||||
ln( 1/ 2 )2 |
ln const (n 1) ln c02 (б) |
||||||
Віднімемо (б) від (а) і дістанемо: |
|||||||
ln( 1/ 2 )1 |
ln( 1/ 2 )2 (n 1)(ln c01 ln c02 ) (в) звідки: |
||||||
|
|
ln |
( 1/ 2 )1 |
||||
|
n |
( 1/ 2 )2 |
|
1 |
|||
|
ln |
c02 |
|
|
|||
|
|
|
|
||||
|
c01 |
||||||
|
|
|
|
||||
(26)
(27)
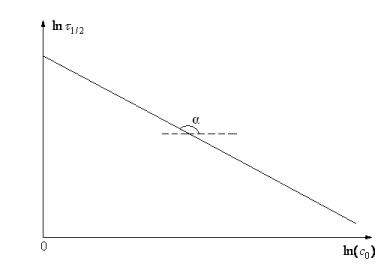
Даний метод має також графічну інтерпретацію. Рівняння (26) є рівнянням прямої в ко-
ординатах ln 1/ 2 f ln(c0 ) . Кутовий коефіцієнт даного рівняння tg (n 1) , а отже,
n 1 tg .
Рис.12. Визначення порядку реакції методом Нойєса-Оствальда
У двох останніх методах можна використовувати не лише час половинного перетворен-
ня, а й час перетворення будь якої іншої частки речовини – 1/3, 2/3, 1/4 тощо.
Диференційний метод Вант-Гоффа базується на використанні логарифмічної форми рі-
вняння (3). Для початкового моменту часу:
w0 kc0nA c0qB c0rC
Якщо підтримувати постійною початкову концентрацію усіх реагентів крім одного
( c0qB const,c0rC const ) то дістанемо спрощене рівняння :
© Ю.Павловський 2011

19
w k'cn |
|
|
|
|||
0 |
0 A |
|
|
|
||
або |
|
|
|
|
|
|
|
ln w0 ln k' nln c0 A |
(28) |
||||
Запишемо дане рівняння для двох початкових концентрацій: |
|
|||||
ln w01 ln k' nln c0 A1 (а) |
|
|
|
|||
ln w02 ln k' nln c0 A2 (б) |
|
|
|
|||
Віднімемо (б) від (а) і дістанемо: |
|
|
|
|||
ln w01 ln w02 n(ln c0 A1 ln c0 A2 ) , або: |
|
|||||
|
n ln |
w01 |
/ ln |
c01 |
|
(29) |
|
|
|
|
|||
|
|
w02 |
c02 |
|
||
Для визначення швидкості реакції у початковий момент часу користуються методом до- |
||||||
тичних, або методом кінцевих різниць. |
|
|
|
|||
У методі дотичних будують початкові ділянки кінетичних кривих c f ( ) для різних |
||||||
значень c0i |
і за тангенсом кута нахилу дотичної до кривої у початковий момент часу знаходять |
|||||
w0i .
У методі кінцевих різниць використовують той факт, що будь яку залежність у початко-
вий момент часу можна описати відрізком прямої, а швидкість знаходять , як середню за неве-
ликий проміжок часу Δτ:
w |
c |
|
c0 c |
(30) |
|
|
|||
0 |
|
|
|
|
|
|
|
Диференційний метод Вант-Гоффа також має графічну інтерпретацію. Рівняння (28) є
рівнянням прямої у координатах ln w0 f ln(c0 ) . Кутовий коефіцієнт даної прямої tg n .
© Ю.Павловський 2011
20
Рис.13. Визначення порядку реакції диференційним методом Вант-Гоффа
Таким чином для визначення порядку реакції необхідно мати хоча б одну повну кінетич-
ну криву, або кілька початкових ділянок кінетичної кривої при різних початкових концентраці-
ях.
© Ю.Павловський 2011
