
методичка фкх
.pdfВстановити залежність швидкості, ступеня та граничного набухання ВМС від рН середовища і визначити ізоелектричну точку желатину. Для цього потрібно:
1.Приготувати розчини із заданим значенням рН.
2.Визначити прирощення маси високополімеру за певний відрізок часу.
3.Розрахувати ступінь набухання.
4.Побудувати графічну залежність ступеня набухання від часу і розрахувати швидкість набухання.
5.Побудувати графічну залежність ступеня набухання від швидкості і знайти граничний ступінь набухання.
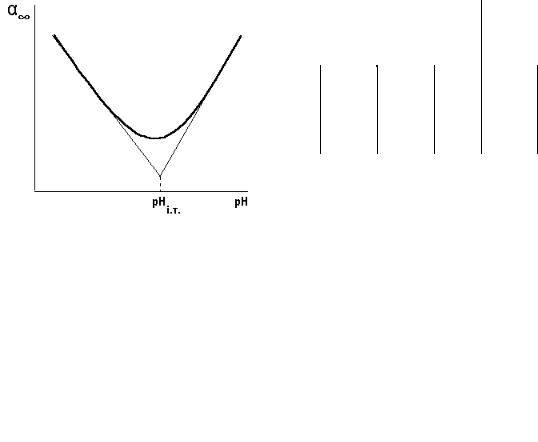
6.Побудувати графічну залежність граничного ступеня набухання від рН розчину і визначити ізоелектричну точку желатину.
Прилади, лабораторний посуд та реактиви
Торзійні терези, технічні терези, бюкси, секундомір, фільтрувальний папір, желатин, розчини соляної кислоти різної нормальності (рН), буферні суміші.
Порядок виконання роботи
Варіант 1
1.Близькі за розмірами і масою платівки желатину, заздалегідь відмиті від домішок і низькомолекулярних фракцій, зважують на торзійних терезах і записують їх початкову масу m0.
2.Кожну зважену платівку желатину опускають в бюкс, який на 2/3 заповнений розчином з певним значенням рН. Включають секундомір і через кожні 0,5 – 2 хв його зупиняють, виймають платівку желатину і швидко висушують її між аркушами фільтрувального паперу.
3.Зважують платівки на торзійних терезах. Масу платівок за відповідний
проміжок часу позначають m .
4. Знову занурюють платівки желатину в розчин на певний проміжок часу. Дослід продовжують, доки збільшення маси стане незначним або маса набуде сталого значення.
Опрацювання результатів
1. Експериментальні дані заносять до табл. 12.3.
Таблиця 12.3
Результати дослідження кінетики набухання желатину в розчинах з різним значенням рН ваговим методом
Загальний час від |
Маса платівки до |
Ступінь набухання |
||
початку набухання |
|
|
mτ m0 |
|
, хв |
часу , |
|
|
|
m , мг |
m0 |
|
||
|
|
|
|
|
81
2.За даними табл. 12.3 будують криву кінетики набухання желатину
f ( ) в розчинах з різними значеннями рН.
3.На криволійній частині кривої вибирають кілька точок, проводять дотичні та обчислюють швидкості набухання U для відповідних значень ступеня
набухання як тангенси кутів нахилу дотичних : tg d |
U (див. рис. 12.1, |
dτ |
|
а). |
|
4. Граничний ступінь набухання визначають при нульовій швидкості набухання. Будують графік в координатах ступінь набухання – швидкість
набухання –U (див. рис. 12.1, б). Відрізок, відокремлений прямою на осі ординат, відповідає значенню граничного ступеня набухання (рівноважній кількості увібраної рідини) . Під час побудови графіків осі ординат мають однаковий масштаб.
5.Отримані дані щодо залежності граничного ступеня набухання від рН розчину узагальнюють в таблиці 12.4.
6.За експериментальними даними будують криву залежності граничного ступеня набухання від рН. Ізотерма набухання в ізоелектричній точці проходить через мінімум. Проводять дотичні до початкової та кінцевої ділянок графіка. Перпендикуляр, опущений на вісь абсцис з точки перетину двох
дотичних кривої набухання, вказує ізоелектричну точку рН желатину (рНіт) (рис. 12.2).
Таблиця 12.4.
Залежність граничного набухання желатину від рН розчину
|
|
|
Концентрація соляної |
|
Буферні |
|||||
№ |
Дані |
|
|
кислоти |
|
|
|
суміші |
||
|
|
|
(нормальність) |
|
|
|
||||
|
|
10-1 |
10-2 |
10-3 |
|
10-4 |
|
10-5 |
6,8 |
9,18 |
1 |
рН розчину |
1 |
2 |
3 |
|
4 |
|
5 |
6,8 |
9,18 |
2Граничний ступінь набухання
82
Рис. 12.2. Визначення ізоелектричної точки желатину.
Варіант 2
Порядоквиконання роботи
1.Шість близьких за масою платівок желатину зважують на торзійних терезах і записують їх початкову масу m0.
2.Кожну зважену платівку желатину опускають в бюкс, заповнений на 2/3 розчином з певним значенням рН. Платівку залишають для подальшого набухання на 40 хвилин.
3.Після набухання платівки виймають, висушують між листами фільтрувального паперу і знову зважують. Записують масу платівки желатину після набухання m.
Опрацювання результатів
1. Експериментальні дані заносять в таблицю 12.5.
Таблиця 12.5.
Залежність граничного ступеня набухання желатину від рН розчину
|
|
|
Концентрація соляної |
|
Буферні суміші |
|||
№ |
Дані |
|
|
кислоти |
|
|
|
|
|
|
|
(нормальність) |
|
|
|
||
|
|
10-1 |
10-2 |
10-3 |
10-4 |
10-5 |
6,8 |
9,18 |
1 |
рН розчину |
1 |
2 |
3 |
4 |
5 |
6,8 |
9,18 |
2Маса платівок до набухання, m0, мг
3Маса платівок після набухання, m, мг
4Граничний ступінь набухання,
m m0 m0
2.Будують криву залежності граничного ступеня набухання від рН. Ізотерма набухання в ізоелектричній точці проходить через мінімум. Проводять дотичні до початкової та кінцевої ділянок графіка. Перпендикуляр, опущений на вісь абсцис з точки перетину двох дотичних кривої набухання, вказує ізоелектричну точку рН желатину (рНіт) (рис. 12.2).
Питання для самоперевірки
1.Які речовини належать до високомолекулярних? Природні та синтетичні ВМС, приклади.
2.Які особливості будови молекул ВМС?
3.Які властивості розчинів ВМС притаманні істинним, а які колоїдним розчинам? Які специфічні властивості розчинів ВМС?
4.Що таке набухання? Обмежене та необмежене набухання, приклади.
83
5.Що називається ступенем набухання? Як його можна розрахувати?
6.Охарактеризуйте 4 стадії набухання.
7.Запишіть рівняння швидкості набухання. Графічний метод знаходження граничного ступеня набухання та константи швидкості набухання.
8.Що таке граничний ступінь набухання? Як його можна визначити?
9.Ваговий методи визначення ступеня набухання.
10.Як розраховують швидкість набухання?
11.Які чинники впливають на набухання ВМС?
12.Охарактеризувати вплив на набухання ВМС природи полімера та розчинника, в’язкості розчинника, молекулярної маси ВМС.
13.Як впливає температура на швидкість та ступінь набухання?
14.Як впливає рН середовища на набухання ВМС?
15.Що таке ізоелектричний стан білка? Як визначити ізоелектричну точку желатину за ступенем набухання?
16.Що називається висолюванням? Його вплив на набухання ВМС. Навести ряд Гофмейстера для аніонів та катіонів.
17.Охарактеризувати вплив додавання спирту в розчин на ступінь набухання желатину.
Лабораторна робота № 13 ВИЗНАЧЕНЯ ЗВ`ЯЗАНОЇ ВОДИ ІНДИКАТОРНИМ
РЕФРАКТОМЕТРИЧНИМ МЕТОДОМ
Мета роботи – ознайомлення з методикою визначення кількості води, що зв`язується гідрофільними ВМС, та визначення кількості зв`язаної води дисперсією різних харчових речовин.
Зв`язаною вважається вода, розташована на межі поділу фаз і приєднана до макромолекул ВМС за механізмом водневого зв’язку. Гідрофільними називають ВМС, що утворюють водневий зв`язок з водою. З усіх видів міжмолекулярної взаємодії Н-зв`язок є найміцнішим і його енергія досягає 20– 30 кДж/моль води. Тому властивості води, зв`язаної ВМС, відрізняються від властивостей вільної води.
Властивості колоїдних систем в значній мірі залежать від вмісту в ньому зв’язаної та вільної води, тобто від наявних форм зв’язку води з полімерами. Вода має різні види зв’язку із високомолекулярними речовинами: від самого міцного, обумовленого молекулярними силами, до чисто механічного утримання вологи на поверхні дисперсних частинок.
Зв’язана вода має наступні відмінні властивості. Вона замерзає при більш низьких температурах, які можуть досягати –15 –20 0С. Густина і в’язкість зв’язаної води більші, ніж у вільної води, а діелектрична проникність – менша. Зв’язана вода не може бути розчинником для інших речовин.
84

Особливою властивістю зв’язаної води є її дуже слабка рухливість, що обумовлює здатність набухлих білкових драглів зберігати форму.
Кількість зв’язаної води визначається гідрофільністю ВМС. Гідрофільність – це кількість зв’язаної води, що припадає на 100г
абсолютно сухої речовини ВМС.
Чим вища спорідненість макромолекули ВМС до води, тим вища їх гідрофільність і тим більше зв’язаної води містить ВМС. Так, в желатині кількість зв’язаної води у два рази вище маси сухої речовини, а в агар-агарі – в чотири рази.
Методи визначення кількості зв`язаної води базуються на використанні її властивостей. Зв`язану воду визначають за теплотою змочування ВМС, за густиною зв`язаної води, за діелектричною проникністю, за зниженням температури замерзання, за властивістю зв’язаної води не бути розчинником для інших речовин.
Найбільш розповсюдженим методом визначення зв’язаної води є індикаторно-рефрактометричний. Суть цього методу полягає в тому, що вода, зв`язана гідрофільними ВМС, не є розчинником для інших речовин. Якщо в розчин цукрози концентрацією С0 внести наважку сухого крохмалю, концентрація розчину підвищиться до концентрації Ср внаслідок вибіркової адсорбції крохмалю до води. Отже, розчин цукрози показує (індукує) на цю вибірковість. Речовину – ”індикатор” підбирають таким чином, щоб вона слабко взаємодіяла з ВМС.
Початкову і рівноважну концентрації “індикатора” цукру визначають рефрактометром.
Якщо в наважці повтряно-сухого крохмалю m з вологістю А % міститься вода в кількості 100A m , г, то у разі занурення наважки в розчин цукрози відбувається додаткове зволоження крохмалю. Маса води, що її вбирає наважка
крохмалю з розчину індикатора, становить B CP C0 , г, де В – маса розчину
CP
цукрози, доданої до наважки крохмалю. Загальна кількість води х, зв`язаної наважкою крохмалю,
x |
A m |
B |
C p C0 |
. |
(13.1) |
|
100 |
C p |
|||||
|
|
|
|
Мірою гідрофільності називають кількість зв’язаної води, що припадає на одиницю маси абсолютно сухої речовини. Якщо маса сухої речовини, г, n у взятій наважці
n m |
A m |
, |
(13.2) |
|
100 |
||||
|
|
|
то гідрофільність W, виражена у відсотках до наважки сухої речовини,
W |
x |
100%. |
(13.3) |
|
n |
||||
|
|
|
Завдання на виконання роботи
85
1.Приготувати розчин цукрози концентрацією, вказаною викладачем і уточнити її на рефрактометрі.
2.Виміряти концентрацію розчину цукрози після його контакту з крохмалем.
3.Розрахувати гідрофільність крохмалю.
Прилади, лабораторний посуд та реактиви
Рефрактометр, технічні терези, бюкс з кришкою, хімічна склянка з паличкою, відстійник, крохмаль, цукроза.
Порядок виконання роботи
1.Розчин цукрози масою 20 г заданої концентрації готують у хімічній склянці, користуючись технічними терезами.
2.Концентрацію приготовленого розчину уточнюють за рефрактометром і позначають як С0.
3.Для приготування наважки крохмалю зважують порожній бюкс з паличкою і кришкою, потім насипають у нього 3 – 4г крохмалю і знову зважують бюкс.
4.При перемішуванні в бюкс з крохмалем вливають 5 – 8 цукрового розчину. Бюкс зважують і ставлять у відстійник.
5.Після освітлення верхньої частини суспензії відбирають піпеткою кілька краплин розчину для рефрактометричного визначення рівноважної концентрації Ср.
Опрацювання результатів
1.Загальну кількість води, зв`язану крохмалем, визначають за формулою (13.1).
2.Гідрофільність крохмалю визначають за формулою (13.3).
3.Співставляють одержану величину гідрофільності з довідковою.
Оцінка похибки вимірювань
Загальна похибка визначення гідрофільності складатиметься з похибок: вимірювання концентрації розчину цукрози рефрактометром
0,2 % 2 = 0,4 %;
вагових вимірів технічними терезами
0,1 % 5 = 0,5 %.
Отже, загальну похибку проведення експерименту можна прийняти такою, що дорівнює ~1 %.
Питання для самоперевірки
1.Що називається зв’язаною водою?
2.Що таке водневий зв`язок?
3.Яка природа гідрофільності ВМС (природних і синтетичних)?
4.Які є властивості зв`язаної води?
5.Які види зв’язку води вам відомі?
86
6.Які Ви знаєте методи визначення зв`язаної води?
7.В чому суть методу диференційної скануючої калориметрії?
8.Що таке гідрофільність? Як її можна розрахувати?
9.Як розрахувати кількість води, зв’язаної наважкою крохмалю?
10.Як підбирається речовина-індикатор в індикаторному рефрактометричному методі визначенням зв’язаної води?
ЛІТЕРАТУРА
1.Манк В.В, Мірошников О.М., Подобій О.В., Стеценко Н.О Колоїна хімія: Практикум. –К.:НУХТ, 2008 – 170 с.
2.Воловік Л.С., Ковалевська Є.І., Манк В.В, Мірошников О.М., Федоренко Г.А. Фізична хімія: Підручник – К.: фірма «Інкос» 2007. -191 с.
3.Чумак В. Л., Іванов С. В. Фізична хімія: Підручник – К.:Книжкове вид-во НАУ, 2007. – 648 с.
4.Воловик Л.С., Ковалевська Є.І., Манк В.В. та ін. Колоїдна хімія: Підручник. – К.: Вид-цтво “Книголюбів”, 1999. – 238 с.
87
ЗМІСТ |
|
Вступ…………………………………………………………….................. 3 |
|
Лабораторна робота № 1. ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ |
|
РОЗЧИНЕННЯ |
|
СОЛІ.................................................................................................................. |
4 |
Лабораторна робота № 2. АНАЛІЗ ДІАГРАМ СТАНУ ОБМЖЕНО |
|
РОЗЧИННИХ РІДИН………………………………………… ………………9 |
|
Лабораторна робота № 3.КРІОМЕТРИЧНЕ ВИЗНАЧЕННЯ МОЛЯРНОЇ |
|
МАСИ РЕЧОВИНИ……………………... .........................................................13 |
|
Лабораторна робота № 4. ЕЛЕКТРОПРОВІДНІСТЬ РОЗЧИНІВ |
|
ЕЛЕКТРОЛІТІВ………………………………………………………………...21 |
|
Лабораторна робота №5.ЕЛЕКТРОРУШІЙНІ СИЛИ……………………….29 |
|
Лабораторна робота №6.ХІМІЧНА КІНЕТИКА……………………………..36 |
|
Лабораторна робота №7.ВИЗНАЧЕННЯ ПОВЕРХЕВОГО НАТЯГУ |
|
РОЗЧИНІВ ТА РОЗРАХУНОК АДСОРБЦІЇ НА МЕЖІ ПОДІЛУ РОЗЧИН- |
|
ПОВІТРЯ……………………………………………………………………….46 |
|
Лабораторна робота №8 АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ТВЕРДЕ ТІЛО- |
|
РІДИНА.ОБЧИСЛЕННЯ ПИТОМОЇ ПОВЕРХНІ АДСОРБЕНТУ…………54 |
|
Лабораторна робота №9.МЕТОДИ ОДЕРЖАННЯ КОЛОЇДНИХ |
|
СИСТЕМ………………………………………………………………………....60 |
|
Лабораторна робота №10.ЕЛЕКТРОФОРЕТИЧНЕ ВИЗНАЧЕННЯ |
|
ЕЛЕКТРОКІНЕТИЧНОГО ПОТЕНЦІАЛУ……………………………………66 |
|
Лабораторна робота №11.ВИЗНАЧЕННЯ КОАГУЛЮЮЧОЇ ДІЇ ЗОЛЮ |
|
ГІДРОКСИДУ ЗАЛІЗА ТА ПЕРЕВІРКА ПРАВИЛА ШУЛЬЦЕ-ГАРДІ…….69 |
|
Лабораторна робота №12. ВИЗНАЧЕННЯ КІНЕТИКИ І СТУПЕНЯ |
|
НАБУХАННЯ ЖЕЛАТИНУ……………………………………………………73 |
|
Лабораторна робота №13.ВИВЧЕННЯ ЗВЯЗАНОЇ ВОДИ ІНДИКАТОРОМ |
|
РЕФРАКТОМЕТРИЧНИМ МЕТОДОМ………………………………………….84 |
|
ЛІТЕРАТУРА……………………………………………………………………….87
88

Навчальне видання
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ
МЕТОДИЧНІ ВКАЗІВКИ
до виконання лабораторних робіт для студентів напряму 6.051701 "Харчові технології та інженерія"
денної та заочної форми навчання
Укладачі: Грабовська Олена В’ячеславівна Мірошников Олег Миколайович Подобій Олена Валеріївна Воловик Людмила Сергіївна Ковалевські Єлизавета Іванівна
Редактор Т.П. Хоменко Комп‘ютерна верстка
Підп. До друку 00.00.11 р. Обл.-вид. арк. Наклад 1000 прим. Вид. № 131/04. Безплатно. Зам. №
РВЦ НУХТ, 01033 Київ-33, вул. Володимирська, 68
89
