
- •47.Визначення вмісту «загального нітрогену» у природних водах (шляхи надходження нітрогену у природні води, форми його існування, способи зберігання проб води для аналізу, суть визначення).
- •26. Яке середовище і чому є оптимальним для аналізу поверхневих вод методом Фольгарда.
- •27. Яким чином уникнути впливу заважаючи іонів при визначенні хлорид іонів у морській воді методом фольгарда?
- •28. У чому полягає хімізм комплексометричних визначень?
- •29. У якому середовищі і чому проводять визначення загальної твердості води Fe(III), окремого вмісту Ca(II) та Mg(II)?
- •40-41. Комплексонометричне визначення іонів Ca у грунтах і донних відкладах (Комплексонометричне визначення іонів Mg у грунтах і донних відкладах)
К/р №1
1. За переважним вмістом того чи іншого аніону природні води ділять на 3 класи (класифікація О.О. Алекіна): • гідрокарбонатні води (здебільшого поверхневі води – води річок, озер); • хлоридні води (води океанів, морів, солоних озер); • сульфатні води (деякі колодязні води). Кожен клас підрозділяють на три групи по переважному катіону (кальцієва, магнієва і натрієва групи).Групи в свою чергу поділяються на типи у відповідності до кількісних характеристик аніонів і катіонів.
2. Хімічні інгредієнти природних вод поділяються на п’ять основних груп: 1) Розчинені гази – О2, СО2, H2S, СН4 тощо. 2) Головні йони (cольові компоненти) – НСО3 - , СО3 2- , Сl- , SO4 2- , Na+ , K + , Mg2+, Ca2+ . 3) Біогенні сполуки – NH4 + -, NO2 – -, NO3 – -йони, азот органічний (Nорг), фосфати та поліфосфати, фосфор органічний (Рорг), силікати, ферум (II,III). 4) Мікроелементи – Mn, Cu, Zn, Co, Mo (біоелементи), Ni, Cr, Cd, Pb, Hg, F та інші компоненти (неорганічні промислові забруднювачі). 5) Органічні речовини - білки, аміни, амінокислоти, карбонові та оксикарбонові кислоти, складні ефіри, гумусові та фульвокислоти, вуглеводні, жири, карбонільні сполуки, спирти, нафтопродукти, пестициди, синтетичні поверхнево-активні речовини (СПАР) та інші органічні сполуки природного та антропогенного походження.
3. Інтегральні показники якості води зумовлені наявністю в ній багатьох речовин, як органічних, так і неорганічних, розчинених або у вигляді зависей чи колоїдів. До інтегральних показників відносяться запах, смак, каламутність (прозорість), кольоровість, окисно-відновний потенціал, окисність (перманганатна чи дихроматна), швидкість поглинання кисню, загальний вміст азоту та фосфору, органічний вуглець, твердість, буферна місткість (кислотність і лужність) тощо.
Смак і запах залежать від вмісту і складу розчинених неорганічних і органічних речовин. Якісна вода не повинна мати запаху. Запахи можуть бути природного (болотистий, торф’яний, рибний) і штучного (хлорний, залізистий) походження. Запахи води тісно пов'язані зі смаком. Розрізняють чотири основні смаки: солоний, гіркий, кислий, солодкий. Всі інші смакові відчуття називаються присмаками (хлорний, рибний, металевий тощо). Кількісну оцінку запаху, смаку і присмаку води проводять за п’ятибальною шкалою, згідно з ГОСТ 3351-74.
Кольоровість, яка зумовлена, головним чином, розчиненими гуміновими речо- винами та сполуками заліза. Вимірюється в градусах за стандартною дихроматно- кобальтовою шкалою, згідно з ГОСТ 3351-74.
Каламутність природних вод викликана присутністю тонко дисперсних домішок, зумовлених нерозчинними або колоїдними неорганічними й органічними речовинами різноманітного походження. Її визначають турбідиметрично.
4. Індивідуальні показники якості води характеризують конкретний вміст окремих речовин (наприклад, летких фенолів, гумінових кислот, діоксиду вугле- цю, сірководню тощо) або іонів (наприклад, Ca2+, Mg2+, Fe2+, Fe3+, Cl-, SO42-, NO3- ,F- ,HCO3- тощо) у воді.
- Головними джерелами надходження Кальцію в поверхневі води є процеси хімічного вивітрювання і розчинення мінералів, насамперед вапняків, доломітів, гіпсу, що містять кальцій, силікати й інші осадові і метаморфічні породи. Процес розчинення відбувається за схемою:
CaCO3 + CO2 + H2O ↔ Са(HCO3)2 ↔ Ca2+ + 2HCO3-
- Значні кількості Магнію можуть надходити у водяні об'єкти зі стічними водами металургійних, силікатних, текстильних та інших підприємств. У річкових водах вміст магнію звичайно коливається від декількох одиниць до десятків міліграмів у 1 дм3 .
5. Впливу речовин, що заважають аналізу, можна позбутися різними методами. Найбільш зручним є спосіб маскування, що використовується в основному при визначенні йонів металів оптичними або електрохімічними методами. Для цього йони, що заважають аналізу, зв'язують в стійкі комплексні сполуки, які не дають аналітичного сигналу, властивого визначуваному металу. Для дотримання цих умов потрібно, щоб константа стійкості комплексної сполуки визначуваного йона з маскуючим реагентом була значно меншою від константи стійкості йона, що заважає аналізу, з цим же реагентом. Використовують методи «мокрого спалювання», фотохімічної деструкції органічних речовин. Для «мокрого спалювання» використовують кислоти особливої чистоти, в яких вміст важких металів незначний. При аналізі профільтрованої природної води доцільно використовувати спосіб фотохімічної деструкції органічних речовин. При визначенні у природних водах органічних сполук їх при необхідності відокремлюють від компонентів, що заважають аналізу, і концентрують екстракційним або сорбційним методом.
6. Пробовідбір – важливий етап аналізу об’єктів навколишнього середовища і від правильності його проведення, у значній мірі, залежать результати аналізу. Проби води можуть бути простими та змішаними. Прості проби одержують одноразовим відбором такого об'єму води, який необхідний для аналізу. Змішані проби являють собою суміш простих проб, які відібрані одночасно в різних місцях досліджуваного водного об'єкта або в одному місці через різні проміжки часу. Змішану пробу, не рекомендується відбирати за період більший ніж за одну добу. Відбір проб води може бути одноразовим (нерегулярним) або серійним (регулярним). Найбільш поширені варіанти серійного відбору проб води такі: - зональний відбір, відбір проб через певні проміжки часу, - погоджені проби, які відбирають в різних місцях за течією річки. При відборі проб використовують посуд з безбарвного скла або поліетилену тих марок, які дозволені для контакту з питною водою. Посуд повинен бути ретельно вимитим миючими засобами, багаторазово промитий водопровідною водою, а безпосередньо перед забором води посуд декілька разів ополіскують досліджуваною водою. Корок бажано 66 використовувати скляний або поліетиленовий, гумові корки обгортають поліетиленовою плівкою.
7. Консервація проб води має на меті зберегти їх фізичні властивості та хімічний склад в такому стані, в якому вони були у момент відбору проби. Консервацію проводять у тих випадках, коли немає можливості виконати аналіз на місці відбору. Універсального методу консервації природних вод немає, тому часто для визначення різних інгредієнтів відбирають окремі проби води і по-різному їх консервують. Найбільш поширеними консервантами води є такі: - 1 см3 концентрованої сульфатної кислоти на 1 дм3 води; - 5 см3 концентрованої нітратної кислоти на 1 дм3 води; - 2 - 4 см3 хлороформу на 1 дм3 води. Для транспортування проби води відбирають у скляний або поліетиленовий посуд з пробками і герметично закривають. Треба стежити за тим, щоб під пробкою не залишалися пухирці повітря. Проби води бажано зберігати в холодильнику при температурі З-4°С. Аналізувати проби починають після того, як їх температура зрівняється з кімнатною.
8. Концентрування мікродомішок неорганічних та органічних сполук доцільно проводити після попереднього фільтрування води або центрифугування, для того щоб позбутися нерозчинних сполук. Для концентрування мікрокомпонентів використовують дві групи методів. До першої з них належать випарювання та виморожування, які призводять до зменшення загального об'єму проби води і, як наслідок, до збільшення концентрації всіх інгредієнтів. При випарюванні проби води з неї можуть виділятись не тільки осади сольових компонентів, але також відганятись леткі органічні сполуки. Метод виморожування з метою концентрування меншою мірою впливає на хімічний склад проби води. Виморожувати воду можна в холодильнику, але більш зручним і швидким є спосіб з використанням установки. До другої групи належать методи концентрування, які ґрунтуються на екстракції, сорбції, співосадженні або електрохімічному виділенні мікрокомпонентів без зміни загального об'єму проби води. Ці методи дозволяють не тільки концентрувати мікро-компоненти, але також відокремлювати їх від матриці та речовин, що заважають аналізу, тому вони є більш ефективними в порівнянні з випарюванням або виморожуванням.
9. Характеристика хімічного складу твердої фази грунтів.
Тверда фаза грунтів - це полідисперсна і полікомпонентна органо-мінеральна система, що утворює твердий каркас грунтового матеріалу. Вона формується у процесі ґрунтоутворення з материнської гірської породи і в значній мірі успадковує її склад та властивості. Характеризується гранулометричним і хімічним мінералогічним складом, з одного боку, та структурою, щільністю і пористістю – з іншого. Мінеральна частина становить 90-99% маси твердої фази грунтів і мас складний мінералогічний і хімічний склад. Основну частку хімічного мінералогічного складу грунтів складають первинні (переважно кварц, польові шпати, слюди), а також вторинні мінерали (глинисті, оксиди і гідроксиди алюмінію, феруму, силіцію, мінерали-солі). З первинних мінералів найбільш поширеним у грунті є кварц (SiO2). Вміст його в усіх грунтах перевищує 60%. а в легких піщаних досягає 90% і більше. Із первинних алюмосилікатних мінералів у грунті широко поширені калієві та натрій-калієві польові шпати, меншою мірою - калійна і залізисто-магнезіальні слюди. Вторинні, або глинисті, мінерали утворюються при зміні польових шпатів і слюд у процесі вивітрювання і грунтоутворення та складаються переважно з силіцію, алюмінію, оксигену, гідрогену, а також містять невелику кількість феруму, кальцію, магнію, та калію. Вони знаходяться в грунті головним чином у вигляді дрібнодисперсних мулистих та колоїдних частинок (<0.001 мм). У твердій фазі грунту завжди присутні в порівняно невеликій кількості важкорозчинні солі фосфатної кислоти (фосфати кальцію, магнію, феруму та алюмінію), а в окремих грунтах може бути значна кількість малорозчинних карбонатів кальцію, магнію і сульфату кальцію. Органічна речовина грунту становить невелику частину твердої фази (від 1-3% у підзолистих грунтах і сіроземах до 8-10% і більше в потужних чорноземах) та складається з живої біомаси, органічних решток рослин, тварин, мікроорганізмів, продуктів їх метаболізму (в цілому 10-15%), а також специфічних новоутворень органічних речовин - гумусу (90-85%).
10. Характеристика рідинної фази грунтів. Рідка фаза грунтів представляє собою водний розчин, який умовно можна поділити на дві частини - «вільну» водну зону та грунтовий розчин, який займає систему пор, що міститься між агрегованими часточками грунту. Першій належить досить значна роль у ґрунтоутворенні: перерозподіл речовин у грунтовому профілі; вода в грунті визначає в значній мірі тепловий баланс грунту та його температурний режим; забезпечує умови життя рослин; відповідає за транспортування розчинів речовин і самої води у грунті. Друга частина рідкої фази грунтів -грунтовий розчин - включає воду, що містить розчинені солі, органо-мінеральні та органічні сполуки, розчинені гази (вуглекислий газ, кисень, аміак та ін.) та найтонші колоїдні золі і служить безпосереднім джерелом живлення рослин. До найважливіших катіонів грунтового розчину відносяться: Са2+ , Mg2+, Na+, K+, NH4+, H+ ; в сильно кислих грунтах можуть бути Al3+, Fe3+, у заболочених – Fe2+ у вигляді катіонів і гідратів полуторних оксидів у колоїдно-розчинній формі. Серед аніонів переважають: НСО3¯ , СО32¯ , NO3 ¯ , NО2¯ , SO42¯ , СІ¯, Н2РО4¯, НРО42¯.Для більшості грунтів характерний гідрокарбонатно-кальцієвий склад грунтових розчинів концентрація яких невелика і коливається від десятих часток грама до кількох грамів речовин на літр. У грунтових розчинах засолених грунтів переважна частка належить хлоридам і сульфатам магнію та натрію. Концентрація розчинених речовин у таких грунтах досягає десятків, а іноді й сотень грамів на літр.
Поряд з концентрацією грунтового розчину важливими характеристиками його є кисла чи лужна реакція та осмотичний тиск грунтового розчину. Кисла чи лужна (активна) реакція грунтового розчину обумовлена присутністю у розчині вільних кислот, основ, кислих та основних солей. Визначається активністю вільних іонів Н+ та ОН¯ , вимірюється величиною pH. У різних типах грунтів pH грунтового розчину коливається від 2,5 (кислі сульфатні грунти) до 6 - 7,5 у чорноземах і до 10 - 11 у лужних солонцях та содових солончаках. Осмотичний тиск грунтового розчину залежить від його концентрації та ступеня дисоціації розчинених речовин. Від величини осмотичного тиску у грунтовому розчині залежить поглинання води рослинами що значною мірою впливає на їх життєздатність. Концентрація солей і осмотичний тиск грунтового розчину залежать від вологості грунту і є досить динамічними величинами.
11. Поняття «атмосфера грунту». Її особливості та хімічний склад.
Газоподібна фаза ґрунту - це ґрунтове повітря, що знаходиться між частинками ґрунту у великих некапілярних порах. Його склад відрізняється від атмосферного підвищеним вмістом вуглекислого газу - 0,1 - 10% (в атмосферному 0,03%), азоту - до 80,2% (в атмосферному 78,08%), присутністю аміаку, сірководню, зниженим вмістом кисню - до 10% (в атмосферному повітрі 21%). Склад ґрунтового повітря залежить від твердої фази ґрунту, вмісту води, життєдіяльності ґрунтових організмів тощо. Газова фаза грунтів може розглядатися як атмосфера грунту, де знаходяться найбільш леткі органічні та неорганічні сполуки у вигляді пари в порах грунту. Газова фаза грунту за своїм складом подібна до атмосфери, яка міститься над грунтом. Обєм газової фази грунту обумовлюється пористістю грунту та вмістом вологи в ньому. В атмосфері грунту присутні основні атмосферні гази СО2, N2, O2. Кількість вуглекислого газу в грунтовому повітрі приблизно в 8 разів вища, ніж в повітрі над грунтом. Оксиди азоту також можуть бути в складі газової фази. Однак, внаслідок високої реакційної здатності оксидів азоту з хімічними та біологічними речовинами, вони довго в грунті не затримуються. Як правило, вміст кисню в аеробних грунтах - біля 20% газової фази, а СО2 - між 1 та 2%. З другого боку, вміст СО2 може досягати 10% для грунтів з високим вмістом вологи. Склад атмосфери грунтів залежить від культивації грунту і від розчинення летких сполук в грунтовій воді. Він змінюється з глибиною і місцем відбору грунту. Розчинність газів у воді залежить від типу газу, температури, концентрації солей, парціального тиску газів в атмосфері. Найбільш розчинні та іонізовані у воді гази - це СО2, NH3 та H2S. Кисень та азот - найменш розчинні гази. Повітряний режим ґрунту - це сукупність усіх явищ надходження повітря в ґрунт, його переміщення і витрачання, обмін газами між ґрунтом, атмосферою, твердою і рідкою фазами ґрунту та виділення газів живими ґрунтовими організмами. Оптимальний повітряний режим ґрунту необхідний для вирощування високих врожаїв сільськогосподарських культур, так як повітря необхідне для дихання коріння рослин, мікроорганізмів, грибів, водоростей, червів та інших ґрунтових організмів. Найсприятливіші умови для росту сільськогосподарських рослин складаються за 50-60% пористості ґрунту та за умови, що 60% пор заповнені водою, а 40% - повітрям.
Повітряний режим ґрунту регулюється за допомогою механічного обробітку, внесенням органічних добрив, відведенням надлишкової кількості води, вирощуванням багаторічних трав, тобто заходів, спрямованих на покращення структури ґрунту.
12.Хімічний склад донних відкладів природних водних об’єктів.
Головні компоненти це - SIO2, AI2O3 трохи CаCO3, Fe, Zn, Cu та Sr, а решта ораніка.
13 .Характеристика мінеральної частини грунтів
Грунт майже на 90% представлений мінеральними елементарними грунтовими частинками (ЕГЧ), а тому його валовий хімічний склад обумовлений в основному складом і кількісним співвідношенням мінералів. Серед основних мінералів тверду фракцію складають кварц і польові шпати, а дрібнодисперсну - глинисті алюмосилікати. Відповідно до цього, у валовому хімічному складі грунтів переважають оксиген і силіцій, менше алюмінію, мало феруму, титану, кальцію та натрію, інші елементи - у мікрокількостях. З органічних компонентів до валового складу грунтів входять органічний карбон та органічний нітроген. Хімічний склад грунтів виражають через процентний вміст оксидів елементів , віднесений до повітряно-сухої проби. Хімічний склад грунтів варіює з глибиною і залежить від напрямку та інтенсивності прояву ґрунтотворних процесів. Поряд із перерахованими макроелементами, в грунті у невеликих кількостіх (від сотих до тисячних часток відсотка) присутні розсіяні елементи і мікроелементи.
14.Складові, що характеризують біологічну цінність грунтів.
• обмінна поглинальна здатність за іонами Са2+, Mg2+, Na+ та Н+ вказує на рівень забезпеченості грунту елементами, так званого, зольного живлення рослин. Вона змінюється в широких межах для грунтів різних типів і виражається в ммоль-екв/100 г грунту;
• мікроелементи. Найбільш важливими для розвитку рослин є бор, манган, купрум, цинк, кобальт та молібден вміст яких змінюється в досить широких межах: від 0,2 до 5000 мг/ кг;
• біогенні елементи доступні для рослин, такі як МН4+, №їз, N02 , РО43 , КГ та амінокислоти;
• воскосмоли, гумінові та фульвокислоти.
Під впливом господарської діяльності людини до хімічного складу грунтів входять численні неорганічні та органічні сполуки антропогенного походження. Вони потрапляють до грунтів зі стічними водами промислових підприємств, сільськогосподарських комплексів, з комунально-побутовими стоками, з органо-мінеральними добривами. Атмосферні опади у вигляді кислотних дощів потрапляючи до поверхні грунту насичують його агресивними сульфатною, нітратною, хлоридною кислотами. В результаті сорбційної та фільтраційної здатності грунти в значних кількостях акумулюють токсичні речовини-забруднювачі, такі як нафтопродукти, пестициди, сполуки важких металів, синтетичні миючі засоби тощо. Велику небезпеку для біосфери і зокрема для хімічного складу грунтів представляють радіонукліди, які можуть потрапляти до грунтів внаслідок аварій на підприємствах ядерної енергетики. Показником забруднення екосистем є донні відклади внаслідок їх високої сорбційної здатності. Наприклад, зі стоками електрохімічних виробництв до них потрапляють ртуть, кадмій хром та інші токсичні метали. Донні відклади річок, водоймищ, озер часто забруднені консервативними органічними сполуками, які є у стічних водах підприємств органічного синтезу, наприклад, фосфорорганічними та хлорорганічними пестицидами. Вміст мікроелементів (металів) у донних відкладах дещо вищий, ніж у грунтах цього ж географічного району. Загалом хімічний склад донних відкладів природних водних об'єктів близький до хімічного складу грунтів. Близький не тільки за основними компонентами та мікроелементами, а також і за іншими складовами. Тому у більшості випадків аналіз грунтів та донних відкладів виконують однаковими методами.
15.Хімічний склад повітря та атмосферних опадів
Головними складовими частинами повітря (біля земної поверхні) є азот — 78,08 % об'єму, кисень — 20,96 % об'єму та інертні гази — 0,94 % об'єму, у тому числі аргон — близько 0,9 % об'єму. Кількість цих газів у повітрі не змінюється, тому їх називають постійними складовими частинами повітря. До складу повітря входять також: діоксид вуглецю CO2 (вуглекислий газ) — близько 0,03 % об'єму і водяна пара 0,1—2,8 % об'єму. Однак їхня кількість залежно від умов може сильно змінюватись, тому їх називають змінними складовими частинами повітря. Крім того, в повітрі можуть бути різні випадкові домішки, наприклад водень H2, аміак NH3, озон O3, сірководень H2S, метан CH4, діоксид сірки SO2 (сульфітний ангідрид) та інші гази, які потрапляють у повітря внаслідок гниття органічних залишків, виверження вулканів, роботи хімічних заводів тощо. Серед випадкових домішок у повітрі також нерідко зустрічаються найдрібніші частинки сажі й мінеральних речовин, а також різні мікроорганізми. Хімічний склад атмосферних опадів, незважаючи на нестабільність, у цілому відображає характерні риси місцевості і тип її ландшафту. Мінералізація атмосферних опадів, як звичайно, нижча, ніж мінералізація поверхневих і підземних вод. Загалом на території України щорічно з атмосферними опадами випадає 7,3 млн т розчинених мінеральних речовин. Кількість надходження розчинених мінеральних речовин у розрахунку на 1 км2 (модуль надходження розчинених мінеральних речовин) становить 12,1 т. Джерелом небезпечних хімічних компонентів в атмосферних опадах є аерозолі атмосфери, або, як їх інакше називають, – ядра конденсації. Аерозолі – це пилоподібні мінеральні частинки кори звітрювання, частинки диму, органічні речовини різного складу, найдрібніші організми та їхні залишки (спори, пилок рослин, мікроби), а також різноманітні техногенні тверді забруднювачі атмосфери. В разі поєднання з практично дистильованою атмосферною вологою тверді частки мають здатність передавати свої хімічні властивості воді або вступати в хімічну реакцію з вологою. Наприклад, у випадку конденсування атмосферної вологи на частках NO, NO2, SO2 утворюються розчини азотної, азотистої та сірчаної кислот, відповідно. Випадіння таких опадів називають кислотними дощами.
16.Класифікація хімічних компонентів грунтів та донних відкладів з точки зору аналітичних визначень.
17. Хімічні інгредієнти, які входять по складу ґрунтів та донних викладів (з точки зору їх аналітичного визначення) можна поділити на три групи. До першої групи належать компоненти, які становлять основну мінеральну частину цих об'єктів, а також карбон та нітроген органічних сполук. Для їх визначення тверду пробу треба повністю перевести у розчин.
Мінеральна (тверда) частина грунту зазвичай складає до 90-97% маси грунту. Відбір ґрунтових зразків для аналізу проводять після описування морфологічних ознак ґрунту в розрізах.
18.
19. У нормальних природних умовах усі процеси, які відбуваються в ґрунті, знаходяться в рівновазі. Основним фактором порушення рівноваги стану ґрунту є антропогенний. У результаті розвитку господарської діяльності людини відбувається ерозія, дефляція, заболочування, засолення і забруднення ґрунтів.
20. Для правильної санітарної оцінки ґрунту слід попередньо обстежити або зібрати дані про топографічні умови та геологічний склад ґрунту на ділянці, звідки забирають проби для дослідження.
Методика відбору проб ґрунту й характер досліджень залежать від мети досліджень. Для фізико-хімічного аналізу проби ґрунту можна відбирати з ділянки площею 25 м2 за способом "конверта", тобто в п'яти точках (одна в центрі й чотири по кутах) або по діагоналі. Звичайно для санітарного аналізу ґрунт забирають на глибині не більше 25 см, а якщо необхідно — на глибині 0,75-1,75-2,0 м. Проби забирають лопатами або свердлами різної конструкції (мал. 46). Проби з поверхні ґрунту і з невеликої глибини забирають знезараженими лопатками та ложечками.
Відібрані за сухої погоди з різних шарів ґрунту проби вміщують у чисті скляні банки з притертими корками, брезентові або поліетиленові пакети. На кожну пробу наклеюють етикетку, зазначивши місце та час відбору. Далі складають супровідний документ, у якому вказують місце, час відбору проб, глибину, метеорологічні умови в момент відбору, прізвище та посаду особи, яка здійснила відбір, а також місце відправлення і показники, які визначаються. Для санітарного аналізу потрібно 1-2 кг ґрунту.
21. Середня проба – готується з генеральної проби висушуванням на повітрі,д ля цього ґрунт насипають тонким шаром (1-2 см) на чистий папір, Для прискорення сушки ґрунт декілька разів перемішують. Приблизно через 3-4 дні ґрунт досягає повітряно-сухого стану, грудки розтирають у ступці, просіюють крізь сито діаметром 1мм. Способом квартування пробу усереднюють до 100-200г. Для цього ретельно перемішану пробу розміщують на чистому папері у вигляді квадрата і шпателем ділять по діагоналі на чотири рівні частини. Дві протилежні частини об'єднують і з них відбирають проби для аналізу.
Лабораторну пробу – квартуть до маси 10-12г
22. У повітряному басейні перебуває багато неорганічних та органічних сполук антропогенного та природного походження в газуватому і паруватому стані та у вигляді рідких та твердих аерозолей.
Відбір проб повітря вважається одним з найскладніших. При цьому використовуються спеціальні поглинальні посудини: балони, бутлі, шприци та газові піпетки, а також гумові камери. Дана методика відбору проб повітря є дуже чутливою і точною.
23. підготовка проби повітря для аналізу полягає в тому, що при наявності твердих аерозолів їх відокремлюють за допомогою фільтрів, на яких парогазуваті речовини не затримуються. При відсутності в повітрі твердих аерозолів пробу без фільтрування вносять безпосередньо у камеру-випарник газового хроматографа.
24. Основні етапи аналізу. Аналіз ґрунтів та донних відкладів включає такі основні етапи:
- визначення валового складу, катіонообмінної (поглинальної) ємності, доступних для рослин форм Нітрогену, Фосфору та Калію (NPK), мікроелементів, рухомих форм силіцієвої кислоти та полуторних оксидів, аналіз водної витяжки і визначення антропогенних забруднювачів. Валовий аналіз включає комплекс визначень, які дають змогу встановити елементарний склад ґрунтів та донних відкладів, тобто загальний вміст в них хімічних елементів. До цієї групи показників входить також гігроскопічна вода.
- Катіонообмінна (поглинальна) здатність ґрунтів та донних відкладів відіграє важливу роль у кореневому живленні рослин. Вона включає визначення обмінних катіонів, ємності поглинання, солонцюватості та кислотності.
- Групу мікроелементів, які найбільш часто визначають у ґрунтах та донних відкладах, складають такі біометали, як манган, мідь, цинк, кобальт, молібден, а також бор. Залежно від цілей дослідження аналіз проводять на загальний вміст мікроелементів після повного розчинення проби або на вміст рухомих, доступних для рослин форм елементів у кислотних або буферних витяжках.
- Антропогенні забруднювачі визначають у пробах ґрунтів, які відбираються в районах промислових, сільськогосподарських, комунально-побутових та транспортних джерел забруднення, донні відклади – в місцях скидання стічних, дренажних вод. Найбільш розповсюдженими антропогенними забруднювачами ґрунтів і донних відкладів є сполуки марганцю; міді, нікелю, цинку, хрому, свинцю і ртуті, сульфати, фосфати, нітрати і фториди, а також бензин, пестициди, синтетичні поверхнево-активні речовини, добрива, якщо їх кількість перевищує агротехнічні норми. Останніми роками виникла потреба визначати в ґрунтах і донних відкладах радіонуклідів цезію, стронцію й інших елементів
37. Під лужністю природних або очищених вод розуміють спроможність деяких їхніх компонентів зв'язувати еквівалентну кількість сильних кислот. Лужність обумовлена наявністю у воді аніонів слабких кислот (карбонатів, гідрокарбонатів силікатів, боратів, сульфітів, гідросульфітом, сульфідів, гідросульфідів, аніонів гумінових кислот, фосфатів). Їх сума називається загальною лужністю.
Визначення вільної лужності100 мл аналізованої природної води титрувати 0,1н HCl з індикатором фенолфталеїн. Оскільки перехід забарвлення кілька згладжений, титрувати слід на білому фоні, порівнюючи забарвлення з перетітрованной пробій.Результат прийнято виражати в мг-екв / л.
Визначення загальної лужності100 мл аналізованої природної води титрування 0,1н HCl з індикатором метиловий оранжевий до переходу забарвлення із жовтого на помаранчеву. Після переходу забарвлення слід почати продувати через пробу повітря протягом 2-3 хвилин. Якщо після цього забарвлення змінилася, то необхідно продовжити титрування. Результат прийнято виражати в мг-екв / л.
45. Для встановлення точки еквівалентності в методи нейтралізації використовують кислотно-основні індикатори, які за своєю природою є слабкими органічними кислотами або основами.


46. Загальна кислотність визначається кількістю титруватирозчину сильної основи (мг-екв / л), яке необхідне для повної нейтралізації досліджуваного розчину по досягненні pH 8,3. Якщо досліджуваний розчин (вода) має рН> 8,3, то кислотність приймається рівною нулю. Кислотність води визначають титруванням проби досліджуваної води стандартним розчином гідроксиду або карбонату натрію. Точка еквівалентності, відповідна закінченню реакції нейтралізації, визначається візуально по зміні забарвлення індикатора. При визначенні вільної кислотності застосовується індикатор метиловий оранжевий, а загальної кислотності - фенолфталеїн. Досягнення точки еквівалентності при взаємодії підстави з сильними кислотами може бути зафіксовано будь-яким з кислотно-лужних індикаторів, що мають інтервал переходу забарвлення від 4 до 9, оскільки вже від однієї зайвої краплі підстави при титруванні досліджуваного розчину різко зростає pH. Активна реакція середовища розчину після закінчення реакції буде нейтральною, оскільки утворюється сіль не піддається гідролізу. При проведенні реакції нейтралізації слабкої кислоти сильною основою активна реакція середовища розчину в точці еквівалентності буде лужний, так як утворюється сіль піддається гідролізу. При проведенні реакції нейтралізації в присутності індикатора фенолфталеїну в точці еквівалентності (pH 8,3) можуть утворюватися не тільки середні, а й кислі солі. Так, при визначенні загальної кислотності природних вод, кислотність яких зумовлена вільною вугільною кислотою, реакція нейтралізації гідроксидом натрію закінчується утворенням бікарбонату натрію С02-ЬМа0Нч а ИаНС0з.
47.Визначення вмісту «загального нітрогену» у природних водах (шляхи надходження нітрогену у природні води, форми його існування, способи зберігання проб води для аналізу, суть визначення).


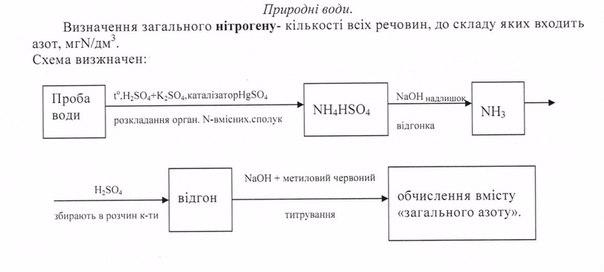
48.Визначення
вмісту «загального нітрогену» у грунтах
та донних відкладах (поняття «загальний
нітроген», підготовка проби грунту до
аналізу, суть визначення).



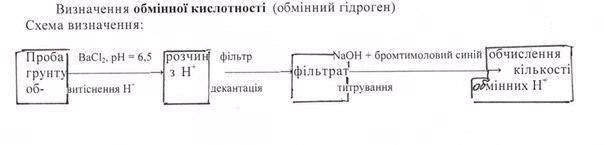
49.



5.Визначення
обмінної кислотн ості
грунтів та донних відкладів.
ості
грунтів та донних відкладів.
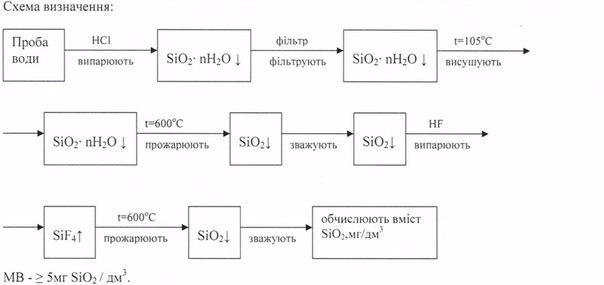
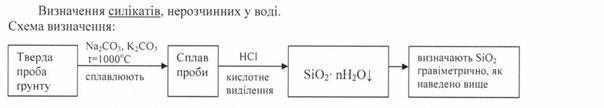
51.Підготовка проби ґрунту для гравіметричного визначення силікатів, нерозчинних у воді.




Кр№2
1.Арбітражний метод визначення ХСК природних вод…Відбір проб води може бути одноразовим (нерегулярним) або серійним (регулярним). Одноразовий відбір використовують в основному тільки при аналізах глибинних підземних вод, хімічний склад яких є досить сталим у часі, просторі та глибині. Одноразовий відбір використовують також для періодичного контролю якості води природного водного об'єкта, для раніше були вивчені закономірності зміни концентрацій визначуваних інгредієнтів і мета аналізу полягає лише у виявленні можливих відхилень від встановлених закономірностей. Надійну та достовірну інформацію про хімічний склад природних вод одержують при серійному відборі проб, які узгоджуються між собою з урахуванням місця та часу відбору. Найбільш поширені варіанти серійного відбору проб води такі: - зональний відбір, при якому проби води відбирають за певною схемою та з різних глибин у різних місцях водного об'єкта. Аналіз таких проб дає змогу виявити закономірності зміни хімічного складу води у просторі;відбір проб через певні проміжки часу, зокрема, сезони, декади,доби та години з метою з'ясування зміни якості води з часом;- погоджені проби, які відбирають в різних місцях за течією річки або стічних вод з урахуванням часу проходження води від одного пункту до другого. На підставі аналізу таких проб можна оцінити напрямок та інтенсивність перебігу фізичних, фізико-хімічних та біологічних процесів, які спричиняють зміну хімічного складу води. Ці процеси можуть призводити до так званого самоочищення або самозабруднення природних вод. Необхідний об'єм проби води для аналізу розраховують, виходячи з кількості визначуваних інгредієнтів, чутливості обраних методів аналізу та особливостей підготовки проби для аналізу. Так, для визначення основних неорганічних інгредієнтів та деяких показників органічної речовини (ХСК, С орг., Nорг.) для трьох повторів досить мати 1,5 – 2 л проби води. Однак для повного хімічного аналізу, особливо для визначення вмісту неорганічних та органічних мікрокомпонентів, об'єм проби води повинен бути значно більшим.
3.3. Підготовка води до аналізу Для одержання достовірних результатів аналіз необхідно проводити якомога швидше. У воді відбуваються процеси окиснення- відновлення,фізико-хімічні, біохімічні, викликані діяльністю мікроорганізмів, сорбції, десорбції, седиментації тощо. Можуть змінюватися і органолептичні властивості води – запах, колір тощо. Деякі сполуки або йони окремих елементів здатні адсорбуватися на стінках посуду (Ферум, Алюміній, Купрум, Кадмій, Манган), а зі скла бутлів можуть вилуговуватися мікроелементи. Якщо неможливо дослідити воду встановлені для відповідних показників терміни її охолоджують або консервують.
Після відбору проби іде її підготовка до аналізу, яка відбувається у декілька стадій:
- консервація, транспортування та зберігання проб води;
- визначення хімічних інгредієнтів у розчиненому стані, колоїдно-дисперсній формі та зависях;
- концентрування мікрокомпонентів;
- усунення речовин, що заважають аналізу.
Найбільш поширеними консервантами води є такі:
- 1 см3 концентрованої сульфатної кислоти на 1 дм3 води;
- 5 см3 концентрованої нітратної кислоти на 1 дм3 води;
- 2 - 4 см3 хлороформу на 1 дм3 води.
3.7. Усунення речовин, що заважають аналізу. Впливу речовин, що заважають аналізу, можна позбутися різними методами. Найбільш зручним є спосіб маскування, що використовується в основному при визначенні йонів металів оптичними або електрохімічними методами. Для цього йони, що заважають аналізу, зв'язують в стійкі комплексні сполуки, які не дають аналітичного сигналу, властивого визначуваному металу. У той же час доданий до розчину комплексоутворювальний реагент не повинен впливати на вимірюваний аналітичний сигнал, тобто не повинен практично зв'язувати визначуваний йон. Для дотримання цих умов потрібно, щоб константа стійкості комплексної сполуки визначуваного йона з маскуючим реагентом була значно меншою від константи стійкості йона, що заважає аналізу, з цим же реагентом. При аналізі природних вод таких умов досягти важко через що у водах завжди присутні неорганічні та органічні комплексоутворюючі сполуки, вилив яких на йони, що визначаються та заважають, врахувати практично неможливо. Тому для маскування тих йонів, що заважають аналізу, при можливості їх переводять у такий ступінь окислення, в якому вони не заважають аналізу, руйнують комплекси або попередньо відокремлюють йони металів екстракційним, сорбційним чи електрохімічним методами. У випадку, коли йони металів визначають у досить кислому розчині у вигляді стійких забарвлених комплексів, наприклад, при визначенні загального вмісту феруму у вигляді його комплексу з о-фенатроліном (Phen), зв'язування феруму в комплексні сполуки з природними лігандами води в більшості випадків не заважає аналізу. Визначенню загальної концентрації йонів металів особливо заважають органічні високомолекулярні сполуки, які утворюють з йонами металів кінетично інертні стійкі комплекси, що маскують елементи, які необхідно визначати. Через те перед визначенням металів ці комплекси треба зруйнувати, тобто знешкодити вплив розчинених органічних. сполук. Використовують методи «мокрого спалювання», фотохімічної деструкції органічних речовин Для, яке полягає в окисленні органічних речовин природних вод, пробу води підкислюють сумішшю концентрованої сульфатної та нітратної кислот у співвідношенні 1:1 і випарюють до появи густих парів сульфатної кислоти. Після цього розбавляють дистильованою водою, додають розчин калій тетраоксоманганату і кип'ятять 3-5 хв. Якщо розчин став безбарвним, тоді ще додають калій тетраоксоманганат і знову кип'ятять. Залишок калій тетраоксоманганат розкладають кип'ятінням з хлоридною кислотою або додаванням по краплинах розведеного розчину оксалатної кислоти до знебарвленого розчину. Для «мокрого спалювання» використовують кислоти особливої чистоти, в яких вміст важких металів незначний.
2.Для визначення ХСК природних вод запропоновано багато методів, які відрізняються природою окисника та умовами проведення. Розрізняють перманганатний, йодатний, дихроматний, церієвий методи. Максимальний ступінь окислення органічних речовин досягається при застосуванні дихроматного та йодатного методів. Найбільш поширеним для визначення ХСК як природних, так і стічних вод є дихроматний метод, в якому окислення органічних речовин проводиться сумішшю K2Cr2O7 + H2SO4 в присутності каталізатора Ag2SO4 при кип’ятінні:
3С+2K2Сr2O7 +8H2SO4 = 2Cr2(SO4)3 + 2K2SO4 + 3CO2 +8H2O
Пірол, піридин і його гомологи, нафталін, нікотинова кислота та інші азотвмісні вуглеводні дихроматом не окислюються або окислюються повільно. Надлишок дихромату титрують розчином солі Мора (Fe(NH4)2(SO4)2•6H2O) в присутності фенілантранілової кислоти як окисно-відновного індикатора
Сr2O72– + 6Fe2+ + 14H+ ↔ 2Cr3+ + 6Fe3+ + 7H2O оранжевий зелений
Фенілантранілова кислота:Безбарвна Червоно-фіолетова Еº = +1,08 в. Тип консервації природної води. Для аналізу відбирають пробу природної води, консервовану 2 мл сульфатної кислоти (1 : 2) на 100 мл води. Заважаючі речовини:Хлорид-іони в умовах реакції окислюються до Cl2, тому його маскують HgSO4:
Hg2+ + 2Cl- = HgCl2↓
Визначенню заважають також NO2- - іони, для їх усунення додають сульфамінову кислоту і кип’ятять пробу води^
H2NSO2OH + HNO2 = N2↑ + H2SO4 + H2O,
H2NSO2OH + H2O = NH4HSO4
Вміст ХСК розраховують за формулою:
ХСК=(V_т∙С_т∙8∙1000)/V_ал ; ХСК=((4,5 мл-4,4мл)∙0,025н∙8∙1000)/(10 мл)=2 мг/л
де Vхол – об’єм солі Мора, що пішов на холостий дослід, мл; Vт – об’єм солі Мора, витрачений на титрування проби досліджуваної води; Vал - об’єм аліквоти,мл; Ст – концентрація солі Мора,н; 8 - еквівалент кисню.
3,4. Сущность метода
Метод основан на окислении веществ, присутствующих в пробе воды 0,1 н раствором перманганата калия в сернокислой среде при кипячении. Перманганат-ион в сильнокислых средах окисляет присутствующие в воде восстановители, восстанавливаясь до двухвалентного марганца:
MnO + 8 H+ + 5e ® Mn2+ + 4 H2O (16)
Избыток перманганата калия восстанавливается щавелевой кислотой:
2 MnO + 5 С2О + 16 H+ + 5e ® Mn2+ + 4 H2O (17)
Не вступившая в реакцию щавелевая кислота оттитровывается перманганатом калия по приведенному выше уравнению.
Условия применимости метода. Метод применим для определения окисляемости питьевых, поверхностных и малозагрязненных сточных вод. Без разбавления можно определять окисляемость до 10 мг кислорода на литр. Наивысшее допустимое разбавление проб - десятикратное. Пробы консервируют добавлением 2 мл разбавленной (1:2) серной кислоты на каждые 100 мл воды. Пробы питьевых вод надо консервировать, если они не могут быть проанализированы в течение 48 часов после их отбора, пробы поверхностных вод надо консервировать, если анализ их будет проводиться позже, чем через 24 часа; пробы сточных вод и сильно загрязненных поверхностных вод можно не консервировать только в том случае, если их будут анализировать в тот же день, через несколько часов после отбора.
Реактивы и оборудование
– серная кислота, разбавленный раствор (Приложение 4);
– щавелевая кислота 0,1 н. и 0,01 н. растворы; основной раствор и рабочий (Приложение 4);
– перманганат калия, 0,1 н. и 0,01 н. растворы; основной и рабочий раствор (Приложение 4);
– плоскодонные колбы для кипячения емкостью от 250 до 300 мл, предназначенные только для определения окисляемости;
– стеклянные шарики или обожженная пемза.
Проведение анализа
Для определения окисляемости в воде неизвестного состава необходимо предварительно проделать качественное определение (ускоренный метод).
Окисляемость х рассчитывают по формуле
х = ![]() ,
,
где V1 - количество раствора KMnO4, истраченного на титрование; Vд - объем KMnO4, необходимый для окисления дистиллированной воды (10 мл); К - поправочный коэффициент нормальности перманганата калия; N - нормальность раствора перманганата калия; W - объем воды, взятой для анализа; 8 - эквивалентная масса кислорода, 1000 - пересчет объема на 1 л.
5.Визначення окисності води. Окисність води — це кількість кисню, необхідна для хімічного окислення органічних та неорганічних речовин, які містяться віл води. Кількість кисню, затрачувана на окислення органічних речовин, що є у воді, незрівнянно більша від затрачуваної на окислення неорганічних речовин води. Отже, окис-ність характеризує ступінь забруднення води органічними речовинами. Принцип пропонованого методу визначення окисності полягає в тому, що перманганат калію в кислому середовищі при кип'ятінні окислює речовини, присутні у воді. Окисність виражається в міліграмах кисню, еквівалентного витраті окислювача на 1 л води.Для визначення окисності у конічну колбу на 250 мл вносять 100 мл досліджуваної води, 5 мл розчину сірчаної кислоти (1:2) і 20 мл 0,01 н. розчину перманганату калію. Колбу накривають покривним склом. Розчин кип'ятять 10 хв. Далі додають 20 мл 0,01 н. розчину щавлевої кислоти і титрують 0,01 н. розчином перманганату калію до появи блідо-рожевого забарвлення. Окисність води обчислюють за формулою де а — кількість розчину перманганату калію, витраченого на титрування досліджуваної води, мл; Ь — кількість робочого розчину перманганату калію, витраченого на титрування дистильованої води (холоста проба), мл; К — поправковий коефіцієнт до титру 0,01 н. розчину перманганату калію; V — об'єм аналізованої проби води, мл; 8 — еквівалент кисню (кількість кисню, що виділяється 1 мл 1 н. розчину перманганату калію, мл).
У тому випадку, якщо при кип'ятінні досліджувана проба води знебарвиться або побуріє, аналіз повторюють, попередньо розвівши її дистильованою водою. Одночасно визначають окисність дистильованої води, використаної для розведення (паралельна проба). Найменшу окисність (1-3 мг/дм3 О) мають глибокі підземні води. Окисність ґрунтових вод 5-15 мг/дм3 О, води відкритих водойм — 7-20 мг/дм3 О.
^ Визначення розчиненого у воді кисню. Розчинений у воді кисень, реагуючи з закисом марганцю, утворює еквівалентну кількість окису марганцю, який у кислому середовищі окислює йодистий калій з виділенням вільного йоду. Кількість йоду визначається титруванням гіпосульфітом натрію.
Воду відбирають у калібровані флакони з притертим корком таким чином, щоб під пробкою не залишалось повітря. На місці забирання до досліджуваної води для фіксації розчиненого у ній кисню додають 2 мл розчину хлориду марганцю. Наповнену реактивом піпетку занурюють на дно склянки, а потім, відкривши піпетку, її повільно виймають. Іншою піпеткою в цю ж склянку таким же чином додають 2 мл розчину їдкого калію з йодидом калію. Склянку щільно закривають пробкою і вміст ретельно збовтують, декілька разів перевертаючи склянку догори дном. У такому вигляді досліджувану пробу води можна транспортувати від місця забирання в лабораторію. Після відстоювання осаду окису марганцю відсмоктують прозору надосадну рідину, а до осаду доливають З мл концентрованої соляної кислоти й перемішують до його розчинення. Виділений йод титрують 0,01 н. розчином гіпосульфіту натрію до отримання блідо-жовтого забарвлення, після чого додають 1-2 мл розчину крохмалю і титрують забарвлений розчин до знебарвлення. Вміст розчиненого кисню (мг/л) обчислюють за формулою де а — об'єм розчину гіпосульфіту, витраченого на титрування, мл; k — поправковий коефіцієнт до нормальності титрованого розчину гіпосульфіту; N — нормальність розчину гіпосульфіту; У, — мі-' сткість каліброваного флакона, мл; V2 — об'єм реактивів, внесених у флакон для фіксації кисню, мл; 8 — еквівалент кисню (кількість кисню (мг), що відповідає 1 мл 1 н. розчину гіпосульфіту). Ступінь насичення води киснем збільшується з підвищенням атмосферного тиску і зниженням температури води. У водоймах з чистою водою кількість розчиненого кисню повинна бути не менше 4 мг/л (Держстандарт 17.1.5.02-80).
6.Йодометрією називають титриметричний метод, в основі якого лежать реакції:
І2 + 2е- → 2І-
2І- - 2е- → І2
Методом йодометрії можна визначати як окисники (вони окиснюють І- до 1°), так і відновники (вони відновлюють йод до 1-).
1. Визначення окисників. Методом йодометрії можна визначати ті окисники, які кількісно окиснюють I- у вільний І2. Частіше за все визначають перманганати, дихроматы, солі купруму (II), солі феруму (III), вільні галогени і ін.
Окиснювач реагує з надміром калій йодиду КІ вкислому середовищі. При цьому виділяється кількість йоду, еквівалентна кількості окислювача. Йод, що виділився, титрують розчином натрій тіосульфату точно відомій концентрації. Таким чином можна розрахувати кількість визначуваного окислювача, яка еквівалентна кількості тіосульфату, що пішов на титрування йоду. Отже, робочим розчином в цьому методі є розчин натрій тіосульфату Na2S2O3.
Початковою речовиною для установки титру Na2S2O3 служить калій дихромат К2Сг207.Більшість окисників не можна титрувати безпосередньо тіосульфатом натрію, оскільки неможливо фіксувати точку еквівалентності. Тому для визначення окисників методом йодометрії застосовують метод титрування замісника. Спочатку проводять реакцію між окиснювачем і калій йодидом в кислому середовищі. Для підкислення застосовують сульфатну кислоту або хлороводневу. Реакція протікає за рівнянням:
К2Сг2О7 +6КІ + 7Н2SO4 = Cr2(SO4)3 +7H2O + 4K2SO4 +3I2
Сг2О72- +14H+ +6e- → 2Cr3++7H2 1
2І- - 2е-→ І2 3
Вільний йод, що виділився, титрують розчином натрій тіосульфату:
2Na2S2O3 + І2 = 2NaI + Na2S4O6
2S2O32- -2e-→ S4O62- 1
2І0 + 2е-→ 2І- 1
Індикатором в методі йодометрії служить розчин, крохмалю. Це чутливий і специфічний індикатор, який утворює з йодом адсорбційну сполуку синього кольору. Проте застосування цього індикатора має деякі особливості. По-перше, розчин крохмалю необхідно додавати в самому кінці титрування, коли йоду залишається дуже мало і титруючий розчин матиме ясно-жовте забарвлення. Якщо додати крохмаль раніше, коли йоду в розчині ще багато, то титрування буде ускладнено тим, що сполука йоду, що утворюється, з крохмалем дуже поволі реагує з тіосульфатом. Друга особливість обумовлена тим, що в даному випадку ми титруємо не до появи забарвлення (як це звичайно буває), а до зникнення забарвлення. Тому поблизу точки кінця титрування необхідно додавати розчин не більше ніж по одній краплі, після кожної краплі ретельно перемішувати розчин і чекати 3—5 сек. Якщо не дотримуватись обох цих умов, розчин дуже легко перетитрувати.
Для проведення визначень окисників йодометричним методом потрібно дотримувати ряд умов.
1) Щоб реакція між окиснювачем і калій йодидом протікала практично до кінця, її потрібно проводити в кислому середовищі.
2) Титрування ведуть на холоді, оскільки при нагріванні йод може частково випаруватися, а також тому, що з підвищенням температури знижується чутливість крохмалю як індикатора.
3) Титрування не можна проводити в сильнолужному середовищі, оскільки йод реагує з лугом. Необхідно стежити за тим, щоб рН розчину не перевищував 9,0.
4) При визначенні окиснювача необхідно застосовувати значний надлишок калій йодиду Розчинність йоду у воді мала, а надлишок К1 сприяє розчиненню йоду, що виділився при реакції. Крім того, надлишок К1 сприяє прискоренню реакції між іонами I- і окиснювачем.
5) Швидкість реакції між калій йодидом і окиснювачем недостатньо велика, тому до титрування йоду, що виділився, приступають не відразу, а по закінченню деякого часу після надбавки окиснювача.
6) При стоянні перед початком титрування реакційну суміш необхідно зберігати в затемненому місці, оскільки на світлі швидшає окислення I- в I2; киснем повітря.
2. Визначення відновників. З числа відновників цим методом частіше за все визначають сульфіти, сульфіди та інші. Робочим розчином є розчин йоду І2 Як вихідна речовина для встановлення титру розчину йоду застосовують астат (III) оксид, який розчиняють в лугу і одержують арсеніт (іон АrО2-). Титрування проводять в дуже слаболужному середовищі (рН<8,0). Практично це досягається надбавкою розчину натрій гідрокарбонату до розчину, що має нейтральну або слабокислу реакцію. Індикатор — крохмаль.
При визначенні різних відновників рідко застосовують пряме титрування, оскільки при титруванні розчином йоду результати виходять заниженими. Причина полягає в тому, що титруючий відновник під час титрування частково окиснюється киснем повітря, крім того, коли титруючого відновника стає мало, реакція між ним і йодом йде повільно і крохмаль забарвлюється раніше досягнення точки еквівалентності. Тому в більшості випадків застосовують зворотне титрування: до визначуваного відновника додають явний надлишок титруючого розчину йоду і залишок йоду, що не прореагував, титрують розчином натрій тіосульфату. Велика чутливість крохмалю до йоду і різке зникнення синього забарвлення в точці еквівалентності дають можливість застосовувати в йодометрії робочі розчини значно меншої концентрації, ніж в інших титриметричних методах. Звичайно застосовують розчини від 0,1 до 0,01 моль - екв/л В окремих випадках застосовують з молярною концентрацією еквівалента 0,001 моль - екв/л. Можливість застосовувати більш розведені робочі розчини приводить до отримання більш точних результатів.
Пряме йодометричне титрування. Метод прямого йодометричного титрування визначають речовини, які мають сильні відновні властивості (натрію тіосульфат, аскорбінова кислота, лікарські сполуки арсену(ІІІ)та ін.) Визначення проводять у кислому, нейтральному або слабко лужному середовищі. Титр антом є розчин йоду в калію йодиді. Цей розчин має жовто-бурий колір і зайва його крапля забарвлює розчин, що титрується, у блідо-жовтий колір, що може слугувати ознакою кінця титрування (кількісне визначення аналгіну).
Методом зворотної йодлметрії визначають сполуки, які повільно окислюються йодом (іоніазид), утворюють з ним комплексні сполуки (кофеїн), дають реакцію ароматичного заміщення (антипірин) або потребують для стехіаметричного необоротного окислення лужного середовища (формальдегід, глюкоза, фурацилін). В останньому випадку окислення відбувається за схемою:
7.Хімічні показники умовно поділяють на п’ять груп: головні іони, розчинені гази, біогенні речовини, мікроелементи, органічні речовини. Для визначення цих показників використовуються хімічні методи аналізу.
Головні іони. Найбільш розповсюджені в природних водах аніони: НСО3-, SO42-, C1-,CO32-, HSiО3і катіони Na+, Ca2+, Mg2+, K+, Fe2+. Вміст головних іонів у прісних водах становить 90-95% від загального солевмісту. У виробничих стічних водах їх вияв може бути дуже різноманітним: це іони вісмуту, кобальту, нікелю, миш’яку та інших важких металів.
Розчинені гази. Серед них певне значення мають кисень, діоксид вуглецю, сірководень та ін. Вміст кисню у воді поверхневих водойм визначається надходженням його з повітря та внаслідок фотосинтезу. У зимовий період концентрація кисню у водоймах різко зменшується через відсутність реаерації й у зв’язку із надходженням тільки підземних вод, що майже не містять кисню. Розчинність кисню у воді залежить від температури води.
Діоксид вуглецю знаходиться у воді як у розчиненому вигляді, так і у формі вугільної кислоти. Основним джерелом діоксиду вуглецю в поверхневих водах є біохімічні процеси розпаду органічних речовин, а також він потрапляє у водойми з підземними водами. Концентрація діоксиду вуглецю у воді залежить від вмісту солей, рН, температури та ін.
Сірководень у природних водах зустрічається органічного (продукт розпаду органічних сполук) і неорганічного (розчинення мінеральних солей) походження. Наявність сірководню у воді додає їй неприємного запаху, сприяє корозії металу.
Мікроелементи. Це такі елементи, вміст яких у воді становить менше 1 мг/л. Мікроелементи в природних водах можуть знаходитися у вигляді іонів, молекул, колоїдних частинок, суспензій, входити до складу мінеральних і органічних комплексів. У питній воді важливе гігієнічне значення мають сполуки йоду і фтору.
Органічні речовини. У природних водах вони бувають у вигляді гумусових сполук, що утворюються під час розкладання рослинних залишків.Для характеристики ступеня забруднення води органічними сполуками застосовують такі непрямі методи, як окислюваність води і біохімічне споживання кисню.Окислюваність води – кількість кисню, необхідна для окислювання домішок у певному об’ємі. Залежно від застосовуваного окислювача розрізняють перманганатну і біхромантну окислюваність. Ступінь забруднення води органічними сполуками виражається кількістю кисню, необхідного для їхнього окислювання мікроорганізмами в аеробних умовах, і зветься біохімічною потребою в кисні (БПК). Повним БПК вважається кількість кисню, необхідного для окислювання органічних речовин до початку процесів нітрифікації. У лабораторних дослідженнях поряд з повним БПК визначається біохімічна потреба в кисні протягом 5 діб – БПК5. Для побутових стічних вод (без істотної домішки виробничих) іноді вважається, що за повну біохімічну потребу в кисні можна прийняти БПК20. Кількість кисню, що витрачається для окислювання амонійного азоту до нітритів і нітратів, при визначенні БПК не враховується. Активна реакція води є показником лужності або кислотності, кількісно вона характеризується концентрацією водневих іонів. Для нейтральної води рН = 7, для кислої – менше 7 і для лужної – більше 7. Активна реакція природних вод звичайно варіюється в межах 6,5 – 8,5 рН, стічних вод коливається у великих межах, залежно від походження. Активна реакція води визначається за допомогою рН-метра.
8. 1.Хіміческій метод Вінклера для визначення розчиненого кисню
Серед методів визначення концентрації розчиненого кисню найстарішим, але до цих пір не втратили своєї актуальності, залишається хімічний метод Вінклера. У цьому методі розчинений кисень кількісно реагує з свежеосажденная гідроокисом Mn (II). При підкисленні з'єднання марганцю більш високої валентності вивільняє йод з розчину йодиду в еквівалентних кисню кількостях. У деяких роботах показано, що не можна впевнено говорити про освіту тільки сполук марганцю (III) або (IV). На думку деяких авторів, утворюється суміш гідроксидів. Вивільнений йод далі визначається титруванням тіосульфатом натрію з крохмалем, як індикатор.
Стадія фіксації кисню (лужне середовище)
Mn 2 + + 2OH - = Mn (OH) 2
2Mn (OH) 2 + O 2 = 2MnO 2 * H 2 O
Йодометрическом титрування (кисле середовище)
MnO 2 * H 2 O + 4H + + 2J - = Mn +2 + + J 2 +3 H 2 O
J 2 + J - = J 3 -
J 3 - + 2S 2 O 3 2 - = 3J - + S 4 O 6 2 -
У міру використання цього методу в природних водах було відзначено істотний вплив редокс-активних домішок. Але, незважаючи на це, методична простота і надійність дозволила вже 1925 включити метод Вінклера до збірки стандартних хімічних методів аналізу вод. Нижче коротко представлені ті труднощі, які можуть виникати при проведенні аналізу за Вінклер при одночасній наявності у воді часто зустрічаються редокс-домішок.
2)Мешающее дію редокс-активних домішок
1. Fe (III, II). Сполуки двовалентного заліза на стадії фіксації кисню можуть виступати як конкуренти по відношенню до марганцю. Прореагувавши з киснем, утворюється гідроксид Fe (III), кінетика взаємодії якого з йодидом в кислому середовищі сповільнена.
2. Нітрити. Зазвичай присутність у воді нітритів обумовлено мікробіологічними перетворенням амонію в нітрат. Відомо, що нітрити в кислому середовищі здатні окислювати йодид іони, викликаючи тим самим завищень результатів у методі Вінклера. Тим не менш, при вмісті у воді до 0.05-0.1 мг N / л можна застосовувати прямий метод Вінклера. В даний час найпоширенішим способом нейтралізації впливу нітритів вважається використання добавок азиду натрію. Крім застосування азиду є й інші способи придушення або врахування впливу нітритів: застосування сечовини або сульфамінової кислоти. Всі ці реактиви руйнують нітрит до молекулярного азоту.
3. Органічні речовини. Зрозуміло, що вплив орг. речовин, як виражених відновників буде проявлятися на всіх етапах визначення розчиненого кисню по Вінклер. Молекулярний кисень, окислені форми марганцю, молекулярний йод - все це досить сильні окислювачі для взаємодії з органічними домішками. Якщо вода багата органічними речовинами (окислюваність 15-30 МГО 2 / л і більше), то виявляється необхідним вводити поправку на їх взаємодію. Наприклад, пропонується проводити паралельну йодну пробу, знаходячи тим самим, скільки йоду витратилося на йодування органічних домішок.
4. Сульфіди і H 2 S. Виявлено, що вміст в аналізованій воді сульфідів приводить до заниження результатів методу Вінклера. При цьому взаємодія сульфіду з окислювачами носить стехіометричний характер: 1 моль кисню і 2 моля сульфіду. У результаті реакції виділяється елементарна сірка. Оскільки в методі Вінклера сильними окислювачами є крім кисню також йод і маргенец (III, IV), то у формулюванні механізму взаємодії сульфіду з окислювачем є різні думки. Так деякі автори вважають, що сульфід взаємодіє з окисленими формами марганцю, а інші - з йодом. Був розроблений метод одночасного визначення сульфідів і кисню в пробі води. Автори, використовуючи солі Zn, осаджують ZnS, які далі відокремлюють і визначають спектрофотометрично, а решти над осадом воді проводять визначення розчиненого кисню. Раніше була використана подібна схема, але використовувався не сульфат, а ацетат Zn. При взаємодії кисню і сульфіду можливо також утворення тіосульфату, в якості проміжного з'єднання. Також був запропонований спосіб обліку такого тіосульфату за методом холостої проби.
10.Суть йодометричного визначення сульфідів і сірководню у природних водах.
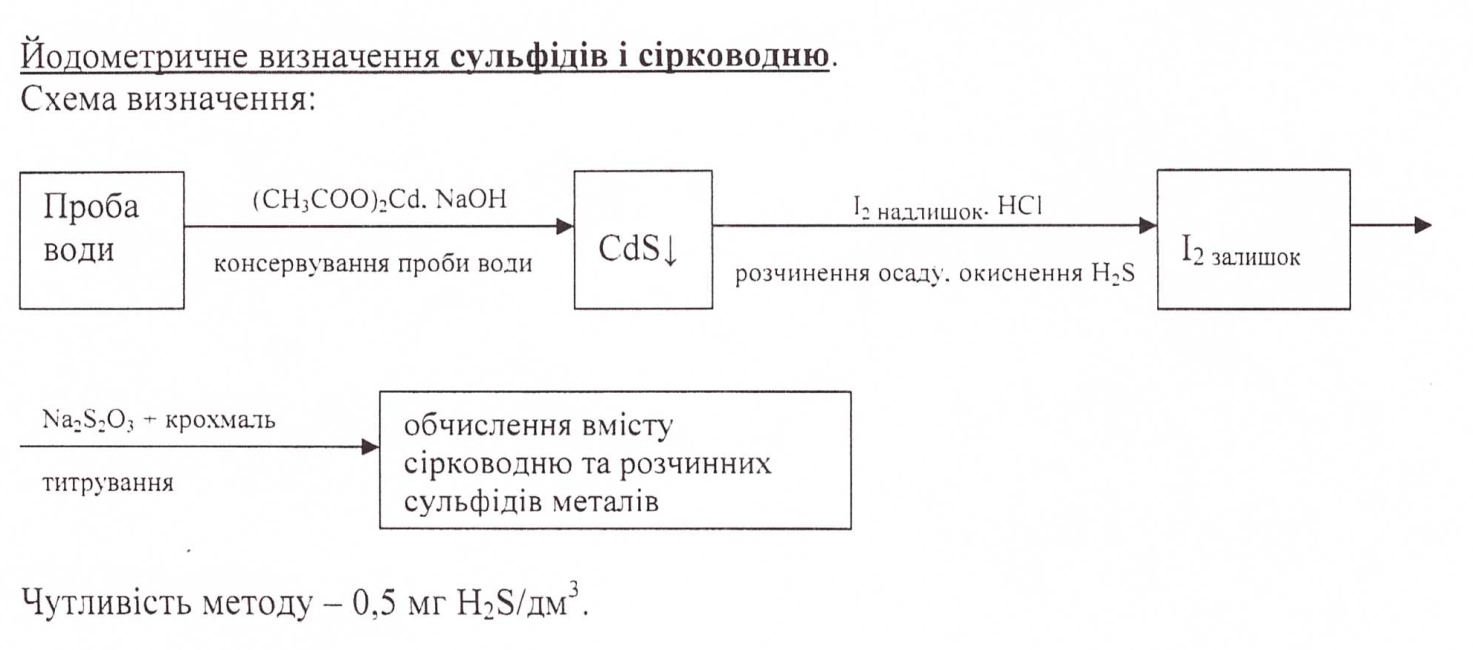
11.Йодометричне визначення йоду у поверхневих водах.
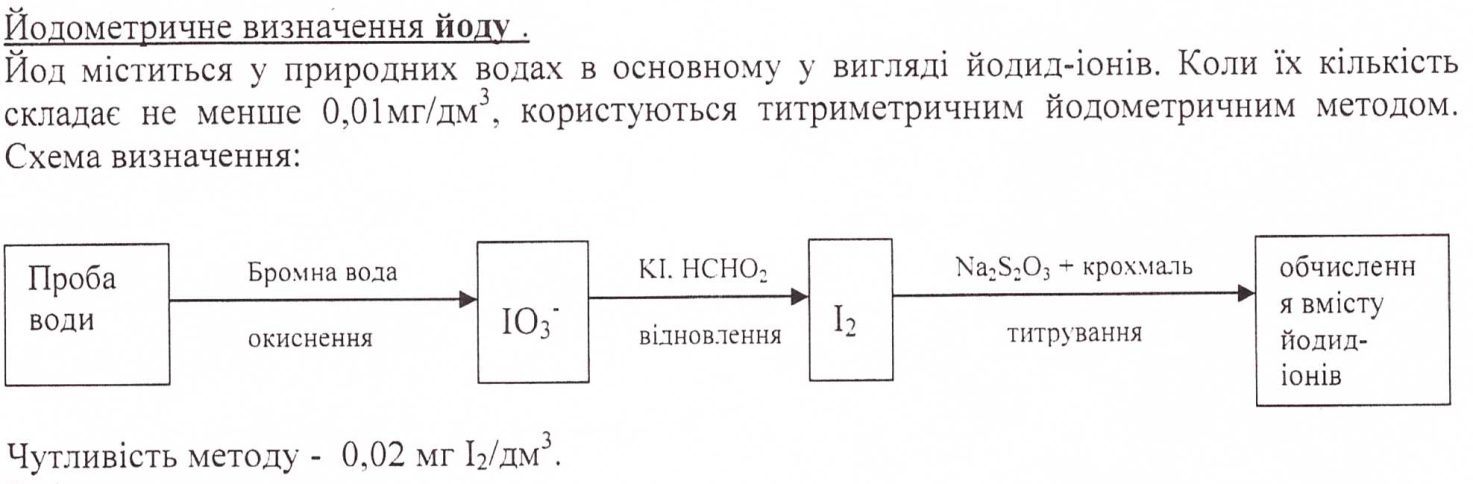
12. Поняття «активний хлор».

13. Визначення металів, неорганічних газуватих сполук повітряного басейну. Шляхи їх надходження, МВ.

Hg0 + Cr2O72- + H+ = Hg2+ + Cr3+ + H2O
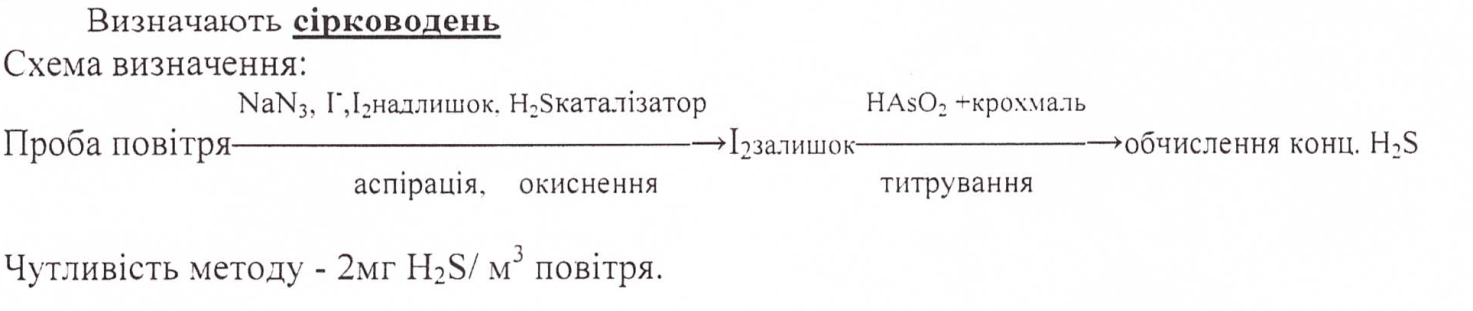
14. Суть йодометричного визначення сірководню у повітряному басейні. МВ, одиниці вимірювання кількісного вмісту.
15. Суть визначення хлорид-іонів у природних водах методом Мора. Фіксування точки еквівалентності. Наведіть відповідні рівняння.


16. Чи можливе титрування методом Мора у присутності іонів амонію? Які аніони і чому заважають визначенню хлорид-іонів у воді методом Мора?
Так, титрування методом Мора у присутності іонів амонію можливе, а ле треба, щоб реакція проводилась при рН 6,7-7,5, оскільки при рН>7,5 утворюються комплексні аміак ати арґентуму [Ag(NH3)2]+.ш9
Визначенню хлорид-іонів у воді заважають сульфіти, сульфіди, тіосульфати, які можна розкласти пероксидом Гідрогену у лужному середовищі. Фосфат-іони заважають при концентрації понад 25 мг\л, іони феруму(ІІІ) – при концентраціх більше 10 мг\л.
17. Умови перебігу реакцій при аргентометричному титруванні методом Мора.


18. Підготовка води до аналізу
Для одержання достовірних результатів аналіз необхідно проводити якомога швидше. У воді відбуваються процеси окиснення- відновлення, фізико-хімічні, біохімічні, викликані діяльністю мікроорганізмів, сорбції, десорбції, седиментації тощо. Можуть змінюватися і органолептичні властивості води – запах, колір тощо. Деякі сполуки або йони окремих елементів здатні адсорбуватися на стінках посуду (Ферум, Алюміній, Купрум, Кадмій, Манган), а зі скла бутлів можуть вилуговуватися мікроелементи. Якщо неможливо дослідити воду у встановлені для відповідних показників терміни її охолоджують або консервують. Біохімічні процеси у воді можна уповільнити, охолодивши її до 4 градусів С. У цих умовах повільніше розкладається і більшість органічних сполук. Після відбору проби іде її підготовка до аналізу, яка відбувається у декілька стадій:
- консервація, транспортування та зберігання проб води;
- визначення хімічних інгредієнтів у розчиненому стані, колоїдно-
дисперсній формі та зависях;
- концентрування мікрокомпонентів;
- усунення речовин, що заважають аналізу.
19. Титрометричне визначення хлоридів аргентометричним методом Мора ґрунтується на утворенні в нейтральному або слаболужному середовищі (рН 6 -10) малорозчинного осаду хлориду срібла (ДР = 1,78∙ 10-10) Для встановлення кінця титрування як індикатор використовують хромат калію, який з надлишком іонів срібла утворює бурий осад – хромату срібла (ДР = 1,1 ∙ 10-13) Метод Мора застосовують для визначення хлоридів у воді при концентрації понад 2 мг/л. Без додаткового розбавлення можна титрувати проби води з концентрацією хлоридів до 100 мг/л. Визначенню хлоридів заважають сульфіти, сульфіди та тіосульфати, які можна розкласти пероксидом водню у лужному середовищі. Фосфат-іони заважають при концентрації понад 25 мг/л, іони заліза – при концентрації > 10 мг/л.Для питної води вміст хлориду-іонів неповинен перевищувати 350 мг/л.
20.ЯКІСНЕ ВИЗНАЧЕННЯ У калориметричну пробірку наливають 5 мл води і додають три краплини 10%-вого розчину азотнокислого срібла. Приблизний вміст хлорид-іонів визначають за характером осаду або муті у відповідності з вимогами таблиці: Характеристика осаду або муті
Вміст Cl – іону, мг \л
1. Опалесценція або слабка муть
2. Велика муть
3. Утворюються пластівці, осаджуються не одразу
4. Білий об’ємний осад
1 – 10 10 – 50 50 – 100 більш 100
^ КІЛЬКІСНЕ ВИЗНАЧЕННЯ
У залежності від результатів якісного визначення відбирають у конічну колбу 100 мл досліджуваної води (або менший її об’єм 10 – 15 мл) і доводять до 100 мл дистильованою водою. Без розведення визначаються хлориди в концентрації до 400 мг/л. рН титрованої проби повинен бути в межах 6 – 10. Якщо це не так, то додати 2 краплини фенолфталеїну. При появі рожевого забарвлення прилити по краплях 0,1Н розчин H2SO4 до знебарвлення. У відсутності забарвлення нейтралізувати пробу 0,1Н розчином NaOH до появи рожевого забарвлення, що зникає при помішуванні. Якщо вода каламутна, її фільтрують через беззольний фільтр, промитий гарячою водою. Якщо вода має кольоровість вище 300, пробу знебарвлюють додаванням гідроксиду амонію. Для цього до 200 мл проби додають 6 мл суспензії гідроксиду амонію, а суміш збовтують до знебарвлення рідини. Потім пробу фільтрують через беззольний фільтр. Перші порції фільтру відкидають. Відміряний об’єм води вносять у дві конічні колби і додають по 1 мл розчину K2CrO4. Одну пробу титрують робочим 0,05Н розчином азотнокислого срібла до появи бурого відтінку, другу використовують як контрольну пробу. При значному утриманні хлоридів утворюється осад , що заважає визначенню. У цьому випадку до відтитрованої першої проби додають 2 – 3 краплини титрованого розчину до зникнення оранжевого відтінку, потім титрують іншу пробу, користуючись першою як контрольною.
Вміст хлор-іону (Х) обчислюють за формулою, мг/л де - нормальна концентрація робочого розчину азотнокислого срібла, моль/л;
- об’єм азотнокислого срібла, витрачений на титрування, мл;
- молярна маса еквіваленту хлорид-іону Ме = 35,45 г/моль;
- об’єм проби взятої для титрування, мл.
Розбіжність між результатами повторних визначень при вмісті від 20 до 200 мг/л – 2 мг/л. При більш високому утриманні – 2 відн.%.
21. Тіоціана́тометрі́я, рода́нометрі́я, ме́тод Фо́льгарда — титриметричний метод для кількісного визначення речовин, які утворюють малорозчинні сполуки при взаємодії з тіоціанатами. Метод Фольгарда - це метод зворотного титрування застосовують для кількісного визначення хлоридів, бромідів, йодидів у азотнокислої середовищі.Метод зазвичай застосовується для визначення вмісту солей Ag(I) та Hg(II). Непрямий та зворотній способи тіоціанатометричного титрування застосовуються для визначення галогенідів.
Умови
• Визначенню срібла за прямим методам заважають сполуки нікелю, кобальту, плюмбуму, купруму, меркурію, а також хлориди, сульфіди; визначенню меркурію заважають броміди і хлориди.
• Титрування проводиться у кислому середовищі для запобігання гідролізу сполук Fe3+; розчин підкислюють нітратною кислотою концентрацією 0,4—0,6 моль/л.
• Осад AgSCN здатен адсорбувати на своїй поверхні іони Ag+, що може вплинути на результати титрування. Для уникнення цього визначення проводять при сильному перемішуванні.
• При визначенні йодидів можливий перебіг реакції відновлення заліза(III): тому індикатор додається наприкінці титрування.
• При визначенні хлоридів можлива обмінна реакція:
Для запобігання контакту частинок хлориду срібла та тіоціанат-іонів, до розчину додають 1—2 мл тетрахлорометану, хлороформу або нітробензену.
22. Переваги метода Фольгарда перед методом Мора в тому, що він може застосовуватись як в нейтральному так і в кислому середовищі. Наявність у розчині вільних кислот сприяє отриманню більш точних результатів. Йони барію, плюмбуму, вісмуту не заважають проведенню аналізу, тому метод Фольгарда застосовується більше ніж метод Мора.
23. Метод Фольгарда має ряд переваг у порівнянні з методами Мора і Фаянса. Його використовують для визначення хлоридів, бромідів, йодидів, роданідів і Ag+–іонів. Метод можна застосовувати для титрування кислих розчинів, бо AgSCN нерозчинний у кислотах. При титруванні за цим методом присутні у досліджуваному розчині йони Ba2+, Pb2+ та ін. у більшості випадків не заважають визначенню. Заважають йони Hg2+, які утворюють осад з SCN–-іонами, а також йони F–, які утворюють комплекс із солями феруму(ІІІ): Fe3+ + 6F– " [FeF6]3–. Осаджений аргентум роданід адсорбує на своїй поверхні йони Ag+, що збільшує помилку визначення, тому титрування потрібно проводити при інтенсивному перемішуванні. При визначенні йодид-іонів можливе їх окиснення до вільного йоду йонами Fe3+: 2Fe3+ + 2I– " I2 + 2Fe2+, тому індикатор треба додавати наприкінці титрування. При визначенні хлорид-іонів можлива обмінна реакція: AgCl$ + SCN– " AgSCN + Cl–, і для запобігання контакту частинок AgCl з тіоцианат-іонами додають у розчин 1-2см3 CCl4, CHCl3.
