
- •Реферат на тему: «Производство промышленных микробных ферментов: источники получения, методы получения, типовые схемы производства»
- •Оглавление
- •Введение
- •Факторы, влияющие на биосинтез ферментов
- •Глубинный метод культивирования продуцентов ферментов
- •Поверхностный метод культивирования продуцентов ферментов
- •Стерилизация питательных сред и засев.
- •Производственное культивирование.
- •Получение товарных форм ферментных препаратов
- •Заключение.
- •Список использованной литературы.
Глубинный метод культивирования продуцентов ферментов
Глубинный метод культивирования заключается в выращивании микроорганизмов в жидкой питательной среде. Он технически более совершенен, чем поверхностный, так как легко поддается механизации и автоматизации; переход к большим масштабам производства осуществляется значительно легче и проще.
Весь процесс должен проводиться в строго асептических условиях, что, с одной стороны, является преимуществом метода, а с другой — составляет наибольшую техническую трудность, поскольку малейшее нарушение асептики по причине несоблюдения режима или несовершенства оборудования приводит иногда к полному прекращению образования фермента.
Концентрация фермента в среде при глубинном культивировании обычно значительно ниже, чем в водных экстрактах поверхностной культуры. Фильтраты культуральных жидкостей содержат не более 3% сухих веществ. Это вызывает необходимость предварительного концентрирования фильтратов перед тем, как выделять ферменты любым методом.
Технологические схемы при глубинном способе культивирования почти не отличаются одна от другой, независимо от состава среды и продуцента. Исключение представляют те редкие случаи культивирования анаэробных микроорганизмов, в которых опускается стадия подготовки воздуха. На рисунке 1 представлена типовая технологическая схема.[4]
Получение посевного материала.
Для засева питательной среды посевной материал готовят также глубинным способом. Вид посевного материала зависит от продуцента: для грибов и актиномицетов — мицелиальная вегетативная масса, а для бактерий — молодая культура на начальной стадии роста.
Получение посевного материала осуществляется постадийным увеличением массы продуцента, например, для обслуживания предприятий с большой суточной производительностью — в четыре ступени: исходная культура продуцента-> маточная культура, выращенная в колбах на качалке -> посевная культура, выращенная в инокуляторе -> посевная культура, выращенная в посевном аппарате.
Объем посевного материала зависит от физиологических особенностей продуцента. Он резко возрастает, до 5—20%, если продуцент размножается только вегетативно, и сокращается до 1%, если происходит обильное спороношение. Объем посевного аппарата составляет до 10% от объема промышленного ферментера.
Существенное влияние на ход производственного культивирования оказывает возраст посевного материала. На рис. 2 показано такое влияние на продуцирование ферментов культурой Asp.oryzae 8F. Обычно при использовании слишком молодой посевной культуры процесс затягивается, а старая приводит к нерациональному потреблению субстрата.

Приготовление питательных сред.
Участок приготовления среды обычно изолируют от других производственных помещений, чтобы предотвратить попадание загрязненного микроорганизмами сырья в основное производство. При большой производительности предприятия питательные среды готовят централизованно для всего производства в отдельном здании.
Методы
приготовления питательных сред различны
и зависят от состава компонентов. Для
некоторых требуется предварительная
обработка: измельчение, отваривание,
экстрагирование, 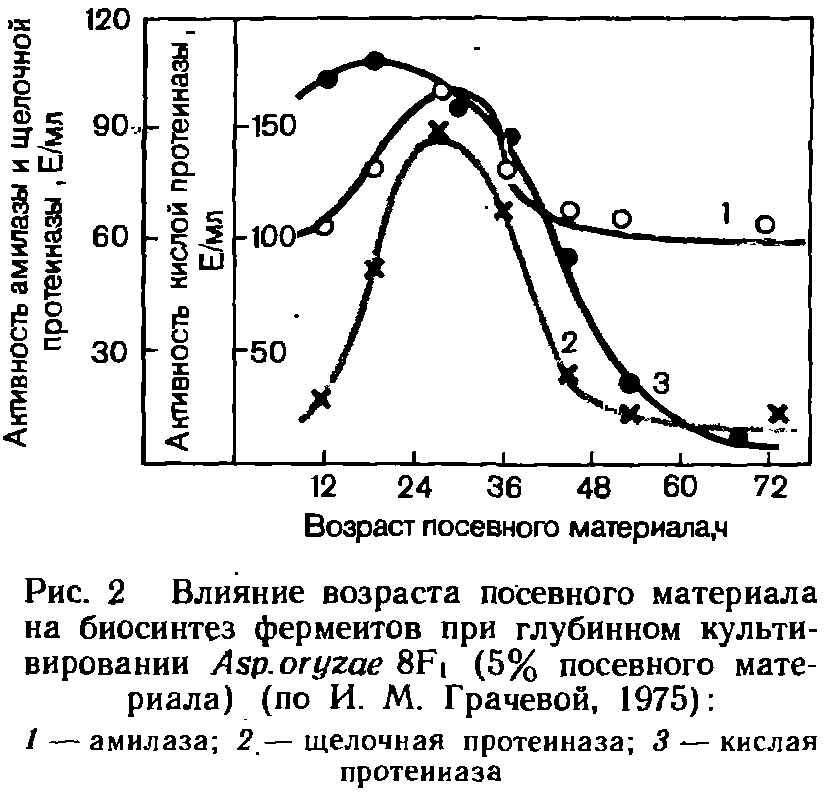 гидролитическое
расщепление и т. д. Затем готовые к
растворению компоненты подают при
постоянном перемешивании через дозирующие
устройства в емкость для приготовления
среды; необходимо соблюдать
последовательность введения в смесь
отдельных компонентов.
гидролитическое
расщепление и т. д. Затем готовые к
растворению компоненты подают при
постоянном перемешивании через дозирующие
устройства в емкость для приготовления
среды; необходимо соблюдать
последовательность введения в смесь
отдельных компонентов.
Емкости и аппараты для предварительной обработки и смешивания компонентов изготавливают из нержавеющей стали или с антикоррозионным покрытием. Передачу жидких потоков осуществляют насосами, самотеком или передавливанием сжатым воздухом. Отделение приготовления сред обычно занимает большое помещение и насыщено оборудованием, так как там кроме смесителей с мешалками и барботерами имеются теплообменники, дозаторы, размельчители, экстракторы, варочные котлы, аппараты для ферментативного гидролиза и др.
Стерилизация питательных сред. Это важнейшая подготовительная операция, осуществляемая двумя способами — отделением микроорганизмов от среды или уничтожением их в среде. Перспективнее первый способ, поскольку при любом методе уничтожения микроорганизмов происходит воздействие «губительного» фактора и на компоненты питательной среды. Первый способ проще всего провести с помощью полупроницаемых мембран в процессе микрофильтрации. Отечественная промышленность уже осваивает производство стерилизующих микрофильтрационных патронов, однако их применение на практике еще крайне ограничено.
Второй метод стерилизации на производстве осуществляют почти исключительно с помощью высоких температур. Отмирание микроорганизмов происходит в течение некоторого времени, которое тем короче, чем интенсивнее «губительный» фактор, т. е. чем выше температура. Кроме того, необходимая, экспозиция зависит еще и от уровня обсемененности объекта, так как чем больше микроорганизмов в обрабатываемом объеме, тем больше особей выживет за данное время в выбранных условиях стерилизации.
Стерилизацию питательных сред можно проводить периодически и непрерывно. В первом случае процесс ведут в самом ферментере, куда заливают питательную среду, нагревают ее до температуры стерилизации, выдерживают при этой температуре нужное время и охлаждают. Во втором случае предварительно стерилизуют аппараты и коммуникации проточным паром, затем подают в ферментер среду, которая прошла через нагревательную колонку (см. рис. 1), где нагрелась острым паром до 120— 140°С, выдерживатель, где находилась нужное время под температурой стерилизации, и холодильник, где охладилась до температуры культивирования.
Отдельно от среды периодическим способом стерилизуют пеногаситель, все корректирующие растворы.[2,4]
Очистка воздуха до и после аэрирования.
Атмосферный воздух содержит частицы пыли органической и неорганической природы, капли воды и микроорганизмы в количестве до 109 частиц на 1 м3. Стерильность его достигается фильтрацией через объемные волоконные фильтры. При производстве ферментных препаратов необходима двойная очистка — на головном фильтре (см. рис. 1), затем на индивидуальных фильтрах непосредственно перед вводом воздуха в посевные и производственные ферментеры.
После аэрирования производственной культуры газовый поток, отводимый из ферментера, несет с собой клетки продуцента. Чтобы не загрязнять окружающий воздух микроорганизмами, на отводящем воздуховоде устанавливают фильтр или систему фильтров. При этом обычно ставится задача получить воздух с установленным предельным значением обсемененности, определенной санитарными органами с учетом особенностей микроорганизмов.
Производственное культивирование.
П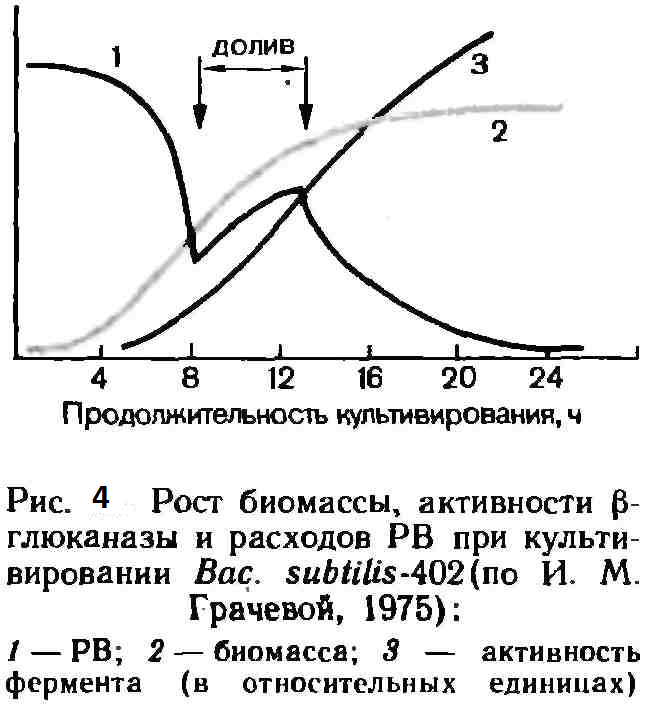 ри
культивированиипродуцента
в объеме жидкости протекают два неразрывно
связанных, хотя зачастую и раздельных
во времени процесса — увеличение
биомассы микроорганизмов и накопление
в среде или в микробной клетке ферментов.
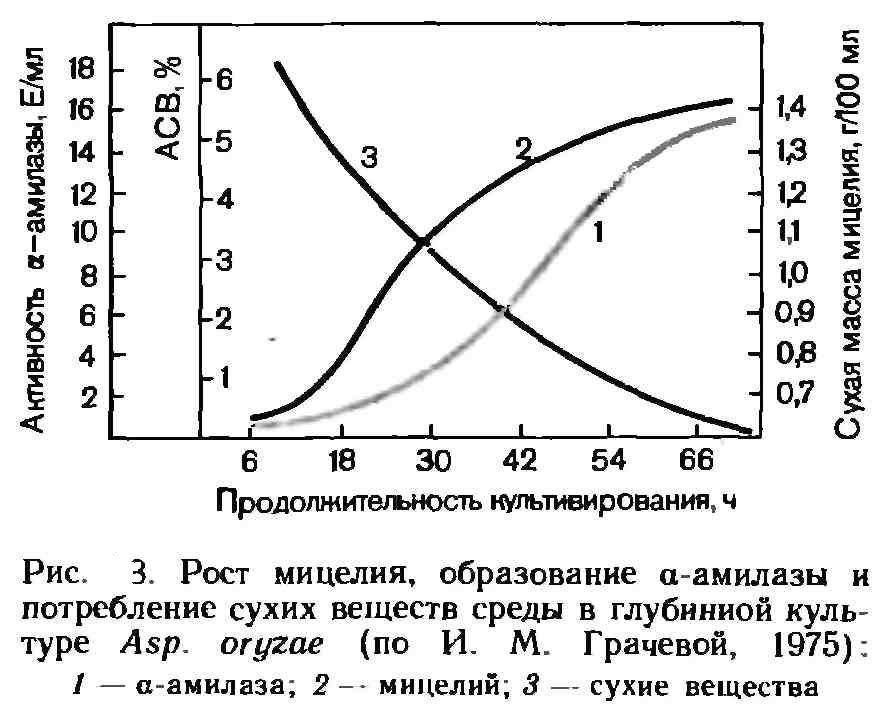
Биосинтез ферментов в глубинных культурах
протекает в течение 2— 4 сут. при
непрерывной подаче воздуха и перемешивании.
Изменения, происходящие в процессе
роста, показаны на рис. 3 на примере
образования α-амилазы продуцентом Asp.
oryzae.
ри
культивированиипродуцента
в объеме жидкости протекают два неразрывно
связанных, хотя зачастую и раздельных
во времени процесса — увеличение
биомассы микроорганизмов и накопление
в среде или в микробной клетке ферментов.
Биосинтез ферментов в глубинных культурах
протекает в течение 2— 4 сут. при
непрерывной подаче воздуха и перемешивании.
Изменения, происходящие в процессе
роста, показаны на рис. 3 на примере
образования α-амилазы продуцентом Asp.
oryzae.
Большинство ферментов являются экстрацеллюларными продуктами и выделяются в окружающую клетки жидкую среду, при этом обычно в мицелии трехсуточной культуры остается не более 10—15% ферментов. В этом случае препараты ферментов выделяют из фильтратов после отделения биомассы. Иногда ферменты не выделяются в окружающую среду и, будучи связанными с клеточными органеллами, могут быть извлечены из клеток лишь после их разрушения и соответствующей обработки.
Высокие концентрации питательных веществ на первых этапах могут тормозить рост биомассы продуцента. Поэтому часто свежая питательная среда или некоторые ее компоненты вводятся в ферментер постепенно на стадии активного роста. Это можно проиллюстрировать биосинтезом β-глюканазы продуцентом Вас. subtilis-402 (рис. 4).
На первом этапе при t=40°С потребляются легко усваиваемые компоненты, биомасса бурно нарастает (к 8-му часу ее содержание достигает 10 г/л). Редуцирующие сахара (по РВ) быстро расходуются. Затем вводят дополнительное количество РВ в виде гидролизата БВК (с 4 до 8 г/л), содержащего необходимые для биосинтеза фермента вещества, особенно индуктор — β-глюкан. Этот прием сокращает длительность культивирования с 28 до 20 ч и в 5 раз повышает конечную ферментную активность.
Одними из важнейших параметров глубинного культивирования являются концентрация ионов водорода и ее изменение в процессе роста культуры. Кислотность среды в растущей культуре определяется составом и свойствами минеральных солей и их потреблением культурой, в первую очередь, это касается источников минерального азота. Потребление клетками иона аммония сопровождается освобождением анионов, которые подкисляют среду. Если же потребляются анионы NO3-, то освобождающиеся ионы металла подщелачивают среду.
В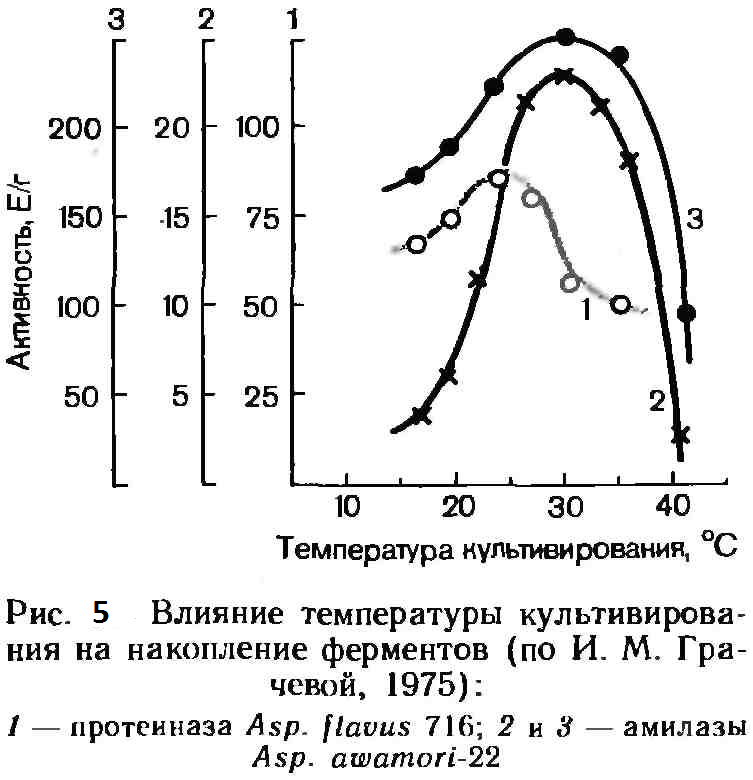 лияние
рН на биосинтез ферментов можно
проиллюстрировать
на примере получения α-амилазы Asp.
oryzae.
Даже при незначительном подкислении,
когда в течение всего роста поддерживалось
рН 6,0, наблюдалось заметное понижение
активности (на 23%). При выращивании с
постоянной кислотностью исходной среды
(рН
5,5) через трое суток обнаруживается лишь
40% от возможного выхода фермента.
лияние
рН на биосинтез ферментов можно
проиллюстрировать
на примере получения α-амилазы Asp.
oryzae.
Даже при незначительном подкислении,
когда в течение всего роста поддерживалось
рН 6,0, наблюдалось заметное понижение
активности (на 23%). При выращивании с
постоянной кислотностью исходной среды
(рН
5,5) через трое суток обнаруживается лишь
40% от возможного выхода фермента.
Интересно отметить, что оптимальное значение рН среды при биосинтезе грибной α-амилазы (рН 7,5) резко отличается от рН оптимума каталитического действия самого фермента (рН 4,7—4,9).
Уровень накопления и скорость образования ферментов сильно зависят от режима аэрации при культивировании. Отсутствие надежных датчиков растворенного кислорода пока не позволяет контролировать процесс напрямую. Однако известно, что интенсивное потребление кислорода свойственно молодой растущей культуре в первые сутки культивирования, поэтому максимальное аэрирование и перемешивание среды обычно осуществляется в начальный период. Следует отметить, что концентрация растворенного кислорода определяется давлением воздуха, температурой, эффективностью перемешивания, которая, в свою очередь, зависит от конструктивных особенностей ферментера; таким образом, технологические и аппаратурные аспекты здесь тесно взаимосвязаны.
Большинство продуцентов ферментов являются мезофильными микроорганизмами и оптимум их развития находится при температуре 22—320С. Почти все они термолабильны и быстро инактивируются при повышении температуры сверх оптимальной. На рис. 5 показана достигаемая активность различных ферментов при культивировании продуцентов в различных температурных режимах.
В процессе культивирования приходится иметь дело со сложной трехфазной системой: жидкость — условно твердая фаза (клетки) — газ. В такой системе затруднены массообменные процессы, что требует специальной аппаратуры. Обычно культивирование проводится в герметичных цельносварных цилиндрических сосудах с эллиптическими крышкой и днищем объемом до 100 м3, выполненных из нержавеющей стали. Основными элементами любого ферментера являются перемешивающие и аэрирующие устройства. Они должны обеспечить равномерное распределение пузырьков воздуха по всему объему жидкости, создать максимально большую поверхность фазового контакта газ — жидкость и устойчивые циркуляционные потоки жидкости с клетками в аппарате, особенно в зонах, где расположены теплообменные устройства. Обычно воздух подают в аппарат через различного типа барботеры или форсунки. Для перемешивания используют многоярусные сложные мешалки.[2,5]
