
- •Лекція 3.
- •Значення білків у життєдіяльності людини.
- •1. Структурна функція.
- •2. Каталітична функція.
- •3. Захисна функція.
- •5. Трансформація енергії.
- •7. Енергетична функція.
- •8. Живильна функція (резервна).
- •9. Буферна функція.
- •10. Скорочувальна функція.
- •Будова білків
- •Методи визначення первинної структури білка
- •Класифікація білків
- •Якісне та кількісне визначення білків
- •Нові форми білкової їжі.
- •Перетворення білків в технологічному потоці.
Будова білків
Способи звязку амінокислот у молекулі білку.
1. Ковалентні зв’язки у молекулі білка можуть бути двох типів – пептидні та дисульфідні.
Наявність у білках кетоімідного типу зв'язку, який був названий пептидним. Пептидний зв'язок утворюється внаслідок взаємодії карбоксильної групи однієї амінокислоти з аміногрупою другої амінокислоти. Сполуки, які при цьому утворюються, називаються пептидами. Схематично процес можна показати так:
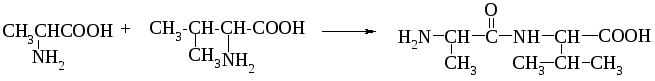
Аланін Валін Дипептид (аланіл-валін)
Дослідженнями встановлено, що пептидний зв'язок є проміжним між подвійним і простим (одинарним) зв'язком. Так відстань між атомами вуглецю і азоту (С—N) в пептидному зв'язку дорівнює 0,132 нм, тоді як довжина одинарного зв'язку між вуглецем і азотом становить 0,147 нм, а подвійного — 0,125 нм. Ця особливість пептидного зв'язку зумовлює таутомерне (кетоенольне) перетворення:

Необхідно зауважити, що обертання навколо пептидного зв'язку значною мірою загальмовано порівняно з іншими зв'язками (N—С–, С—С–), які утворюють скелет поліпептидного ланцюга. Пептидний зв'язок є досить жорстким і має плоску транс конфігурацію. Він є основою утворення поліпептидних ланцюгів, з яких побудовано молекули білка.
Ковалентні зв'язки між залишками двох цистеїнів (дисульфідні містки).
Цей досить міцний ковалентний зв'язок утворюється внаслідок відщеплення атомів водню від сульфгідрильних груп двох амінокислотних залишків цистеїну. Дисульфідний зв'язок, як і водневий, може бути внутрішньоланцюговим (а) і міжланцюговим (б). Велика кількість дисульфідних зв'язків є також в білках сполучної і покривної тканин та в білках, які мають високу біологічну активність. Дисульфідні зв'язки мають важливе значення в формуванні третинної структури білків. Руйнування цих зв'язків призводить до дестабілізації даного рівня структури і втрати білком його біологічної активності.
2. Іонні (електростатичні) взаємодії між протилежно зарядженими амінокислотними залишками (три радикали зі знаком «+» і два зі знаком «-»). Між залишками моноамінодикарбоновими та діаміномонокарбоновими кислотами. Наприклад, позитивно заряджена -аміногруппа лізину (–NН3+) притягається негативно зарядженою карбоксильною групою – (–СОО–) глютамінової або аспарагінової кислоти. Виникає електростатична взаємодія. Приймають участь в утворенні третинної та четвертинної структури.
Залишок глютамінової кислоти
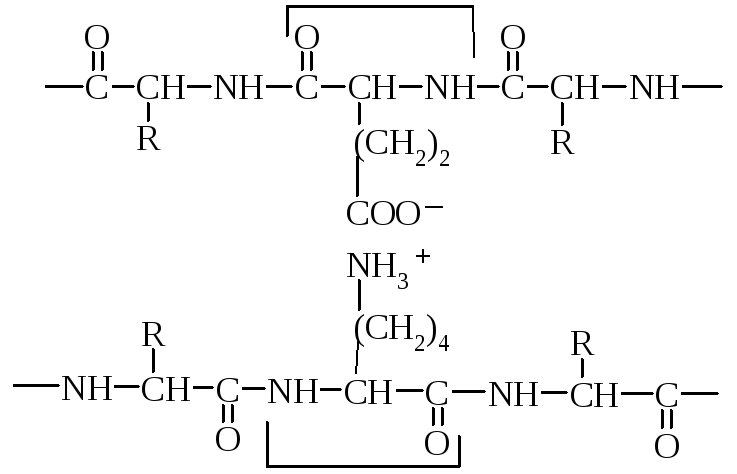
Залишок лізину
3. Водневі зв'язки – слабке електростатичне притягнення між одним електронегативним атомом (наприклад, киснем чи азотом) та водневим атомом, що ковалентно-зв'язаний з другим електронегативним атомом. Беруть участь всі амінокислоти, що у радикалі мають гідроксильні, амідні або карбоксильні групи. У молекулах білка водневий зв'язок найчастіше утворюється при взаємодії атома водню імінної групи залишку однієї амінокислоти з атомами кисню карбонільної групи залишку іншої амінокислоти:
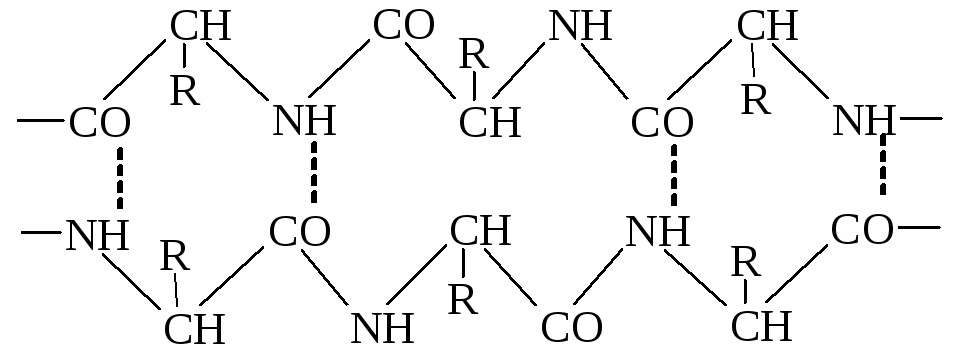
Водневий зв'язок у молекулі білка може бути внутрішньоланцюговим (з’єднує окремі витки однієї спіралі) і міжланцюговим (з’єднує різні поліпептидні ланцюги). У нативних білках цей тип зв'язку може утворюватися не лише між воднем і киснем пептидних груп, а й між іншими функціональними групами поліпептидного ланцюга.
Водневий зв’язок досить слабкий. Грає важливу роль в утворенні вторинної, третинної та четвертинної структур.
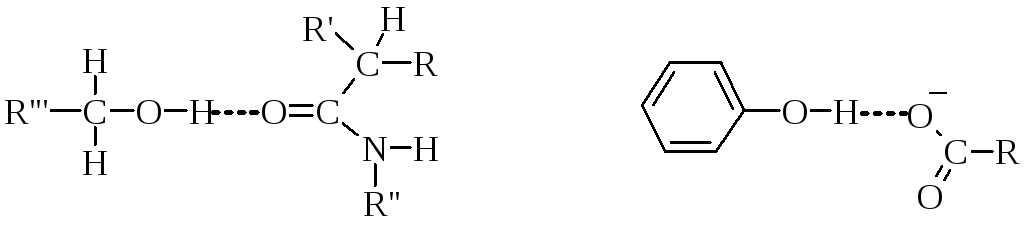
Між атомом Гідрогену гідроксильної групи і атомом Оксисену карбонільної групи пептидного зв’язку.

Між атомом Оксисену і атомом Гідрогену двох гідроксильних груп або гідроксильної та аміногруп.
4. Гідрофобні взаємодії. Утворюються внаслідок міжмолекулярної взаємодії (сил Ван- дер Ваальса) між неполярними алкільними радикалами у водному середовищі.
Залишок лейцину
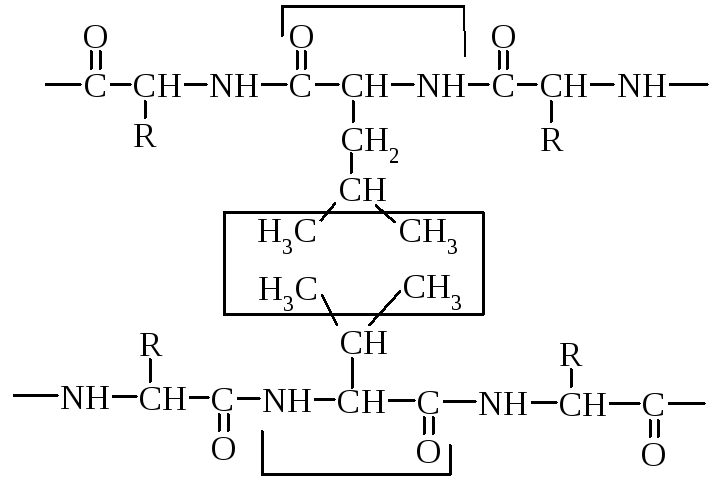
Залишок валіну
Перш ніж розглянути природу гідрофобних взаємодій, необхідно ввести поняття гідрофобних (і гідрофільних) функціональних груп і сполук. Самі назви вказують на те, що ці поняття відносяться до водних розчинів. Групи, що можуть утворювати водневі зв'язки з молекулами води, називаються гідрофільними. Оскільки молекула води може виступати як у ролі донора атома Гідрогену, так і в ролі акцептора атома Гідрогену, гідрофільними є групи, що мають або «кислий» атом Гідрогену (атом Гідрогену, з'єднаний з атомом, більш електронегативним, чим атом Карбону), або атоми з неподіленою електронною парою. До таких груп відносяться гідрокси- і аміногрупи, карбонільна, карбоксильна, амідна групи і т.п.
Молекули або частини молекули, які не здатні утворювати водневі зв'язки з водою називаються гідрофобними. До гідрофобних груп відносяться алкільні й ароматичні радикали. Як правило, гідрофобні сполуки – або погано, або зовсім нерозчинні, гідрофільні добре розчинні у воді. Грає важливу роль в стабілізації третинної та четвертинної структур.
Особливо важливим є дослідження послідовності розміщення залишків амінокислот у поліпептидних ланцюгах, тобто первинної структури білка. Остання визначає трьохмірну структуру поліпептидних ланцюгів, яка називається конформацією білка.
Рівні просторової організації біополімерів
Звичайно при розгляді просторової організації біополімерів виділяють чотири рівні: первинну, вторинну, третинну і четвертинну структуру. Хоча такий поділ значною мірою умовний, він досить корисний для систематизації наших знань про будову біополімерів.
Первинна структура білка - це послідовність розташування амінокислотних залишків у поліпептидному ланцюзі. Первинною структурою називають порядок, у якому мономерні одиниці зв'язані між собою ковалентними зв'язками. На Землі не було, немає і не буде двох людей з цілком однаковим набором білків.
