
14.Многоядерные арены
.pdf
название хромофоры (от греч. «хромос» - цвет и «форос» - носитель). Хромофорами являются: длинные цепи сопряжения, азогруппа – N = N –,
хиноидная группа 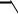

 , нитрогруппа – NО2, нитрозогруппа – N = О и др. Для появления окраски часто достаточно одного такого хромофора в структуре молекулы. Если молекула содержит несколько хромофоров, включѐнных в единую цепь сопряжения, интенсивность окраски увеличивается.
, нитрогруппа – NО2, нитрозогруппа – N = О и др. Для появления окраски часто достаточно одного такого хромофора в структуре молекулы. Если молекула содержит несколько хромофоров, включѐнных в единую цепь сопряжения, интенсивность окраски увеличивается.
Однако окрашенное вещество далеко не всегда является красителем. Чтобы вещество было красителем, в его структуре должны присутствовать группы, получившие название ауксохромы (от греч. «ауксео» - увеличиваю и «хромос» - цвет). Ауксохромами являются группы: ОН, NH2, NHR, NR2, OR, SH и др. Эти группировки без хромофоров не способны вызывать окраску, но, находясь с ними в единой сопряженной системе, усиливают окраску и способствуют взаимодействию красителя с окрашиваемым материалом, что повышает устойчивость окраски к действию внешней среды, моющих средств и др.
КРАСИТЕЛИ ТРИФЕНИЛМЕТАНОВОГО РЯДА
В основе красителей трифенилметанового ряда лежат производные трифенилметана (несущие хромофор), которые содержат в бензольных кольцах аминогруппы или гидроксильные группы (ауксохромы).
Синтез трифенилметановых красителей протекает, как правило, в несколько стадий:
1.Получение лейкооснования красителя (бесцветное вещество).
2.Окисление лейкооснования в карбинольное основание красителя
(бесцветное вещество).
3.Превращение карбинольного основания красителя в краситель (окрашенное вещество).
Носителем цвета в трифенилметановых красителях является карбкатион (C6H5)3C+, содержащий длинную цепь сопряжения (хромофор), по которой происходит смещение свободных пар электронов, принадлежащих ауксохромам, в сторону положительно заряженного центрального углеродного атома.
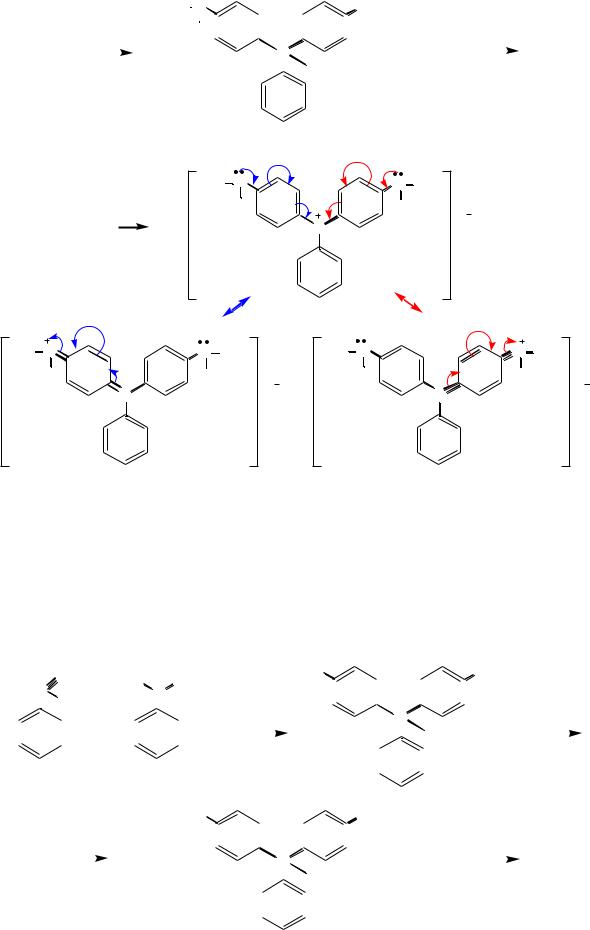
Малахитовый зеленый. Конденсацией бензальдегида с N,N-диметил- анилином в присутствии серной кислоты получают лейкооснование малахитового зелѐного. Его окисляют до карбинольного основания, которое под действием соляной кислоты превращается в краситель малахитовый зелѐный:
C |
O |
H3C |
N |
CH3 |
H3C N |
N CH3 |
H |
|
|
Н3C |
CH3 |
||
|
|
|
|
|
|
C |
|
+ |
2 |
|
|
- H2О |
Н |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
бензальдегид |
N,N-диметиланилин |
лейкооснование малахитового зелѐного |
||||
302
|
H3C |
|
N |
|
|
|
|
|
|
|
|
|
N |
|
|
CH3 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[ O ] |
Н3C |
|
|
|
|
|
|
|
|
|
CH3 |
HCl |
|||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
C |
|
|||||||||||
|
|
|
|
|
|
|
- H2O |
||||||||||||
PbO |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбинольное основание малахитового зеленого
H3C N |
N CH3 |
Н3C |
CH3 |
C |
Cl |
H3C N |
N CH3 |
H3C N |
|
N CH3 |
Н3C |
CH3 |
Н3C |
|
CH3 |
C |
|
Cl |
C |
Cl |
краситель малахитовый зеленый
Малахитовый зеленый применяют для окрашивания тканей (хлопок, шерсть, шелк) в зеленый цвет.
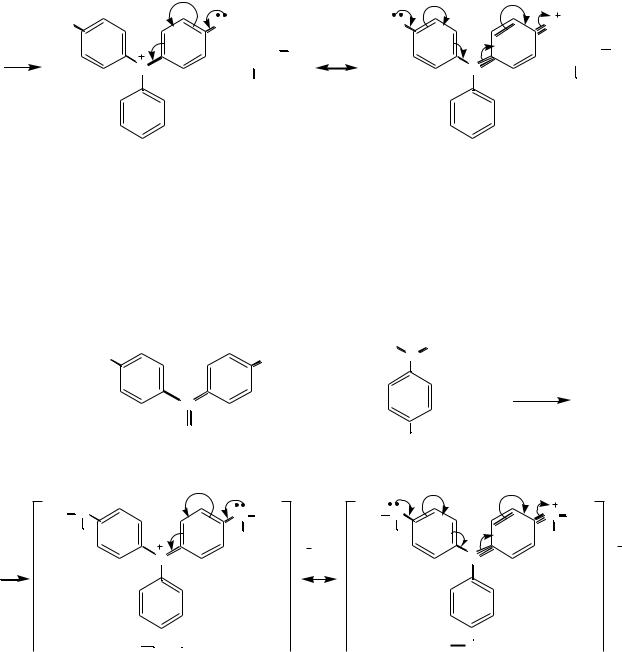
Бриллиантовый зеленый. Лейкооснование бриллиантового зелѐного получают конденсацией бензальдегида с N,N-диэтиланилином в присутствии кислотного катализатора. Окислением лейкооснования получают карбинольное основание, которое под действием щавелевой кислоты превращается в краситель бриллиантовый зелѐный:
|
C |
O |
|
H5C2 N C2H5 |
(C2H5)2N |
|
|
|
|
|
|
|
|
|
|
|
|
N(C2H5)2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
+ 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
[ O ] |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|||
|
|
|
|
|
|
- H2О |
|
|
|
PbO2 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
бензальдегид |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
N,N-диэтиланилин |
|
|
|
|
|
|
|
лейкооснование бриллиантового зелѐного |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
(C2H5)2N |
|
|
|
|
|
|
|
|
|
|
|
N(C2H5)2 |
СООН |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
СООН |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбинольное основание бриллиантового зеленого |
|
|
|
|
|||||||||||||||||||||||
303
(C2H5)2N |
|
N(C2H5)2 |
(C2H5)2N |
|
N(C2H5)2 |
|
C |
СОО |
|
C |
СОО |
|
|
|
СООН |
||
|
|
СООН |
|
|
краситель бриллиантовый зеленый
Бриллиантовый зеленый применяют в медицине в виде 1 – 2 % водных и спиртовых растворов как антисептическое средство. Окраска бриллиантовым зеленым мало устойчива к действию света и влажным обработкам, поэтому как краситель его используют, главным образом, для окрашивания нетекстильных материалов – бумаги, древесины и др.
Кристаллический фиолетовый. При взаимодействии кетона Михлера с N,N-диметиланилином образуется краситель кристаллический фиолетовый:
(CH3)2N |
N(CH3)2 |
H3C N CH3 |
|
|
|
||
|
C |
+ |
HCl |
|
|
||
|
|
- H2O |
|
|
|
|
|
|
O |
H |
|
кетон Михлера |
|
||
N,N-диметиланилин |
|
||
CH3 N |
N CH3 |
CH3 N |
N CH3 |
Н3C |
CH3 |
Н3C |
CH3 |
C |
Cl |
C |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
N |
|
CH3 |
|
|
|
|
CH3 |
N |
|
CH3 |
|
|
||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
краситель кристаллический фиолетовый |
|||||||||||
|
Кристаллический фиолетовый применяется, главным образом, как |
||||||||||||||||
кислотно-основной индикатор для титрования. |
|
|
|
|
|
|
|
||||||||||
|
Фенолфталеин |
|
является представителем |
окситрифенилметановых |
|||||||||||||
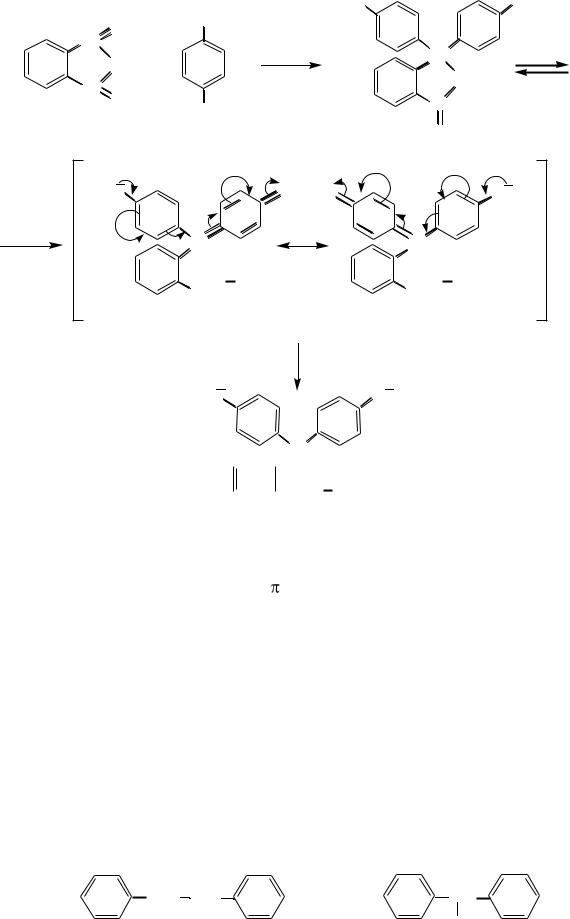
красителей. Он образуется при конденсации фталевого ангидрида с фенолом в присутствии серной кислоты. В кислой и нейтральной среде фенолфталеин находится в бесцветной лактонной форме, а в щелочной среде (при рН 8,2–10) приобретает малиновую окраску:
304
|
|
OH |
HO |
|
OH |
O |
|
|
|
|
|
|
|
|
|
|
|
C |
|
t, H2SO4 |
C |
|
|
O + |
2 |
|
|||
- H2O |
|
O |
|
||
C O |
|
|
|
||
|
H |
|
C |
|
|
|
|
|
|
|
|
|
|
фенол |
|
O |
|
фталевый ангидрид |
|
фенолфталеин (в кислой среде бесцветная форма) |
|||
Na+O |
|
O |
O |
|
O Na+ |
2 NaOH |
|
C |
|
C |
+ 2 H2O |
|
|
|
|||
|
|
COO Na+ |
|
COO Na+ |
|
фенолфталеин (в щелочной среде форма с малиново-красной окраской)
|
NaOH |
Na+O |
O Na+ |
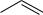
 C
C OH
OH
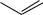
 COO Na+
COO Na+
фенолфталеин (в сильнощелочной среде бесцветная форма)
Возникновение окраски объясняется тем, что в щелочной среде в результате эффекта сопряжения -электроны равномерно распределены по цепи сопряжения, включающей хиноидную и бензоидную группировки. Это облегчает поглощение части видимого света и приводит к появлению окраски. В сильнощелочной среде фенолфталеин обесцвечивается, так как хиноидная структура разрушается, трансформируясь в бензоидную.
Фенолфталеин применяется в аналитической практике как кислотноосновной индикатор, в медицине – как слабительное средство (пурген).
14.1.4. ДИФЕНИЛЭТАН
Дифенилэтан может существовать в виде двух структурных изомеров – симметричного 1,2-дифенилэтана (дибензила) и несимметричного 1,1- дифенилэтана:
CH2 CH2 |
CH |
|
CH3 |
1,2-дифенилэтан |
1,1-дифенилэтан |
305
1,2-дифенилэтан получают действием натрия на хлористый бензил:
2 |
|
|
|
|
|
|
|
CH2Cl + 2Na |
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
CH2 |
|
|
|
|
|
|
+ 2NaCl |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлористый бензил |
|
|
|
|
|
|
|
|
|
|
1,2-дифенилэтан |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
1,1-дифенилэтан получают конденсацией бензола с 1,1-дихлорэтаном: |
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
+ |
Cl |
|
CH |
|
Cl + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
- 2HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
бензол |
|
1,1-дихлорэтан |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,1-дифенилэтан |
|
|||||||||||||||||||||||||||||||
Хлорпроизводное 1,1-дифенилэтана – 1,1-бис(п-хлорфенил)-2,2,2- трихлорэтан, – известное под названием ДДТ, применяется как сильный инсектицид (для уничтожения вредных насекомых). Его получают конденсацией хлораля с хлорбензолом:
2 |
|
|
|
|
|
Cl + CCl3 |
|
C |
O |
H2SO4 |
Cl |
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CCl3 |
|
|
|
|
|
|
|||
хлорбензол |
хлораль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
1,1-ди(п-хлорфенил)-2,2,2-трихлорэтан |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ДДТ) |
|
|
|
|
|
|
||||
=============================================================
14.2. МНОГОЯДЕРНЫЕ АРЕНЫ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ КОЛЬЦАМИ
=============================================================
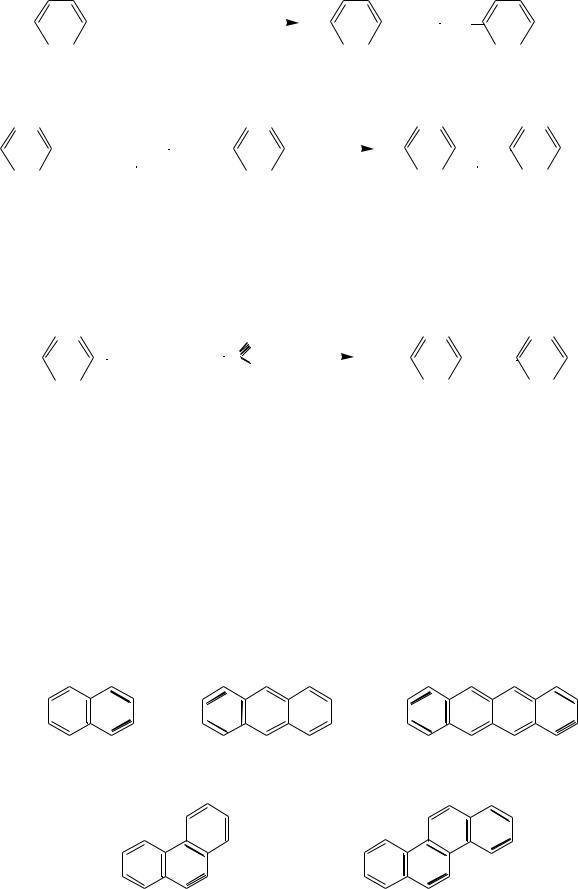
К многоядерным аренам с конденсированными бензольными кольцами относят углеводороды, которые содержат два или более бензольных ядра, имеющих общие атомы углерода. Например: нафталин, антрацен, фенантрен и др. В зависимости от способа сочленения циклов различают два основных типа конденсированных систем:
а) с линейным расположением циклов:
нафталин |
антрацен |
тетрацен |
б) с угловым (ангулярным) расположением циклов:
фенантрен |
хризен |
306
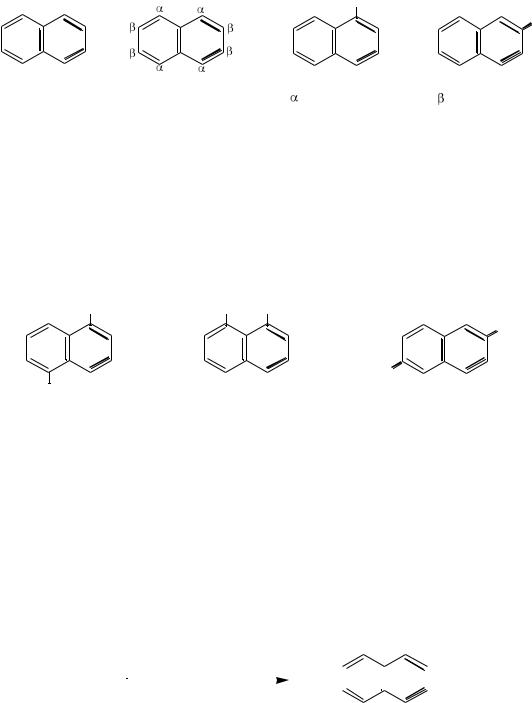
14.2.1.НАФТАЛИН
Молекула нафталина состоит из двух конденсированных бензольных колец. Нумеруются только те атомы углерода, которые принадлежат лишь одному кольцу (общие не нумеруются). При каждом нумерованном атоме углерода имеется один атом водорода. Углеродные атомы в молекуле нафталина неравнозначны (1,4,5,8 – α-положения; 2,3,6,7 – β-положения), поэтому существует два вида однозамещенных нафталинов – α-изомеры и β- изомеры:
8 |
1 |
CH3 |
CH3 |
|
|||
7 |
2 |
|
|
6 |
3 |
|
|
5 |
4 |
|
|
|
нафталин |
-метилнафталин |
-метилнафталин |
|
|
(1-метилнафталин) |
(2-метилнафталин) |
.
Двузамещѐнные нафталины с одинаковыми заместителями могут существовать в виде десяти изомеров. Так, существует десять изомеров диметилнафталина: 1,2-; 1,3-; 1,4-; 1,5-; 1,6-; 1,7-; 1,8-; 2,3-; 2,6- и 2,7-
диметилнафталин. Причѐм положения 1,2 называют орто-; положения 1,3 – мета-; положения 1,4 – пара-; положения 1,5 – ана-; положения 1,8 – пери-; положения 2,6 – амфи-.
CH3 |
CH3 CH3 |
CH3 |
|
|
|
|
|
Н3C |
CH3 |
|
|
ана-диметилнафталин |
пери-диметилнафталин |
амфи-диметилнафталин |
(1,5-диметилнафталин) |
(1,8-диметилнафталин) |
(2,6-диметилнафталин) |
СПОСОБЫ ПОЛУЧЕНИЯ НАФТАЛИНА
Из каменноугольной смолы. Это основной способ получения нафталина в промышленности. Все остальные (лабораторные) методы получения хорошо подтверждают его строение, но практического значения не имеют из-за высокого содержания нафталина в каменноугольной смоле (~10%).
Из ацетилена или его смеси с бензолом при пропускании через раскаленные трубки:
5 CH |
|
|
CH |
700-800 oC |
|
|
|
+ H2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
ацетилен |
|
|
нафталин |
||||||
307
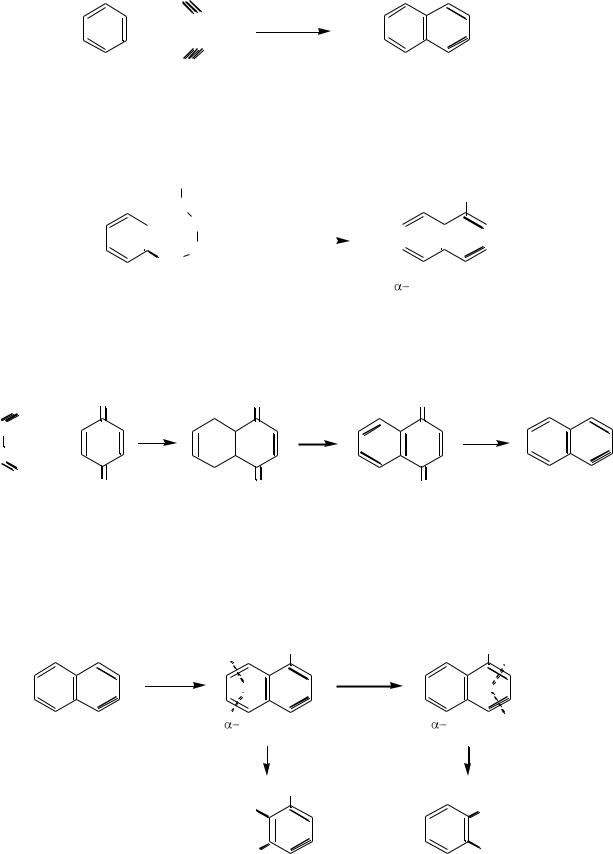
HС
+ |
CH |
700-800 oC |
+ H2 |
CH |
|
||
|
|
|
|
|
HС |
|
|
бензол ацетилен |
|
нафталин |
|
Из алкилбензолов с боковой цепью из четырѐх и более атомов углерода можно получить нафталин и его гомологи (дегидроциклизацией):
|
|
CH3 |
|
|
|
|
CH3 |
|||
|
|
H2C |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
CH2 |
Pt, 300 oC |
|
|
|
+ 3H2 |
|
|
|
|
|
|
|
|
||||
|
|
|
CH2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
CH2 |
|
|
|
|
|
|
||
пентилбензол |
|
|
метилнафталин |
|||||||
Конденсация дивинила с пара-бензохиноном и следующие за ней реакции дегидрирования и восстановления получающихся продуктов приводят к образованию нафталина:
CH2 |
O |
O |
O |
|
|
|
|
CH |
+ |
- 2H2 |
6 [ H ] |
CH |
|
- 2H2O |
|
|
|
||
CH2 |
O |
O |
O |
дивинил |
пара-бензохинон |
|
нафталин |
СТРОЕНИЕ НАФТАЛИНА
Наличие двух бензольных колец в молекуле нафталина доказано с помощью реакций окисления его производных.
|
|
NO2 |
|
NH2 |
I II |
HNO3 |
I II |
восст. |
I II |
|
|
|||
нафталин |
|
нитронафталин |
|
нафтиламин |
|
|
ок. |
|
ок. |
|
|
NO2 |
|
COOH |
|
|
HOOC |
|
|
|
|
II |
|
I |
|
|
HOOC |
|
COOH |
|
|
3-нитрофталевая кислота |
|
фталевая кислота |
Нафталин при окислении превращается во фталевую кислоту, то есть содержит, как минимум, одно бензольное кольцо. Окисление α-нитронафтали-
308
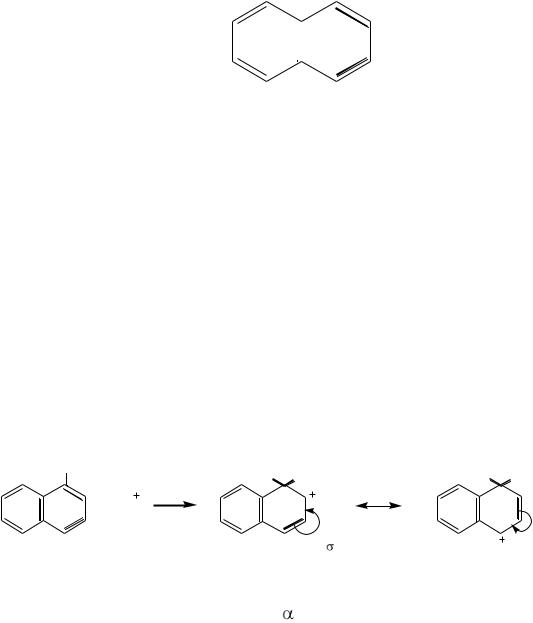
на дает 3-нитрофталевую кислоту. Следовательно, в молекуле нафталина имеется бензольное кольцо ІІ, несущее нитрогруппу. Восстановлением α- нитронафталина получают α-нафтиламин, который при окислении дает фталевую кислоту. В этом случае при окислении разрушилось бензольное кольцо ІІ, содержавшее ранее нитрогруппу. Следовательно, в молекуле нафталина, кроме бензольного ядра ІІ, содержится бензольное ядро І.
Электронное строение нафталина сходно со строением бензола:
молекула плоская, все углеродные атомы в sp2-гибридизации, каждый из десяти атомов углерода предоставляет р-орбиталь для образования замкнутой сопряженной системы. Общее число π-электронов (10) удовлетворяет требованию правила Хюккеля (4n+2). Однако, степень ароматичности у нафталина ниже, чем у бензола. В бензоле все углерод-углеродные связи равны (1,40 нм), что делает его облако π-электронов абсолютно симметричным. В молекуле нафталина длина углерод-углеродных связей разная:
|
7 |
3 |
|
, |
|
1 |
|
0 4 , 1
1,36
1 |
|
|
|
2 |
, |
|
|
||
4 |
|
4 |
||
|
3 |
|
, |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
1,39 |
|
|
|
|
|
|
|
2 |
|
1 |
|
|
|
, |
|
|
,4 |
|
4 |
||
|
3 |
|||
1 |
|
|
||
1,36
0 4 , 1
|
7 |
, |
3 |
||
, |
|
|
1 |
|
|
поэтому π-электронная плотность распределена неравномерно – в α-положе- ниях нафталинового ядра электронная плотность выше, чем в β-положениях. Соответственно и энергия сопряжения нафталина (255,2 кДж/моль) значительно меньше удвоенной энергии сопряжения бензола (2×150,7=301,4
кДж/моль). Поэтому нафталин легче, чем бензол, вступает в реакции
замещения, присоединения, окисления, восстановления.
ХИМИЧЕСКИЕ СВОЙСТВА НАФТАЛИНА
Реакции электрофильного замещения
При взаимодействии нафталина с электрофильными реагентами заместитель почти всегда становится в α-положение. Это объясняется тем, что в α-положении нафталинового ядра электронная плотность выше, чем в β- положении, а также тем, что при замещении водорода в α-положении возникает энергетически более выгодный σ-комплекс, чем при замещении в β-положении.
H |
H |
E |
H E |
|
+ E |
|
|
нафталин |
|
|
-комплекс, |
|
в котором положительный заряд может быть делокализован |
||
|
без нарушения ароматической системы соседнего кольца, |
||
|
соответственно без дополнительной затраты энергии. |
||
|
Значит, в |
-положение атаковать выгодно. |
|
309
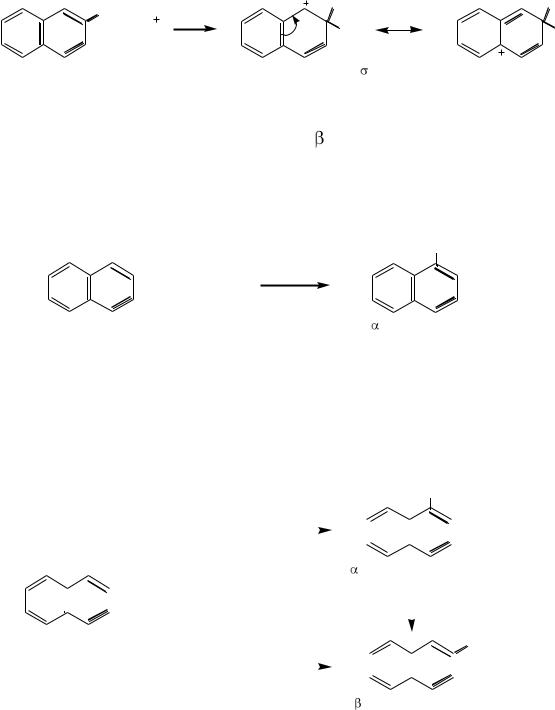
H |
E |
E |
+ E |
H |
H |
нафталин |
-комплекс, |
|
|
в котором положительный заряд делокализуется, |
|
|
нарушая ароматическую систему соседнего кольца, |
|
соответственно затрачивая дополнительную энергию
Значит, в -положение атаковать невыгодно.
Нитрование. При небольшом нагревании в присутствии нитрующей смеси нафталин гладко превращается в α-нитронафталин:
|
|
|
NO2 |
|
+ HNO3 |
H2SO4 |
+ H O |
||
60 |
оC |
|||
|
2 |
|||
нафталин |
|
|
-нитронафталин |
|
|
|
|
(1-нитронафталин) |
|
В более жестких условиях образуется смесь 1,5- и 1,8-динитронафталинов. β- Нитронафтлин этим методом получен быть не может.
Сульфирование. Под действием концентрированной серной кислоты нафталин в зависимости от температуры превращается преимущественно в α- или β-нафталинсульфокислоту:
80 |
оС |
|
|
|
|
SO3H |
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
+ H2O |
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-нафталинсульфокислота |
||||||
|
|
|
+ H2SO4 |
|
|
|
|
|
|
|
H2SO4 |
|
160 оС |
||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
(конц.) |
|
|
|
(конц.) |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
нафталин |
|
|
|
|
|
|
|
|
SO3H |
||||||
|
|
|
|
|
|
|
|
о |
|
|
|
|
|||
|
|
|
160 |
С |
|
|
|
|
+ H2O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-нафталинсульфокислота |
||||||
α-Нафталинсульфокислота при нагревании до 160 ˚С в присутствии серной кислоты превращается в β-нафталинсульфокислоту, а в присутствии 20%-ного олеума при 40 ˚С сульфируется далее с образованием смеси 1,5- и 1,6-нафталиндисульфокислот. Нафталинсульфокислоты являются исходным материалом для синтеза многих красителей, поэтому сульфирование нафталина
– важный в практическом отношении процесс.
Алкилирование и ацилирование. В присутствии кислот Льюиса нафталин реагирует с галогеналканами и галогенангидридами карбоновых кислот с образованием смеси α- и β-замещенных:
310
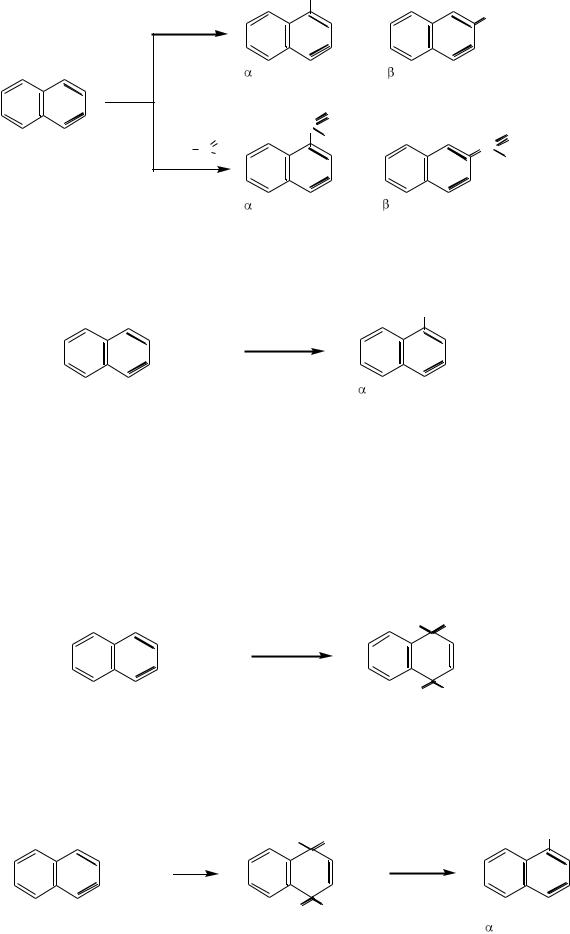
|
|
|
|
CH3 |
|
|
|
|
|
2 CH Cl |
|
|
CH3 |
|
|
|
|
3 |
|
+ |
|
+ |
2HCl |
|
|
|
|
|
|||
|
|
|
|
-метилнафталин |
-метилнафталин |
|
|
2 |
AlCl3 |
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|
|
|
нафталин |
2 |
H3C C |
O |
C CH3 |
C |
О |
|
|
Cl |
+ |
CH3 |
+ 2HCl |
|||
|
|
|
|
|
|||
|
|
|
|
-ацетилнафталин |
-ацетилнафталин |
|
|
Галогенирование (заместительное). При температуре 90-110 ˚С в присутствии FeCl3 нафталин хлорируется с образованием преимущественно α- хлорнафталина:
|
|
|
Cl |
+ Cl2 |
FeCl3 |
|
+ HCl |
90-110 |
о |
||
|
С |
|
|
нафталин |
|
|
-хлорнафталин |
Реакции присоединения
В молекуле нафталина связи между α- и β- атомами углерода имеют бóльшую непредельность, чем углерод-углеродные связи в бензоле, поэтому нафталин значительно легче, чем бензол вступает в реакции присоединения.
Галогенирование (присоединительное). При обычной температуре без катализатора хлор присоединяется к нафталину с образованием продукта 1,4- присоединения:
|
H |
Cl |
|
20 оС |
|
|
+ Cl2 |
|
|
H |
Cl |
нафталин |
1,4-дихлор-1,4-дигидронафталин |
|
Бром вступает в реакцию с нафталином по схеме присоединенияотщепления, т. е. сначала бром присоединяется в положения 1 и 4, а затем продукт присоединения при нагревании отщепляет бромоводород, превращаясь в α-бромнафталин:
|
H |
Br |
Br |
|
|
||
|
+ Br2 |
50-60 оС |
|
|
- HBr |
|
|
|
|
|
|
|
H |
Br |
|
нафталин |
1,4-дибром-1,4-дигидронафталин |
-бромнафталин |
|
311
