
биохимия (Восстановлен)
.pdfобразования тройной спирали. Число углеводных единиц в молекуле коллагена зависит от вида ткани. Так, например, в коллагене сухожилий (тип I) это число равно 6, а в коллагене капсулы хрусталика (тип IV) - НО. Роль этих углеводных групп неясна; известно только, что при наследственном заболевании, причиной которого является дефицит лизилгидроксилазы (синдром Элерса - Данло-Русакова, тип VI), содержание гидроксилизина и углеводов в образующемся коллагене снижено; возможно, это является причиной ухудшения механических свойств кожи и связок у людей с этим заболеванием.
Образование проколлагена и его секреция в межклеточное пространство
После гидроксилирования и гликозилирования каждая про-α-цепь соединяется водородными связями с двумя другими про-α-цепями, образуя тройную спираль проколлагена. Эти процессы происходят ещѐ в просвете ЭР и начинаются после образования межцепочечных дисульфидных мостиков в области С- концевых пропептидов. Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
100. Структурная организация межклеточного матрикса. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Строение и функции гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфатов, гепарина). Структура протеогликанов.
Гликозаминогликаны - линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно присоединѐнные к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков - ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов - коллаген и эластин, иммуноглобулины, ангиотензиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
они являются структурными компонентами межклеточного матрикса;
протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей;
протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
гепарин - антикоагулянт;
гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
Строение и классы гликозаминогликатов
Гликозаминогликаны представляют собой длинные неразветвлѐнные цепи гетерополиса-харидов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером - производное аминосахара (глюкозили галактозамина). NH2-rpyппa аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.Гиалуроновая кислота содержит несколько тысяч дисахаридных единиц, молекулярная масса еѐ достигает 105 - 107 Д.
Хондроитинсульфаты - самые распространѐнные гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связках, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана - основного протеогликана хрящевого матрикса. В организме человека встречаются 2 вида хондроитинсульфатов: хондроитин-4-сульфат и хондроитин-6-сульфат. Они построены одинаковым образом, отличие касается только положения сульфатной группы в молекуле N- ацетилгалактозамина .Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц и имеет молекулярную массу 104 - 106 Д.
Кератансульфаты - наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфат I находится в роговице глаза и содержит кроме повторяющейся дисахаридной единицы L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат II был обнаружен в хрящевой ткани, костях, межпозвоночных дисках. В его состав помимо Сахаров дисахаридной единицы входят N-ацетилгалактозамин, L-фукоза, D-манноза и сиаловая кислота. Кератансульфат II входит в состав агрекана и некоторых малых протеогликанов хрящевого матрикса. В отличие от других гликозаминогликанов, кератансульфаты вместо гексуроновой кислоты содержат остаток галактозы .
Молекулярная масса одной цепи кератансульфата колеблется от 4 × 103 до 20 × 103 Д.
Дерматансульфат широко распространѐн в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов.В составе малых протеогликанов (бигликана и декорина) дерматансульфат содержится в межклеточном веществе хрящей, межпозвоночных дисков, менисков. Повторяющаяся дисахаридная единица дерматансульфата имеет следующую структуру . Молекулярная масса одной цепи дерматансульфата колеблется от 15 × 103 до 40 × 103 Д.
Гепарин - важный компонент противосвѐртывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживаются в лѐгких, печени и коже. Дисахаридная единица гепарина похожа на дисахаридную единицу гепарансульфата. Отличие этих гликозаминогликанов заключается в том, что в гепарине больше N-сульфатных групп, а в гепарансульфате больше N-ацетильных групп. Молекулярная масса гепарина колеблется от 6 × 103 до 25 × 103 Д .
Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепарансульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5 × 103 до 12 × 103 Д.
Cтроение и виды протеогликанов
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные - например агрекан и версикан. Кроме них, в межклеточном матриксе имеется целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там самые разнообразные функции.
Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный "ѐршик" .
В хрящевой ткани молекулы агрекана собираются в агрегаты с гаалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалент-ными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахаридными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200 × 106 Д состоит из одной молекулы гиалуроновой кислоты и 100 молекул агрекана (и такого же количества связывающего белка). Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и "выталкивается" в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Малые протеогликаны
Малые протеогликаны - протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани.
Эти протеогликаны имеют небольшой коровый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан.
Коровые белки бигликана и декорина похожи по размерам и структуре (молекулярная масса 36 000 и 38 000 Д, соответственно). Они имеют несколько тандемных повторов, богатых лейцином, которые образуют α-спирали или β-структуры. На N- и С-концах этих белков имеются домены, содержащие S-S- связи. Ко'ровые белки значительно различаются по первичной структуре в N-концевых областях, что определяет различия в присоединении гликозаминогликанов. Бигликан содержит серии в положениях 5 и 11, что обеспечивает присоединение двух полисахаридных цепей. Декорин содержит один серии в положении 4, поэтому к нему присоединяется одна полисахаридная цепь. У этих протеогликанов полисахаридные цепи представлены дерматансульфатом с молекулярной массой ~ 30 000 Д (рис. 15-17).
Ко́ровый белок фибромодулина (молекулярная масса ~ 40 000 Д) тоже имеет области тандемных повторов, богатые лейцином, но его N-концевая область отличается тем, что не содержит серина, а имеет несколько сульфатированных остатков тирозина, поэтому одна или две цепи кератансульфата присоединяются к ко'ровому белку фибромодулина не в N-концевой, а в области, богатой лейцином, через NH2-группу аспарагина.
Малые протеогликаны являются мультифункциональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр (т.е. препятствуют образованию толстых фибрилл). Декорин и бигликан, присоединяясь к фибронектину, подавляют клеточную адгезию, а присоединяясь к фактору роста опухолей (3, снижают его митогенную активность. Кроме этого, имеется большое количество данных о том, что малые протеогликаны играют важную регуляторную роль в процессах развития и восстановления соединительной ткани.
Протеогликаны базальных мембран
Протеогликаны базальных мембран отличаются значительной гетерогенностью. Это преимущественно гепарансульфатсодержащие протеогликаны (ГСПГ), представленные двумя разновидностями: высокой и низкой плотности
Структурная организация межклеточного матрикса. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции.
Белки межклеточного матрикса выполняют различные функции, но их можно разделить на две большие группы по одному весьма важному признаку: 1) белки, обладающие адгезивными свойствами; 2) белки, подавляющие адгезию клеток.
А. Aдгезивные белки
К первой группе белков с выраженными адгезивными свойствами относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам "зрелой" соединительной ткани.
Фибронектин
Фибронектин - один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединѐнных дисульфидными мостиками у своих С-концов .
Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток.
Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками.
Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach - прикреплять proteins): талин, винкулин, α-актинин.
С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного матрикса внутрь клетки, а также в обратном направлении - из клетки наружу, таким образом влияя на протекающие в клетке процессы.
Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе.
В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
Ламинин - наиболее распространѐнный некол-лагеновый гликопротеин базальных мембран. Он состоит из трѐх полипетидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трѐхцепочечной ветвью . Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток.
Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.

Нидоген - сульфатированный гликопротеин базальных мембран, образует с ламинином плотный, нековалентно связанный комплекс; сила связывания нидогена с коллагеном IV типа гораздо меньше, чем с ламинином. Этот белок представлен одной полипептидной цепью, содержащей три глобулярных домена. Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центр связывания коллагена IV типа. Таким образом, нидоген может выступать в качестве одного из связывающих мостов между различными компонентами межклеточного матрикса и участвовать в образовании тройных комплексов ламинин-нидоген-коллаген. Кроме этого, нидоген содержит RGD-последовательность и поэтому может присоединяться к клеточной поверхности.
Антиадгезивные белки
Ко второй группе белков, обладающих антиадгезивными свойствами, относят такие гликопротеины, как остеонектин, тенасцин и тромбоспондин. Эти белки появляются и играют заметную роль в эмбриогенезе и морфогенезе, развитии клеточного ответа на повреждение. Их концентрация в матриксе повышается при некоторых опухолевых заболеваниях.
Остеонектин (синонимы: ВМ-40, SPARC, от англ, secreted protein acidic and rich in cysteine) состоит из
4 доменов, к 2 из которых могут присоединяться ионы Са2+. Остеонектин - кислый белок, богатый цистеином. Показано, что он может ингибировать G1-S'-фазу роста эндотелиальных клеток.
Тенасцин (антиген мышечных сухожилий) - олигомерный гликопротеин, состоящий, подобно фибронектину, из 2 субъединиц, соединѐнных дисульфидной связью. Эту большую молекулу, похожую на осьминога, называют ещѐ "гексабрахион", так как она имеет 6 "рук", отходящих радиально от одного участка. Благодаря такому строению, тенасцин может взаимодействовать с большим количеством лигандов, к которым относят различные молекулы межклеточного матрикса.
Тенасцин обладает как адгезивными, так и антиадгезивными свойствами, синтезируется в различных тканях эмбриона (наиболее интенсивно - в зонах эпителиальномезинхимальных контактов и в развивающейся нервной ткани). В зрелых тканях небольшие количества тенас-цина находятся в сухожилиях и хрящах, его синтез увеличивается в заживающих ранах.
Тромбоспондин, как и другие белки межклеточного матрикса, может взаимодействовать со многими лигандами: коллагеном, фибронектином, ламинином, протеогликанами, ионами Са2+ и др. В клетках роговицы глаза и тромбоцитах Тромбоспондин проявляет адгезивные свойства, а в клетках эндотелия и фибробластах он функционирует как антиадгезивный белок.
Таким образом, функции этих белков определяются их локализацией и окружением.
101. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина.
К группе миофибриллярных белков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β- актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц
Молекулярная масса миозина скелетных мышц около 500000. Молекула миозина (рис. 20.3) имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу.
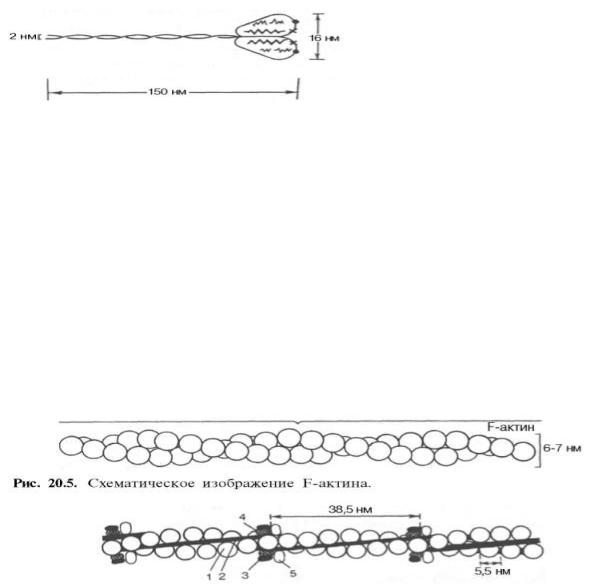
Строение молекулы миозина
Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 20.5). Актиомиозин образуется при соединении миозина с F-актином. Актиомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. Как отмечалось, кроме рассмотренных основных белков, в миофибриллах содержатся также тропомиозин, тропонин и некоторые другие регуляторные белки.
Структура тонкого филамента. 1 - актин; 2 - тропомиозин; 3 - тропонин С; 4 - тропонин I; 5 - тропонин Т.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл. Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином.
Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ . Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ.
102. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения. Особенности энергетического обмена в мышцах; роль креатинфосфата.
Рассмотрим, к чему сводятся представления о механизме попеременного сокращения и расслабления мышц. В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий
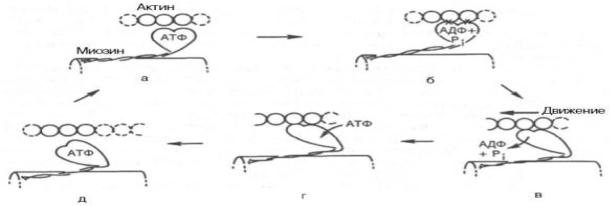
(рис. 20.8): 1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер (см. рис. 20.8, а);
2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90° (см.
рис. 22.8, б);
3)это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера (см. рис. 20.8, в);
4)новая молекула АТФ связывается с комплексом миозин–F-актин (см. рис. 20.8, г); Рис. 20.8. Биохимический цикл мышечного сокращения. Объяснение в тексте.
5)комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом (см. рис. 20.8, д). Затем цикл возобновляется.
Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регулятор-ная роль принадлежит ионам Са2+. Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция . Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6– 10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ. По современным представлениям, в покоящейся мышце (в миофибрил-лах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн сарко-плазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети . При этом наблюдается весьма своеобразная картина: скорость выкачивания ионов Са2+ из межфибриллярного пространства стимулируется этими же ионами. В целом такой механизм получил название «кальциевая помпа» по аналогии с хорошо известным в физиологии натриевым насосом. Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость акто-миозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т- системы некоторого количества ионов Са2+ в саркоплазму. Как отмечалось, «чувствительность» актомиозиновой системы к ионам Са2+ (т.е. потеря актомиозином способности расщеплять АТФ и
сокращаться в присутствии АТФ при снижении концентрации ионов Са2+ до 10–7 М) обусловлена присутствием в контрактильной системе (на нитях F-акти-на) белка тропонина, связанного с тропомиозином. В тропонин-тропомио-зиновом комплексе ионы Са2+ связываются именно с тропонином. В молекуле тропонина при этом происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиози-нового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Mg2+-АТФазы. В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул. Итак, чем большее число мостиков прикреплено в данный момент к акти-новым нитям, тем больше сила мышечного сокращения. Наконец, если возбуждение прекращается, содержание ионов Са2+ в саркоплазме снижается (кальциевая помпа), то циклы прикрепление–освобождение прекращаются, т.е. «головки» миозиновых нитей перестают прикрепляться к актиновым нитям. В присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если прекращается поступление АТФ (аноксия, отравление дыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики толстых (миозиновых) нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы.
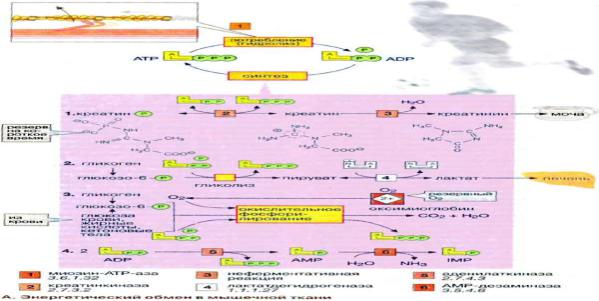
Энергетический обмен в мышечной ткани
103. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы. Медиаторы нервной системы. Физиологически активные пептиды мозга.
1. ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ.
Химический состав нервной ткани сложен и неоднороден, как в целом и сама нервная ткань. Отличия в химическом составе носят в основном количественный характер. В сером веществе 77 -81% воды, в белом-70%. Содержание белков в нервной ткани меньше, чем в некоторых других тканях (печень, мышцы). Их больше в сером веществе и меньше в периферических нервах. В нервной ткани содержится больше сложных белков: ЛИПОПРОТЕИНЫ (миелиновые оболочки), ФОСФОПРОТЕИНЫ, НУКЛЕОПРОТЕИНЫ (ДНП, РНП), ГЛИКОПРОТЕИНЫ (нейрокератин), En.
Наибольший интерес представляют нейроспецифические белки:
1.белок S-100 (растворим в 100% растворе (NH4)2SO4). Он повышается в ткани мозга в эксперименте при обучении и эмоциональном воздействии. Считают, что этот белок отвечает за формирование зависимостей (алкогольной, наркотической). ПРОПРОТЕИН - антитело к белку S-100, понижает его содержание в ткани мозга.
2.Белок 14-3-2 играет важную роль в формировании памяти.
3.НЕЙРОПЕПТИДЫ - играют роль нейромедиаторов и гормонов. Пептиды памяти, боли, сна. Не белковые азотистые соединения те же самые, что и в других тканях, но отличаются по
количественному составу. В нервной ткани много свободных аминокислот, г.о. дикарбоновых (ГЛУ, ГЛН, ACП, АСН), ГАМК, ароматические аминокислоты, ЦАМФ и ЦГМФ. Углеводов незначительное количество:
1.резервные углеводы - гликоген (0,1 %)
2.глюкоза (1 -4мкмоль/л)
3.гексозофосфаты
4.триозофосфаты
5.ПВК
6.молочная кислота.
ЛИПИДОВ в сером веществе 25%, в белом веществе 50%.
1.ФОСФОЛИПИДЫ (до 50%) - ПЛАЗМОГЕН АЦЕТАЛЬФОСФАТИДЫ.
2.ГЛИКОЛИПИДЫ - ЦЕРЕБРОЗИДЫ, ГАНГЛИОЗИДЫ.
3.ВЖК - в основном непредельные, содержащие по 4 - 5 двойных связей.
4.Холестерин (25%) в свободном виде. Мозг даже называют депо холестерина.
5.Нейтральные жиры - в незначительном количестве в головном, но в большом количестве в периферических нервах.
Минеральные вещества представлены катионами калия, натрия, кальция, магния, железа, меди, цинка, в качестве анионов выступают анионы белков и фосфаты.
Миелиновая оболочка — электроизолирующая оболочка, покрывающая аксоны многих нейронов. Миелиновую оболочку образуют глиальные клетки: в периферической нервной системе — Шванновские клетки, в центральной нервной системе —олигодендроциты. Миелиновая оболочка формируется из плоского выроста тела глиальной клетки, многократно оборачивающего аксон подобно изоляционной ленте. Цитоплазма в выросте практически отсутствует, в результате чего миелиновая оболочка представляет собой, по сути, множество слоѐв клеточной мембраны.
Миелин прерывается только в области перехватов Ранвье, которые встречаются через правильные промежутки длиной примерно 1 мм. В связи с тем, что ионные токи не могут проходить сквозь миелин, вход и выход ионов осуществляется лишь в области перехватов. Это ведѐт к увеличению скорости проведения нервного импульса. Таким образом, по миелинизированным волокнам импульс проводится приблизительно в 5—10 раз быстрее, чем по немиелинизированным.
Из вышесказанного становится ясным, что миелин и миелиновая оболочка являются синонимами. Обычно термин миелин употребляется в биохимии, вообще при упоминании его молекулярной организации, а миелиновая оболочка — в морфологии и физиологии.
Химический состав и структура миелина, произведѐнного разными типами глиальных клеток, различны. Цвет миелинизированных нейронов — белый, отсюда название «белого вещества» мозга.
Приблизительно на 70—75 % миелин состоит из липидов, на 25—30 % — из белков. Такое высокое содержание липидов отличает миелин от других биологических мембран.
Склерозы, аутоиммунные заболевания, связанные с разрушением миелиновой оболочки аксонов в некоторых нервах, приводит к нарушению координации и равновесия.
Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
Головной мозг хорошо снабжается кровью и имеет интенсивный энергетический обмен. Хотя головной мозг составляет около 2% массы тела, при спокойном состоянии организма он утилизирует около 20% поглощенного кислорода и 60% глюкозы, которая полностью окисляется до СО2 и Н2О в цитратном цикле и путем гликолиза. В клетках головного мозга практически единственным источником энергии, который должен поступать постоянно, является глюкоза. Только при продолжительном голодании клетки начинают
использовать дополнительный источник энергии — кетоновые тела (см. рис. 305). Запасы гликогена в клетках головного мозга незначительны. Жирные кислоты, которые в плазме крови транспортируются в виде комплекса с альбумином, не достигают клеток головного мозга из-за гематоэнцефалического барьера. Аминокислоты не могут служить источником энергии для синтеза АТФ (АТР), поскольку в нейронах отсутствует глюконеогенез. Зависимость головного мозга от глюкозы означает, что резкое падение уровня глюкозы в крови, например, в случае передозировки инсулина у диабетиков, может стать опасным для жизни. В клетках центральной нервной системы наиболее энергоемким процессом, потребляющим до 40% производимого АТФ, является функционирование транспортной Na+/К+-АТФ-азы (Na+/K+-«насоса») клеточных мембран . Активный транспорт ионов Na+ и К+ компенсирует постоянный поток ионов через ионные каналы. Кроме того, АТФ используется во многих биосинтетических реакциях.
Ацетилхолин (лат. Acetylcholinum) — нейромедиатор, осуществляющий нервно-мышечную передачу, а также основной нейромедиатор в парасимпатической нервной системе. Четвертичное аммониевое основание. В организме очень быстро разрушается специализированным ферментом — ацетилхолинэстеразой.
Ацетилхолину принадлежит также важная роль как медиатор ЦНС. Он участвует в передаче импульсов в разных отделах мозга, при этом малые концентрации облегчают, а большие — тормозят синаптическую передачу. Изменения в обмене ацетилхолина могут привести к нарушению функций мозга. Недостаток его во многом определяет клиническую картину такого опасного нейродегенеративного заболевания, как болезнь Альцгеймера. Некоторыецентральнодействующие антагонисты ацетилхолина (см. Амизил)
являются психотропными препаратами (см. также Атропин). Передозировка антагонистов ацетилхолина может вызвать нарушения высшей нервной деятельности (оказывать галлюциногенный эффект и др.).
Катехоламины — физиологически активные вещества, выполняющие роль химических посредников и «управляющих» молекул (медиаторов и нейрогормонов) в межклеточных взаимодействиях у животных и человека, в том числе в их мозге; производныепирокатехина. К катехоламинам относятся, в частности, такие нейромедиаторы, как адреналин, норадреналин, дофамин (допамин). Адреналин часто, особенно в западной литературе, называют «эпинефрин» (то есть «вещество надпочечников»). Соответственно, норадреналин ча
сто называют «норэпинефрин».
Все высшие формы поведения человека связаны с нормальной жизнедеятельностью катехоламинергических клеток - нервных клеток, синтезирующих катехоламины и использующих их в качестве медиатора. От активности синтеза и выделения катехоламинов зависят такие сложные процессы, как запоминание и воспроизведение информации, сексуальное поведение, агрессивность и поисковая реакция, уровень настроения и активность в жизненной борьбе, скорость мышления, эмоциональность, уровень общего энергетического потенциала и т.д. Чем активнее идет синтез и выделение катехоламинов в количественном отношении, тем выше настроение, общий уровень активности, сексуальность, скорость мышления, да и просто работоспособность.
Самый высокий уровень катехоламинов (на единицу массы тела) у детей. Дети отличаются от взрослых прежде всего очень высокой эмоциональностью и подвижностью, способность к быстрому переключению мышления с одного объекта на другой. У детей исключительно хорошая память, всегда хорошее настроение, высокая обучаемость и колоссальная работоспособность.
С возрастом синтез катехоламинов как в центральной нервной системе, так и на периферии замедляется. Тому есть разные причины: это и старение клеточных мембран, и исчерпание генетических резервов, и общее снижение синтеза белка в организме. В результате снижения скорость мыслительных процессов, уменьшается эмоциональность, снижается настроение. С возрастом все эти явления усугубляются: снижается эмоциональность, настроение, нередки случаи депрессии. Причина этого в одном - в возрастном снижении синтеза катехоламинов в организме.
Высокое содержание в нервной системе дофамина усиливает все сексуальные рефлексы и повышает чувствительность клеток к половым гормонам, что способствует высокому анаболизму. Самым высоким содержанием дофамина в ЦНС отличаются подростки. Их настроение носит на себе налет эйфории, а поведение отличается выраженной гиперсексуальностью. Любые тренировки, даже неправильные с методической точки зрения, в подростковом возрасте дают хороший анаболический эффект. Возрастное падение содержания дофамина вызывает возрастную депрессию (снижение настроения), падение сексуальной активности (у мужчин) и замедление скорости анаболических реакций.
Катехоламины увеличивают нервно-мышечную проводимость, повышают быстроту реакции и скорость мышления.
