
биохимия (Восстановлен)
.pdf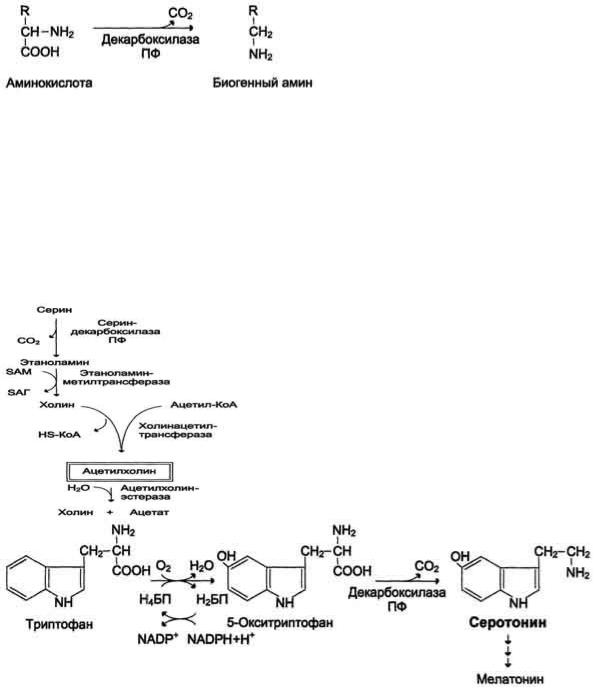
концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу.
77. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, ГАМК, , путресцин. Реакции их образования , ферменты , кофактор. Биороль биогенных аминов. Дезаминирование и метилирование аминов как пути их обезвреживания.
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5- окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путѐм формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
В. Роль аргинина и орнитина в синтезе биологически активных молекул
Обмен аминокислоты аргинина связан с реакциями орнитинового цикла, которые можно рассматривать как путь синтеза аргинина. Под действием аргиназы в цикле происходит и распад аргинина на орнитин и мочевину.
Аргинин выполняет в организме важные функции:
используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. В мышцах беспозвоночных аналогичную энергетическую функцию способен выполнять аргининфосфат.
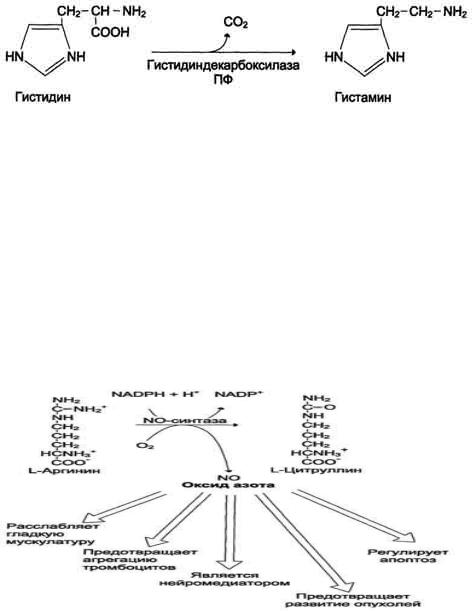
служит источником NO в организме;
служит предшественником орнитина, из которого синтезируются полиамины.
1.Аргинин - источник NO в организме
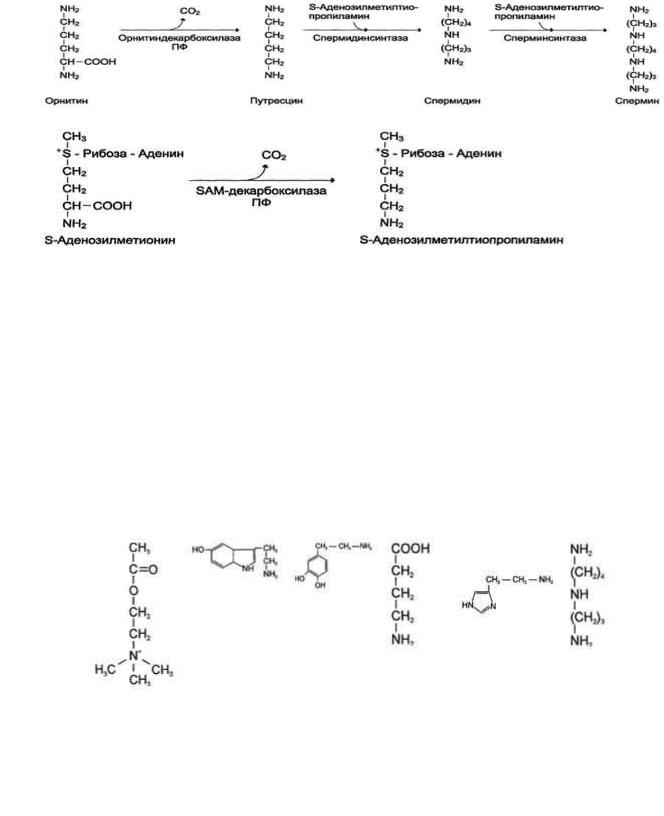
2. Образование спермидина и спермина, их биологическая роль
Аргинин под действием аргиназы превращается в аминокислоту орнитин, которая не входит в состав белков организма. Из орнитина синтезируются полиамины спермидин и спермин (см. схему А на с. 518).
Спермидин, спермин и путресцин обнаружены в ядрах клеток всех органов человека. Они имеют большой положительный заряд, легко связываются с отрицательно заряженными молекулами ДНК и РНК, входят в состав хроматина и участвуют в репликации ДНК, стимулируют транскрипцию и трансляцию. Их концентрация сильно возрастает при интенсивной пролиферации тканей.
Фермент орнитиндекарбоксилаза - регулируемый. Он отличается очень коротким Т1/2 - всего 10 мин. Гормон роста, кортикостероиды, тестостерон быстро увеличивают его количество в 10-200 раз.
Катаболизм полиаминов до СО2 и Н2О происходит под действием полиаминоксидазы в печени. Часть их в ацетилированном виде экскретируется почками.
Предшественники и биологическая роль некоторых биогенных аминов
Амино- |
|
|
|
Глутами- |
|
Орнитин |
|
Серии |
Триптофан |
Тирозин |
новая |
Гистидин |
|||
кислоты |
Лизин |
||||||
|
|
|
кислота |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Продукты |
Этаноламин |
Триптамин |
|
γ-амино- |
Гистамин |
Путресцин |
|
декарбокси |
|
|
|
масляная |
|
Кадаверин |
|
лирования |
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
Биологиче |
Ацетилхолин |
Серотонин |
Дофамин |
ГАМК |
Гистамин |
Спермиди |
|
ски |
|
|
|
|
|
н |
|
активные |
|
|
|
|
|
(и |
|
вещества |
|
|
|
|
|
спермин) |
|
|
|
|
|
|
|
|
|
Формулы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Физиологи |
Возбуждающи |
Возбуждающий |
Медиатор |
Тормозно |
Медиатор |
Изменяют |
|
ческая |
й медиатор |
медиатор |
среднего |
й |
воспаления, |
степень |
|
роль |
вегетативной |
средних |
отдела мозга |
медиатор |
аллергических |
агрегации |
|
|
нервной |
отделов мозга |
|
высших |
реакции, |
полисом. |
|
|
системы |
|
|
отделов |
пищеваритель |
Регулируют |
|
|
|
|
|
мозга |
ный гормон |
синтез РНК |
|
|
|
|
|
|
|
и белка |
|
|
|
|
|
|
|
|
Инактивация биогенных аминов
Для осуществления биологической функции в нервных клетках требуется определѐнная концентрация
биогенных аминов. Избыточное накопление их может вызывать различные патологические отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
Инактивация биогенных аминов происходит двумя путями:
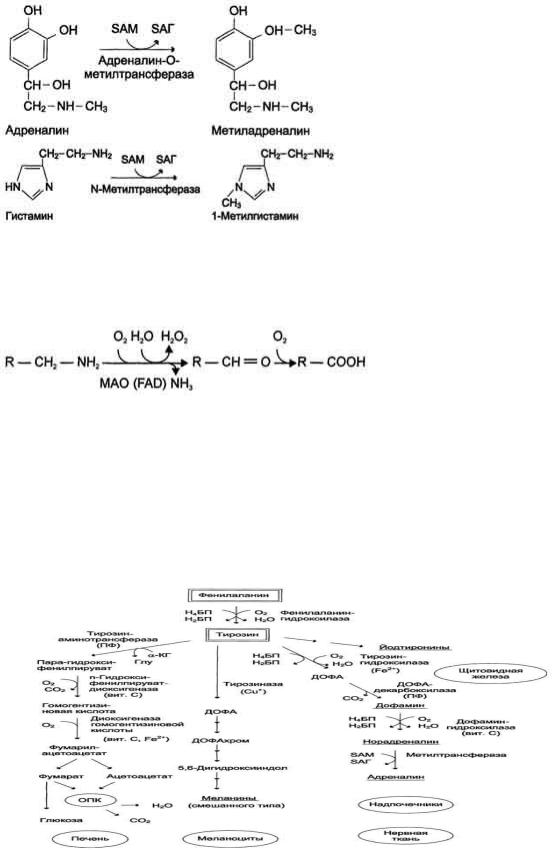
1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путѐм метилирования гидроксильной группы в ортоположении (см. схему ниже).
Реакция инактивации гистамина также преимущественно происходит путѐм метилирования .
2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками
78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях. Синтез катехоламинов, меланинов, йодтиронинов. Наследственные биохимические блоки в распаде фенилаланина и тирозина: паркенсонсизм, фенилкетонурия, алкаптонурия, альбинизм, диагностика и лечение.
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется еѐ бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному
Заболевания, связанные с нарушением обмена фенилаланина и тирозина
Известно несколько наследственных заболеваний, связанных с дефектом ферментов обмена фенилаланина и тирозина в разных тканях.
Фенилкетонурия
В печени здоровых людей небольшая часть фенилаланина ( 10%) превращается в фениллактат и фенилацетилглутамин .
Этот путь катаболизма фенилаланина становится главным при нарушении основного пути - превращения в тирозин, катализируемого фенилаланингидроксилазой. Такое нарушение сопровождается гиперфенилаланинемией и повышением в крови и моче содержания метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглу-тамина. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурия (ФКУ). Выделяют 2 формы ФКУ:
Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме - 1,0- 2,0 мг/дл), в моче - в 100-300 раз по сравнению с нормой (30 мг/дл). Концентрация фенилпирувата и фениллактата в моче достигает 300-600 мг/дл при полном отсутствии в норме.
Наиболее тяжѐлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет. Частота заболевания - 1:10 000 новорождѐнных. Заболевание наследуется по аутосомно-рецессивному типу.
Тяжѐлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефаличеекий барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина).
Вариантная ФКУ (коферментзависимая гиперфенилаланинемия) - следствие мутаций в генах,
контролирующих метаболизм Н4БП. Клинические проявления - близкие, но не точно совпадающие с проявлениями классической ФКУ. Частота заболевания - 1-2 случая на 1 млн новорождѐнных.
Н4БП необходим для реакций гидроксилирования не только фенилаланина, но также тирозина и триптофана, поэтому при недостатке этого кофермента нарушается метаболизм всех 3 аминокислот, в том числе и синтез ней-ромедиаторов. Заболевание характеризуется тяжѐлыми неврологическими нарушениями и ранней смертью ("злокачественная" ФКУ).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребѐнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону "пожизненной диеты".
Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче. Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину. Для этого обследуемому дают натощак 10 г фенилаланина в виде раствора, затем через часовые интервалы берут пробы крови, в которых определяют содержание тирозина. В норме концентрация тирозина в крови после фенилаланиновой нагрузки значительно выше, чем у гетерозиготных носителей гена фежилкетонурии. Этот тест используется в генетической консультации для определения риска рождения больного ребѐнка. Разработана схема скрининга для выявления новорождѐнных детей с ФКУ. Чувствительность теста практически достигает
100%.
В настоящее время диагностику мутантного гена, ответственного за ФКУ, можно проводить с помощью методов ДНК-диагностики (рестрикционного анализа и ПЦР).
Тирозинемии
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирози-нурии. Различают 3 типа тирозинемии.
Тирозинемия типа 1 (тирозиноз). Причиной заболевания является, вероятно, дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумарилацетоа-цетата на фумарат и ацетоацетат (рис. 9-28). Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождѐнных. Клинические проявления - диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6-8 мес из-за развивающейся недостаточности печени.Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
Тирозинемия типа II (синдром Рихнера-Ханхорта). Причина - дефект фермента тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
Тирозинемия новорождѐнных (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифенилпируватдиоксигеназы, превращающего п- гидроксифенилпируват в гомогентизиновую кислоту (рис. 9-28). В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенил-аланина. При лечении назначают бедную белком диету и витамин С.
Алкаптонурия ("чѐрная моча")
Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты . Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тѐмные пигменты алкаптоны. Это метаболическое нарушение было описано ещѐ в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота - 2-5 случаев на 1 млн новорождѐнных. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено.
Альбинизм
Причина метаболического нарушения - врождѐнный дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов (рис. 9-28) может вызывать различные нервно-психические заболевания, причѐм патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Болезнь Паркинсона
Заболевание развивается при недостаточности дофамина в чѐрной субстанции мозга. Это одно из самых распространѐнных неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы:
заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.
подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
79. Эндокринная, паракринная и аутокринная системы межклеточной коммуникации. Роль гормонов в системе регуляции метаболизма. Регуляция синтеза гормонов по принципу обратной связи.
Для нормального функционирования многоклеточного организма необходима взаимосвязь между отдельными клетками, тканями и органами. Эту взаимосвязь осуществляют 4 основные системы регуляции
(рис. 11-1).
Центральная и периферическая нервные системы через нервные импульсы и нейромедиаторы;
Эндокринная система через эндокринные железы и гормоны, которые секретируются в кровь и влияют на метаболизм различных клеток-мишеней;
Паракринная и аутокринная системы посредством различных соединений, которые секретируются в межклеточное пространство и взаимодействуют с рецепторами либо близлежащих клеток, либо той же клетки (простагландины, гормоны ЖКТ, гистамин и др.);
Иммунная система через специфические белки (цитокины, антитела).
А. Иерархия регуляторных систем
Системы регуляции обмена веществ и функций организма образуют 3 иерархических уровня.
Первый уровень - ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы - медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень - эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень - внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
изменения активности ферментов путѐм активации или ингибирования;
изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения;
изменения скорости транспорта веществ через мембраны клеток.
Роль гормонов в регуляции обмена веществ и функций
Интегрирующими регуляторами, связывающими различные регуляторные механизмы и метаболизм в разных органах, являются гормоны. Они функционируют как химические посредники, переносящие сигналы, возникающие в различных органах и ЦНС. Ответная реакция клетки на действие гормона очень разнообразна и определяется как химическим строением гормона, так и типом клетки, на которую направлено действие гормона.
В крови гормоны присутствуют в очень низкой концентрации. Для того чтобы передавать сигналы в клетки, гормоны должны распознаваться и связываться особыми белками клетки - рецепторами, обладающими высокой специфичностью.
Физиологический эффект гормона определяется разными факторами, например концентрацией гормона (которая определяется скоростью инактивации в результате распада гормонов,

протекающего в основном в печени, и скоростью выведения гормонов и его метаболитов из организма), его сродством к белкам-переносчикам (стероидные и тиреоидные гормоны транспортируются по кровеносному руслу В комплексе с белками), количеством и типом рецепторов на поверхности клеток-мишеней.
Синтез и секреция гормонов стимулируются внешними и внутренними сигналами, поступающими в ЦНС (рис. 11-2).
Эти сигналы по нейронам поступают в гипоталамус, где стимулируют синтез пептидных рилизинг-гормонов (от англ, release - освобождать) - либеринов и статинов, которые, соответственно, стимулируют или ингибируют синтез и секрецию гормонов передней доли гипофиза. Гормоны передней доли гипофиза, называемые тройными гормонами, стимулируют образование и секрецию гормонов периферических эндокринных желѐз, которые поступают в общий кровоток и взаимодействуют с клетками-мишенями.
Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратнойсвязи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желѐз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желѐз.
Не все эндокринные железы регулируются подобным образом. Гормоны задней доли гипофиза (вазопрессин и окситоцин) синтезируются в гипоталамусе в виде предшественников и хранятся в гранулах терминальных аксонов нейрогипофиза. Секреция гормонов поджелудочной железы (инсулина и глюкагона) напрямую зависит от концентрации глюкозы в крови.
В регуляции межклеточных взаимодействий участвуют также низкомолекулярные белковые соединения - цитокины. Влияние цитокинов на различные функции клеток обусловлено их взаимодействием с мембранными рецепторами. Через образование внутриклеточных посредников сигналы передаются в ядро, где происходят активация определѐнных генов и индукция синтеза белков. Все цитокины объединяются следующими общими свойствами:
синтезируются в процессе иммунного ответа организма, служат медиаторами иммунной и воспалительной реакций и обладают в основном аутокринной, в некоторых случаях паракринной и эндокринной активностью;
действуют как факторы роста и факторы дифференцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
обладают плейотропной (полифункциональной) активностью.
80. Классификация гормонов по химическому строению и биологическим функция.
Все гормоны классифицируют по химическому строению, биологическим функциям и механизму действия.
1. Классификация гормонов по химическому строению
По химическому строению гормоны делят на 3 группы: пептидные (или белковые), стероидные и непептидные производные аминокислот .
2. Классификация гормонов по биологическим функциям
По биологическим функциям гормоны можно разделить на несколько групп . Эта классификация условна, поскольку одни и те же гормоны могут выполнять разные функции. Например, адреналин участвует в регуляции обме-
Классификация гормонов по химическому строению
Пептидные гормоны |
Стероиды |
Производные аминокислот |
|
|
|

Адренокортикотропный гормон |
Альдостерон |
|
Адреналин |
|
(кортикотропин, АКТГ) |
|
|
|
|
|
|
|
|
|
Гормон роста (соматотропин, ГР, |
Кортизол |
|
Норадреналин |
|
СТГ) |
|
|
|
|
|
|
|
|
|
Тиреотропный гормон |
Кальцитриол |
|
Трийодтиронин (Т3) |
|
(тиреотропин, ТТГ) |
|
|
|
|
|
|
|
|
|
Лактогенный гормон (пролактин, |
Тестостерон |
|
Тироксин (Т4) |
|
ЛТГ) |
|
|
|
|
|
|
|
|
|
Лютеинизирующий гормон |
Эстрадиол |
|
|
|
(лютропин, ЛГ) |
|
|
|
|
|
|
|
|
|
Фолликулостимулирующий |
Прогестерон |
|
|
|
гормон (ФСГ) |
|
|
|
|
|
|
|
|
|
Меланоцитстимулирующий |
|
|
|
|
гормон (МСГ) |
|
|
|
|
|
|
|
|
|
Хорионический гонадотропин |
|
|
|
|
(ХГ) |
|
|
|
|
|
|
|
|
|
Антидиуретический гормон |
|
|
|
|
(вазопрессин, АДГ) |
|
|
|
|
|
|
|
|
|
Окситоцин |
|
|
|
|
|
|
|
|
|
Паратиреоидный гормон |
|
|
|
|
(паратгормон, ПТГ) |
|
|
|
|
|
|
|
|
|
Кальцитонин |
|
|
|
|
|
|
|
|
|
Инсулин |
|
|
|
|
|
|
|
|
|
Глюкагон |
|
|
|
|
|
|
|
|
|
Классификация гормонов по биологическим функциям |
|
|
||
|
|
|
|
|
Регулируемые процессы |
|
|
Гормоны |
|
|
|
|
||
Обмен углеводов, липйдов, |
|
Инсулин, глюкагон, адреналин, кортизол, тироксин, соматотропин |
||
аминокислот |
|
|
|
|
|
|
|
||
Водно-солевой обмен |
|
Альдостерон, антидиуретический гормон |
||
|
|
|
||
Обмен кальция и фосфатов |
|
Паратгормон, кальцитонин, кальцитриол |
||
|
|
|
||
Репродуктивная функция |
|
Эстрадиол, тестостерон, прогестерон, гонадотропные гормоны |
||
|
|
|
||
Синтез и секреция гормонов |
|
Тропные гормоны гипофиза, либерины и статины гипоталамуса |
||
эндокринных желѐз |
|
|
|
|
|
|
|
||
Изменение метаболизма в клетках, |
|
Эйкозаноиды, гистамин, секретин, гастрин, соматостатин, |
||
синтезирующих гормон |
|
вазоактивный интестинальный пептид (ВИП), цитокины |
||
|
|
|
|
|
на жиров и углеводов и, кроме этого, регулирует частоту сердечных сокращений, АД, сокращение гладких мышц. Кортизол не только стимулирует глюконеогенез, но и вызывает задержку NaCl.
81. Клетки-мишени и клеточные рецепторы гормонов. Рецепторы цитоплазматических мембран, рецепторы, локализованные в цитоплазме. Регуляция количества и активности рецепторов. Механизмы трансдукции сигналов рецепторами мембран, G-белок.
Биологическое действие гормонов проявляется через их взаимодействие с рецепторами клетокмишеней. Для проявления биологической активности связывание гормона с рецептором должно приводить к образованию химического сигнала внутри клетки, который вызывает специфический биологический ответ, например изменение скорости синтеза ферментов и других белков или изменение их активности . Мишенью для гормона могут служить клетки одной или нескольких тканей. Воздействуя на клетку-мишень, гормон вызывает специфическую ответную реакцию.
Рецепторы гормонов
Начальный этап в действии гормона на клетку-мишень - взаимодействие гормона с рецептором клетки. Концентрация гормонов во внеклеточной жидкости очень низка и обычно колеблется в пределах 10-6-10- 11 ммоль/л. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном.
1. Общая характеристика рецепторов
Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы стероидных и тиреоидных гормонов находятся внутри клетки. Причѐм внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки .
Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
В структуре мембранных рецепторов можно выделить 3 функционально разных участка. Первый домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен - трансмембранный. У рецепторов одного типа, сопряжѐнных с G-белками, он состоит из 7 плотно упакованных α-спиральных полипептидных последовательностей. У рецепторов другого типа трансмембранный домен включает только одну α-спирадизованную полипептидную цепь (например, обе β-субъединицы гетеротетрамерного рецептора инсулина α2β2). Третий (цитоплазматический) домен создаѐт химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определѐнным внутриклеточным ответом. Цитоплазматический участок рецептора таких гормонов, как инсулин, фактор роста эпидермиса и инсулиноподобный фактор роста-1 на внутренней стороне мембраны обладает тирозинки-назной активностью, а цитоплазматические участки рецепторов гормона роста, пролактина и цитокинов сами не проявляют тирозинкиназ-ную активность, а ассоциируются с другими цитоплазматическими протеинкиназами, которые их фосфорилируют и активируют.
Рецепторы стероидных и тиреоидных гормонов содержат 3 функциональные области. На С-
концевом участке полипептидной цепи рецептора находится домен узнавания и связывания гормона. Центральная часть рецептора включает домен связывания ДНК. На N-концевом участке полипептидной цепи располагается домен, называемый вариабельной областью рецептора, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
2. Регуляция количества и активности рецепторов
Концентрация рецепторов внутри клетки или на еѐ поверхности и их сродство к данному гормону в норме регулируются различными способами, а также могут меняться при заболеваниях или при использовании гормонов или их агонистов в качестве лекарственных средств. Например, при воздействии β- адренергических агонистов на клетки в течение нескольких минут в ответ на новое добавление агониста прекращается активация аденилатциклазы, и биологический ответ исчезает. Такое снижение чувствительности рецептора к гормону (десенситизация) может происходить в результате изменения количества рецепторов по механизму понижающей регуляции. Гормон связывается с рецептором, комплекс гормон-рецептор путѐм эндоцитоза проникает в клетку (интернализуется), где часть рецепторов подвергается протеолитическому расщеплению под действием ферментов лизосом, а часть инактивируется, отделяясь от других мембранных компонентов. Это приводит к уменьшению количества рецепторов на плазматической мембране. Например, в случае инсулина, глюкагона, катехоламинов это происходит в течение нескольких минут или часов. При снижении концентрации гормона рецепторы возвращаются на поверхность клетки, и чувствительность к гормону восстанавливается. Активность рецептора, т.е. его
