
биохимия (Восстановлен)
.pdf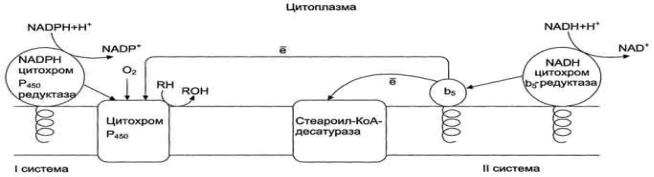
Рис. 12-2. Электронтранспортные цепи ЭР. RH - субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NADPH окисляется NADPH цитохром Р450-редуктазой, которая затем передаѐт электроны на целое семейство цитохромов Р450. Вторая сисгема включает в себя окисление NADH цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома
b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на О2. Один атом кислорода принимает 2 е и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- + 2Н+→ Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH .
Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н+ → ROH + Н2О + NADP+ .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения.
Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой еѐ биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
3. Свойства системы микросомального окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определѐнные изоформы цитохрома Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Регуляция активности микросомальной системы окисления
Регуляция активности микросомальной системы осуществляется на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ, выведение которых невозможно без участия системы микросомального окисления.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
93.Распад гема. Схема процесса, место протекания. «Прямой» и «непрямой» билирубин, его обезвреживание в печени.Диагностическое значение определения билирубина в крови и моче.
Катаболизм гема
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная система локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца . В ходе реакции образуются линейный тетрапиррол – биливердин (пигмент жѐлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему.
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, не также при катаболизме других гемсодержащю белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека - примерно 250-350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
Метаболизм билирубина
Билирубин, образованный в клетках РЭС (селезѐнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Каждая молекула альбумина связывает (или даже 3) молекулы билирубина, одна из которых связана с белком более прочно (более высокое сродство), чем другие. При сдвиге рН крови в кислую сторону (повышение концентрации кетоновых тел, лактата) изменяются заряд, конформация альбумина, снижается сродство к билирубину. Поэтому билирубин, связанный с альбумином непрочно, может вытесняться из центров связывания и образовывать комплексы с коллагеном межклеточного матрикса и липидами мембран. Ряд лекарственных соединений конкурирует с билирубином за высокоаффинный, имеющий высокое сродство центр альбумина.
Поглощение билирубина паренхиматозными клетками печени
Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчѐнная диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z. Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке.
Лигандин и протеин Z обнаружены также в клетках почек и кишечника, поэтому при недостаточности функции печени они способны компенсировать ослабление процессов детоксикации в этом органе.
Конъюгация билирубина в гладком ЭР
В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты.Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин) .
Донором глюкуроновой кислоты служит УДФ-глюкуронат. Специфические ферменты, УДФглюкуронилтрансферазы (уридиндифосфоглюкуронилтрансферазы) катализируют образование моно- и диглюкуронидов билирубина. Индукторами синтеза УДФ-глюкуронилтрансфераз служат некоторые лекарственные препараты, например, фенобарбитал .
Секреция билирубина в жѐлчь
Секреция конъюгированного билирубина в жѐлчь идѐт по механизму активного транспорта, т.е. против градиента концентрации. Активный транспорт является, вероятно, ско-рость-лимитирующей стадией
всего процесса метаболизма билирубина в печени. В норме диглюкуронид билирубина - главная форма экскреции билирубина в жѐлчь, однако не исключается присутствие небольшого количества моноглюкуронида. Транспорт конъюгированного билирубина из печени в жѐлчь активируется теми же лекарствами, которые способны индуцировать конъюгацию билирубина. Таким образом, можно сказать, что скорость конъюгации билирубина и активный транспорт билирубинглюкуронида из гепатоцитов в жѐлчь строго взаимосвязаны .
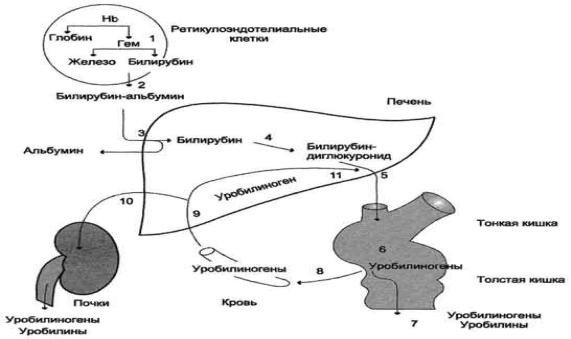
Билирубин-уробилиногеновый цикл в печени. 1 - катаболизм НB в ретикулоэндотелиальных клетках костного мозга, селезѐнки, лимфатических узлов; 2 - образование транспортной формы комплекса билирубин-альбумин; 3 - поступление билирубина в печеНb; 4 - образование билирубинглюкуронидов; 5 - секреция билирубина в составе жѐлчи в кишечник; 6 - катаболизм билирубина под действием кишечных бактерий; 7 - удаление уробилиногенов с фекалиями; 8 - всасывание уробилиногенов в кровь; 9 - усвоение уробилиногенов печенью; 10 - поступление части уробилиногенов в кровь и выделение почками с мочой; 11 - небольшая часть уробилиногенов секретируется в жѐлчь.
. Дифференциальная диагностика желтух
При диагностике желтух надо иметь в виду, что на практике редко отмечают желтуху какого-либо одного типа в "чистом" виде. Чаще встречается сочетание того или иного типа. Так, при выраженной гемолитической желтухе, сопровождающейся повышением концентрации непрямого билирубина, неизбежно страдают различные органы, в том числе и печень, что может вносить элементы паренхиматозной желтухи, т.е. повышение в крови и моче прямого билирубина. В свою очередь, паренхиматозная желтуха, как правило, включает в себя элементы механической. При подпечѐночной (механической) желтухе, например при раке головки поджелудочной железы, неизбежен повышенный гемолиз как следствие раковой интоксикации и, как следствие, повышение в крови как прямого, так и непрямого билирубина.
Итак, гипербилирубинемия может быть следствием избытка как связанного, так и свободного билирубина. Измерение их концентраций по отдельности необходимо при постановке диагноза желтухи. Если концентрация билирубина в плазме <100 мкмоль/л и другие тесты функции печени дают нормальные результаты, возможно предположить, что повышение обусловлено за счѐт непрямого билирубина. Чтобы подтвердить это, можно сделать анализ мочи, поскольку при повышении концентрации непрямого билирубина в плазме прямой билирубин в моче отсутствует.
При дифференциальной диагностике желтух необходимо учитывать содержание уробилиногенов в моче. В норме за сутки из организма выделяется в составе мочи около 4 мг уробилиногенов. Если с мочой выделяется повышенное количество уробилиногенов, то это - свидетельство недостаточности функции печени, например при печѐночной или гемолитической желтухе. Присутствие в моче не только уробилиногенов, но и прямого билирубина указывает на поражение печени и нарушение поступления жѐлчи в кишечник.
94. . Нарушения катаболизма гема. Желтухи: гемолитическая, желтуха новорожденных, печеночно-клеточная, механическая, наследственная (нарушения синтеза УДФглюкуронилтрансферазы).
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жѐлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени.
Во всех случаях содержание билирубина в крови повышается. При достижении определѐнной концентрации он диффундирует в ткани, окрашивая их в жѐлтый цвет. Пожелтение тканей из-за отложения в них билирубина называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не превысит верхний предел нормы более чем в 2,5 раза, т.е. не станет выше 50 мкмоль/л.
1. Гемолитическая (надпечѐночная) желтуха
Известно, что способность печени образовывать глюкурониды и выделять их в жѐлчь в 3-4 раза превышает их образование в физиологических условиях. Гемолитическая (надпечѐночная) желтуха - результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Гемолитическая желтуха развивается при исчерпании резервных возможностей печени. Основная причина надпечѐночной желтухи - наследственные или приобретѐнные гемолитические анемии. При гемолитических анемиях, вызванных сепсисом, лучевой болезнью, дефицитом глюкозо-6-фосфатдегидрогеназы эритроцитов, та-лассемией, переливанием несовместимых групп крови, отравлением сульфаниламидами, количество освобождающегося из эритроцитов гемоглобина за сутки может доходить до 45 г (при норме 6,25 г), что значительно увеличивает образование билирубина. Гипербилирубинемия у больных гемолитической желтухой обусловлена значительным повышением (103 - 171 мкмоль/л) в крови концентрации альбуминсвязанного неконъюгированного билирубина (непрямой билирубин). Образование в печени и поступление в кишечник больших количеств билирубинглюкуронидов (прямой билирубин) ведѐт к усиленному образованию и выделению с калом и мочой уробилиногенов и более интенсивной их окраски .
Один из главных признаков гемолитической желтухи - повышение содержания в крови неконъюгированиого (непрямого) билирубина. Это позволяет легко отличить еѐ от механической (подпечѐночной) и печѐночно-клеточной (печѐночной) желтух.
Неконъюгированный билирубин токсичен. Гидрофобный, липофильный неконъюгирован-ный билирубин, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клетки и органелл. Это отрицательно сказывается а состоянии ЦНС, вызывая у больных ряд характерных неврологических симптомов.
Желтуха новорождѐнных
Частая разновидность гемолитической желтухи новорождѐнных - "физиологическая желтуха", наблюдающаяся в первые дни жизни ребѐнка. Причиной повышения концентрации непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У новорождѐнных не только снижена активность УДФ-глюкуронилтрансферазы, но и, по-видимому, недостаточно активно происходит синтез второго субстрата реакции конъюгации УДФ-глюкуроната.
Известно, что УДФ-глюкуронилтрансфераза - индуцируемый фермент (см. раздел 12). Новорождѐнным с физиологической желтухой вводят лекарственный препарат фенобарбитал, индуцирующее действие которого было описано в разделе 12.
Одно из неприятных осложнений "физиологической желтухи" - билирубиновая энцефалопатия. Когда концентрация неконъюгированного билирубина превышает 340 мкмоль/л, он проходит через гематоэнцефалический барьер головного мозга и вызывает его поражение.
2. Печѐночно-клеточная (печѐночная) желтуха
Печѐночно-клеточная (печѐночная) желтуха обусловлена повреждением гепатоцитов и жѐлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах.
Причина повышения концентрации билирубина в крови - поражение и некроз части печѐночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражѐнных гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жѐлчь против градиента концентрации. Для печѐночно-клеточной желтухи характерно то, что вместо преобладающих в норме диглюкуронидов билирубина в поражѐнной печѐночной клетке образуются главным образом моноглюкурониды .
Врезультате деструкции печѐночной паренхимы образующийся прямой билирубин частично попадает
вбольшой круг кровообращения, что ведѐт к желтухе. Экскреция жѐлчи также нарушена. Билирубина в кишечник попадает меньше, чем в норме.
При печѐночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так и обеих его фракций - неконъюгированного (непрямого) и конъюгированного (прямого).
Так как в кишечник поступает меньше билирубинглюкуронида, то и количество образующегося уробилиногена также снижено. Поэтому кал гипохоличный, т.е. менее окрашенный. Моча, наоборот, имеет более интенсивную окраску за счѐт присутствия там не только уробилинов, но и конъюгированного билирубина, который хорошо растворим в воде и экскретируется с мочой.
3. Механическая, или обтурационная (подпечѐночная) желтуха
Механическая, или обтурационная (подпечѐночная), желтуха развивается при нарушениижелчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жѐлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жѐлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной железы или послеоперационным сужением общего жѐлчного протока .
При полной закупорке общего жѐлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Поскольку билирубин в кишечник не попадает, продуктов его катаболизма уробилиногенов в моче и кале нет. Кал обесцвечен. Так как нормальные пути экскреции билирубина заблокированы, происходит его утечка в кровь, поэтому в крови больных повышена концентрация конъ-югированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет.
Наследственные нарушения метаболизма билирубина
Известно несколько заболеваний, при которых желтуха вызвана наследственными нарушениями метаболизма билирубина.
Примерно у 5% населения диагностируют наследственную желтуху, вызванную генетическими нарушениями в структуре белков и ферментов, ответственных за транспорт (захват) непрямого билирубина в печень и его конъюгацию с глюкуроновой кислотой. Эта патология наследуется по аутосомнодоминантному типу. В крови больных повышена концентрация непрямого билирубина.
Известно 2 типа наследственных желтух, обусловленных нарушением реакции глюкуронирования в печени - образования прямого билирубина.
Для первого типа характерно полное отсутствие УДФ-глюкуронилтрансферазы. Заболевание наследуется по аутосомно-рецессивному типу. Введение фенобарбитала, индуктора УДФглюкуронилтрансферазы, не приводит к снижению уровня билирубина. Дети умирают в раннем возрасте изза развития билирубиновой энцефалопатии.
Для второго типа характерно снижение активности (недостаточности) УДФ-глюкуронилтрансферазы, гипербилирубинемия происходит за счѐт непрямого билирубина. Желтуха хорошо поддаѐтся лечению фенобарбиталом.
Нарушение активного транспорта образованных в клетках печени билирубинглюкуронидов в жѐлчь характерно для желтухи, наследуемой по аутосомно-доминантному типу. Проявляется гипербилирубинемией за счѐт прямого билирубина и билирубинурией (в моче определяется прямой билирубин).
Семейная гипербилирубинемия новорождѐнных связана с наличием конкурентных ингибиторов конъюгации билирубина (эстрогенов, свободных жирных кислот) в материнском молоке. При грудном вскармливании ингибиторы конъюгации билирубина обнаруживают в сыворотке крови ребѐнка. Такая гипербилирубинемия была названа транзиторной. Гипербилирубинемия исчезает при переводе ребѐнка на искусственное вскармливание. Не поддающаяся лечению гипербилирубинемия приводит к развитию билирубиновой энцефалопатии и ранней смерти.
95. Метаболизм эндогенных и чужеродных токсичных веществ. Основные этапы обезвреживания ксенобиотиков. Фаза конъюгации. Схемы реакций коньюгации с ФАФС и УДФглюкуроновой кислотой. Обезвреживание продуктов гниения аминокислот в кишечнике.
Обезвреживание большинства ксенобиотиков происходит путѐм химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жѐлчью в кишечник и затем удаляются с фекалиями.
Сисгема обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован.
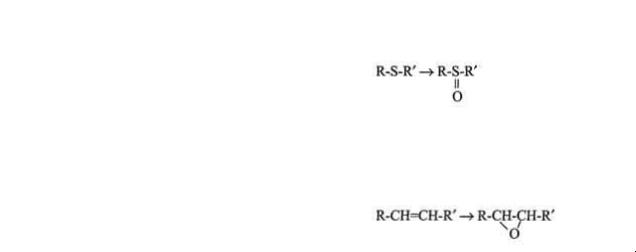
Микросомальные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования .
В мембранах ЭР практически всех тканей локализована сисгема микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырѐк - микросому, отсюда и название - микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ.
Возможные модификации ксенобиотиков в первой фазе обезвреживания
Превращения ксенобиотиков (первая фаза) |
Схема реакции |
|
|
Гидроксилирование |
RH → ROH |
|
|
Окисление по атому серы (сульфоокисление) |
|
|
|
Окислительное дезаминирование |
RNH2 → R=O + NH3 |
|
|
Дезалкилирование по азоту, кислороду, сере |
RNHCH3 → RNH2 + H2C=O |
|
ROCH3 → ROH + H2CO |
|
RSCH3 → RSH + H2CO |
Эпоксидирование |
|
|
|
В метаболизме ксенобиотиков могут принимать участие ферменты почек, лѐгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации.
Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
Б. Конъюгация - вторая фаза обезвреживание веществ
Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков.
1. Участие трансфераз в реакциях конъюгации
Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы
Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления .
В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы
Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам .
Реакция с участием сульфотрансферазы в общем виде записывается так:
ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы
Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жѐлчных кислот, продуктов ПОЛ.
Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH) .
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединѐн к цис-теину карбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
путѐм конъюгации субстрата R с глутатионом (GSH):
R + GSH → GSRH,
в результате нуклеофильного замещения:
RX + GSH → GSR + НХ,
восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
В реакции: ООН - гидропероксидная группа, GSSG - окисленный глутатион.
Система обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционноспособны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма .
ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество липофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
Ацетилтрансферазы, метилтрансферазы
Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов. Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2 и SH-группы ксенобиотиков.
2. Роль эпоксидгидролаз в образовании диолов
Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксидгидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы (рис. 12-8). Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков (см. раздел 16). Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую.
Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот.
Образование и обезвреживание n-крезола и фенола
Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путѐм разрушения боковых цепей аминокислот микробами (рис. 12-9).
Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола и крезола может происходить путѐм конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфе-раза (рис. 12-10).
Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФглюкуронилтрансферазы (рис. 12-11). Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике.
Образование и обезвреживание индола и скатола
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.
Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина .
Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана (рис. 12-13).
Обезвреживание бензойной кислоты
Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени (рис. 12-14). Скорость этой реакции отражает функциональное состояние печени.
В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) - проба Квика.
96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
Дыхательный пигмент, содержащийся в эритроцитах, с помощью которого осуществляется транспорт молекулярного кислорода из легких к тканям. Относится к сложным белкам - хромопротеидам. Молекула гемоглобина состоит из двух частей: простетической группы (гема), в состав которой входит атом железа, и белка типа альбуминов - глобина. На долю гема приходится 4 % молекулы гемоглобина, а глобина - 96 %. Гем относится к порфиринам, он содержит 4 пирроловые группы, соединенные в центре атомом железа. При потере железа гем превращается в гематопорфирин. Как в оксигемоглобине, так и в редуцированном гемоглобине железо находится в двухвалентной закисной форме. Трехвалентная (окисная) форма железа, не способная переносить молекулярный кислород, может образовываться при окислении в метгемоглобин. При разрушении эритроцитов (гемоглобина) в конечном счете в печени образуются желчные пигменты - билирубин и биливердин; в течение суток 3,6 г гемоглобина превращается в желчные пигменты.
В капиллярах легких гемоглобин (гем) вступает с кислородом в непрочное соединение, образуя оксигемоглобин, а в капиллярах тканей происходит отщепление кислорода и восстановление гемоглобина. Последний вновь легко вступает в соединение с кислородом. Нарушение дыхательной функции крови может наблюдаться при уменьшении количества гемоглобина, эритроцитов в крови (анемии) и изменении качества гемоглобина: образовании карбоксигемоглобина (отравлении окисью углерода), метгемоглобина (отравлении гемолитическими ядами) сульфгемоглобина.
Типы нормального гемоглобина
С помощью физико-химических методов исследования (электрофорез, хроматография) удалось установить неоднородность человеческого гемоглобина, существование различных его типов как в нормальных, так и в патологических условиях. В настоящее время известны три формы нормального гемоглобина:
Примитивный гемоглобин (гемоглобин Р)
Это гемоглобин, который может быть обнаружен у трехсантиметрового зародыша, характеризуется высокой щелочной резистентностью и малой электрофоретической подвижностью. Находится в
эритроцитах зародыша до 18 - недельного возраста (в основном между 7 - й и 12 - й неделями), затем сменяется фетальным гемоглобином.
Фетальный гемоглобин (гемоглобин F)
Представляет собой основную массу гемоглобина с 9 - 13 недельного возраста эмбриона. После третьего месяца - основной гемоглобин плода. Затем содержание его постепенно уменьшается за счет образования с 13 - й недели гемоглобина А. К моменту рождения гемоглобина F остается около 20 %, а 80 % приходится на гемоглобин А. К 4 - 5 месяцу жизни гемоглобина F остается всего 1 - 2 %. Существует метод цитологической дифференцировки гемоглобина F путем обработки мазка крови лимоннокислофосфатной буферной смесью с рН = 3,4. В этих условиях эритроциты, содержащие преимущественно гемоглобин А, подвергаются гемолизу и представляются на препарате в виде теней (стром). Эритроциты, в которых преобладает гемоглобин F, оказываются резистентными и контрастно окрашиваются.
Гемоглобин взрослых (гемоглобин А)
Представляет основную массу гемоглобина взрослых людей. С помощью электрофореза на крахмале установлено наличие нескольких фракций гемоглобина А:
гемоглобин A1 (основная фракция, на долю которой приходится 96 - 98 % всей массы гемоглобина).
гемоглобин A2 (2 - 5 %).
гемоглобин A3 (содержание менее 1 %).
Содержание гемоглобина F в крови взрослого человека составляет 1 - 2 %. Повышение этих величин возможно в условиях патологии. Преобладание того или иного типа гемоглобина совпадает во времени с периодами эмбрионального кроветворения: гемоглобин Р характерен для периода желточного кроветворения, гемоглобин F - для печеночного, гемоглобин А - для периода костномозгового кроветворения.
Аномальные гемоглобины
Наличие в эритроцитах людей аномальных или патологических гемоглобинов определяет состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии. Это наследственные аномалии кроветворения, при которых молекулы патологических гемоглобинов имеют измененную структуру, поэтому подобные заболевания относятся к группе так называемых молекулярных болезней. Аномальные гемоглобины различаются своими физико - химическими свойствами (электрофоретической подвижностью, резистентностью к щелочам, растворимостью, изоэлектрической точкой), а также по молекулярной структуре глобиновой части (по одному из пептидов, в котором изменена последовательность аминокислот). Появление аномальных гемоглобинов объясняется мутационной теорией, передача потомкам аномального гена осуществляется по законам наследственности. У гетерозиготных особей (Аа) заболевание отсутствует или обнаруживаются субклинические признаки, у гомозиготных (от брака гетерозиготных особей) наблюдается развитие тяжелых анемий гемолитического типа. В настоящее время установлено более 200 аномальных гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О, Р, Q и других, а также возможные их комбинации (SC, SD и др.). На XVI Международном конгрессе гематологов (Япония, 1976 г.) сделаны сообщения о новых аномальных гемоглобинах: Hb Beth (Nagel, США), Hb Austin (Moo-Peen, США), Hb Djelfa (Labie, Франция), Hb Hrosaki (Ohba, Япония), Hb Waco (Moo-Peen, США).
Гемоглобинозы в гетерозиготной и гомозиготной форме имеют распространение в экваториальной Африке, странах, омываемых Средиземным морем, на Аравийском полуострове, в Южной Индии, на острове ШриЛанка, в Юго-Восточной Азии, Южном Китае, южных районах США. Причину появления аномальных гемоглобинов объясняет малярийная гипотеза, согласно которой мутации в гене, контролирующем образование гемоглобина, возникли в странах с широким распространением тропической малярии. Было установлено, что наличие аномального гена в гетерозиготной форме повышает устойчивость людей к заболеванию, создает иммунитет к малярии, так как изменения молекулы гемоглобина препятствуют использованию его малярийным плазмодием.
Гемоглобин S
Отличается от гемоглобина А строением четвертого пептида, в котором на шестом месте вместо глутаминовой кислоты находится электрически нейтральный валин. Гемоглобин S менее растворим,
