
- •3. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
- •5.Конформация петидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
- •7.Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
- •9.Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация.
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •1. Методы разрушения тканей и экстракции белков
- •2. Методы очистки белков
- •3. Очистка белков от низкомолекулярных примесей
- •11.Конформационная лабильность белков. Денатурация, признаки и факторы ее вызывающие. Защита от денатурации специализированными белками теплового шока (шаперонами).
- •12. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •13. Иммуноглобулины, классы иммуноглобулинов, особенности строения и функционирования.
- •14. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды. Классификация и номенклатура ферментов, примеры.
- •1. Оксидоредукпшзы
- •2.Трансферты
- •V. Механизм действия ферментов
- •1. Формирование фермент-субстратного комплекса
- •3. Роль активного центра в ферментативном катализе
- •1. Кислотно-основной катализ
- •2. Ковалентный катализ
- •16. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •17. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •18. Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов.
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •20. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •21. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
- •22. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
- •23. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •24. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •25. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •28. Первичная структура нуклеиновых кислот. Днк и рнк–черты сходства и различия состава, локализации в клетке, функции.
- •29. Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
- •30. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •32. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •33. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •34. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •35. Транскрипция Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса. Элонгация, терминация транскрипции.
- •36. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •37. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры).
- •1. Теория оперона
- •2. Индукция синтеза белков. Lac-оперон
- •3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
- •39. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •41. Фолдинг белков. Ферменты. Роль шаперонов в фолдинге белка. Фолдинг белковой молекулы с помощью шаперониновой системы. Болезни, связанные с нарушением фолдинга белка – прионовые болезни.
- •42. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •43. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •44. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •45. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •47. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния.
- •48. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •3. Жидкостностъ мембран
- •1. Структура и свойства липидов мембран
- •51. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Мембранные рецепторы
- •52. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза атф.
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Строение атф-синтазы и синтез атф
- •3.Коэффициент окислительного фосфорилирования
- •4.Дыхательный контроль
- •56. Образование активных форм кислорода (синглетный кислород, пероксид водо-рода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
- •57. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1) Инициация: образование свободного радикала (l•)
- •2) Развитие цепи:
- •3) Разрушение структуры липидов
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •59. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •1. Последовательность реакций цитратного цикла
- •60. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
- •61. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
- •Методы определение глюкозы в крови
- •63. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
- •1. Этапы аэробного гликолиза
- •64. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
- •1. Реакции анаэробного гликолиза
- •66. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
- •68. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
- •2. Агликогенозы
- •69. Липиды. Общая характеристика. Биологическая роль. Классификация липидов.Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы..
- •72. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метаболизма жира.
- •73. Распад жирных кислот в клетке. Активация и перенос жирных кислот в митохондрии. Β-окисление жирных кислот, энергетический эффект.
- •74. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •2. Регуляция синтеза жирных кислот
- •75. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете.
- •76. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •Фонд холестерола в организме, пути его использования и выведения.
- •1. Механизм реакции
- •2. Органоспецифичные аминотрансферазы ант и act
- •3. Биологическое значение трансаминирования
- •4. Диагностическое значение определения аминотрансфераз в клинической практике
- •1. Окислительное дезаминирование
- •81. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •3. Неокислительное дезамитровате
- •82. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •110. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина. Основные белки миофибрилл
- •111. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения.
- •114. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
- •115. Медиаторы нервной системы: ацетилхолин, катехоламины, серотонин, γ-аминомасляная кислота, глицин, глутамат, гистамин. Физиологически активные пептиды мозга.
- •Рецепторы гистамина[править | править исходный текст]
3. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование -
471


заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
4. Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности ACT и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз по сравнению с нормой, a ACT - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
80. Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминирования. Окислительное дезаминирование. Оксидазы L-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7.
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования,
472
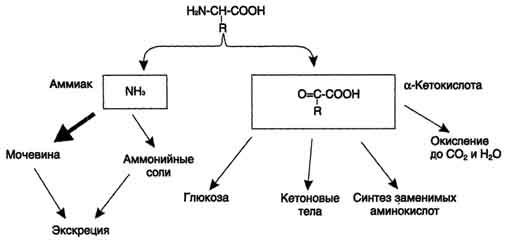
Рис. 9-7. Судьба продуктов дезаминирования аминокислот.
в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
окислительное;
непрямое (трансдезаминирование);
неокислительное;
внутримолекулярное.
