- •3. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
- •5.Конформация петидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
- •7.Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
- •9.Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация.
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •1. Методы разрушения тканей и экстракции белков
- •2. Методы очистки белков
- •3. Очистка белков от низкомолекулярных примесей
- •11.Конформационная лабильность белков. Денатурация, признаки и факторы ее вызывающие. Защита от денатурации специализированными белками теплового шока (шаперонами).
- •12. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •13. Иммуноглобулины, классы иммуноглобулинов, особенности строения и функционирования.
- •14. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды. Классификация и номенклатура ферментов, примеры.
- •1. Оксидоредукпшзы
- •2.Трансферты
- •V. Механизм действия ферментов
- •1. Формирование фермент-субстратного комплекса
- •3. Роль активного центра в ферментативном катализе
- •1. Кислотно-основной катализ
- •2. Ковалентный катализ
- •16. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •17. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •18. Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов.
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •20. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •21. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
- •22. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
- •23. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •24. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •25. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •28. Первичная структура нуклеиновых кислот. Днк и рнк–черты сходства и различия состава, локализации в клетке, функции.
- •29. Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
- •30. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •32. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •33. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •34. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •35. Транскрипция Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса. Элонгация, терминация транскрипции.
- •36. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •37. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры).
- •1. Теория оперона
- •2. Индукция синтеза белков. Lac-оперон
- •3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
- •39. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •41. Фолдинг белков. Ферменты. Роль шаперонов в фолдинге белка. Фолдинг белковой молекулы с помощью шаперониновой системы. Болезни, связанные с нарушением фолдинга белка – прионовые болезни.
- •42. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •43. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •44. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •45. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •47. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния.
- •48. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •3. Жидкостностъ мембран
- •1. Структура и свойства липидов мембран
- •51. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Мембранные рецепторы
- •52. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза атф.
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Строение атф-синтазы и синтез атф
- •3.Коэффициент окислительного фосфорилирования
- •4.Дыхательный контроль
- •56. Образование активных форм кислорода (синглетный кислород, пероксид водо-рода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
- •57. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1) Инициация: образование свободного радикала (l•)
- •2) Развитие цепи:
- •3) Разрушение структуры липидов
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •59. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •1. Последовательность реакций цитратного цикла
- •60. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
- •61. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
- •Методы определение глюкозы в крови
- •63. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
- •1. Этапы аэробного гликолиза
- •64. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
- •1. Реакции анаэробного гликолиза
- •66. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
- •68. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
- •2. Агликогенозы
- •69. Липиды. Общая характеристика. Биологическая роль. Классификация липидов.Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы..
- •72. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метаболизма жира.
- •73. Распад жирных кислот в клетке. Активация и перенос жирных кислот в митохондрии. Β-окисление жирных кислот, энергетический эффект.
- •74. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •2. Регуляция синтеза жирных кислот
- •75. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете.
- •76. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •Фонд холестерола в организме, пути его использования и выведения.
- •1. Механизм реакции
- •2. Органоспецифичные аминотрансферазы ант и act
- •3. Биологическое значение трансаминирования
- •4. Диагностическое значение определения аминотрансфераз в клинической практике
- •1. Окислительное дезаминирование
- •81. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •3. Неокислительное дезамитровате
- •82. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •110. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина. Основные белки миофибрилл
- •111. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения.
- •114. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
- •115. Медиаторы нервной системы: ацетилхолин, катехоламины, серотонин, γ-аминомасляная кислота, глицин, глутамат, гистамин. Физиологически активные пептиды мозга.
- •Рецепторы гистамина[править | править исходный текст]
Фонд холестерола в организме, пути его использования и выведения.
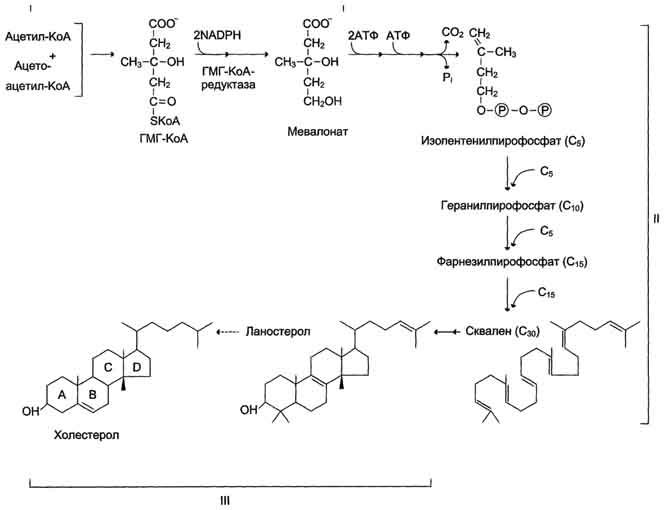
Рис. 8-66. Синтез холестерола. С5 - изопентенилпирофосфат; С1 - Фарнезилпирофосфат. Все атомы углерода холестерола происходят из ацетил-КоА. Сквален - углеводород линейной структуры - превращается ферментом циклазой в ланостерол, содержащий 4 конденсированных кольца и гидроксильную группу. Ланостерол через ряд последовательных реакций превращается в холестерол (I, II, III - этапы синтеза).
Этерификация холестерола
В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул - эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА:холестеролаиилтрансферазой).
Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин:холестеролацилтрансфераза). Эфиры холестерола - форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Регуляция синтеза холестерола
Регуляция ключевого фермента синтеза холестерола (ГМГ-КоА-редуктазы) происходит разными способами.
Фосфорилирование/дефосфорилирование ГМГ-КоА-редуктазы (рис. 8-67). При увеличении соотношения инеулин/глюкагон этот фермент дефосфорилируется и переходит в активное состояние. Действие инсулина осуществляется через 2 фермента:
фосфатазу киназы ГМГ-КоА-редуктазы, которая превращает киназу в неактивное дефосфорилированное состояние;
фосфатазу ГМГ-КоА-редуктазы путём превращения её в дефосфорилированное активное состояние. Результатом этих реакций служит образование дефосфорилированной активной формы ГМГ-КоА-редуктазы.
Следовательно, в абсорбтивный период синтез холестерола увеличивается. В этот период увеличивается и доступность исходного субстрата для синтеза холестерола - ацетил-КоА (в результате приёма пищи, содержащей углеводы и жиры, так как ацетил-КоА образуется при распаде глюкозы и жирных кислот).
В постабсорбтивном состоянии глюкагон через протеинкиназу А стимулирует фосфорилирование ГМГ-КоА-редуктазы, переводя её в неактивное состояние. Это действие усиливается тем, что одновременно глюкагон стимулирует фосфорилирование и инактивацию фосфатазы ГМГ-КоА-редуктазы и фосфорилирование киназы ГМГ-КоА-редуктазы, удерживая, таким образом, ГМГ-КоА-редуктазу в фосфорилированном неактивном состоянии. В результате синтез холестерола в постабсорбтивном периоде и при голодании ингибируется.
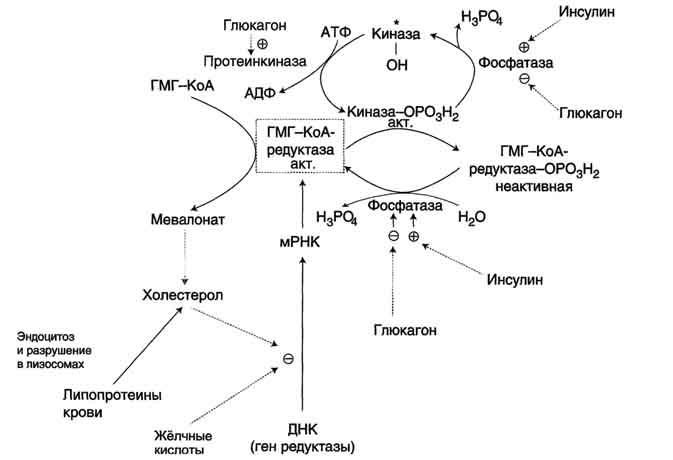
Рис. 8-67. Регуляция активности ГМГ-КоА-редуктазы в печени. Холестерол и жёлчные кислоты снижают скорость транскрипции и, таким образом, синтез фермента. Инсулин стимулирует дефосфорилирование, а глюкагон - фосфорилирование ГМГ-КоА-редуктазы. Инсулин активирует 2 фосфатазы: киназы ГМГ-КоА-редуктазы* и фосфатазу, дефосфорилирующую непосредственно ГМГ-КоА-редуктазу. Глюкагон стимулирует фосфорилирование и инактивацию 2 фосфатаз и фосфорилирование и активацию киназы ГМГ-КоА-редуктазы.
Ингибирование синтеза ГМГ-КоА-редуктазы. Конечный продукт метаболического пути (холестерол) снижает скорость транскрипции гена ГМГ-КоА-редуктазы, подавляя таким образом собственный синтез. В печени активно идёт синтез жёлчных кислот из холестерола, поэтому и жёлчные кислоты (как конечные продукты синтеза) подавляют активность гена ГМГ-КоА-редуктазы (рис. 8-67). Так как молекула ГМГ-КоА-редуктазы существует около 3 ч после синтеза, то ингибирование синтеза этого фермента конечным продуктом метаболического пути (холестеролом) является эффективной регуляцией.
77. Роль липопротеинов низкой и высокой плотности (ЛПНПи ЛПВП) в обмене холестерина. Биохимические основы развития атеросклероза Количественное определение общего холестерина в сыворотке крови. Клиническое значение определения.
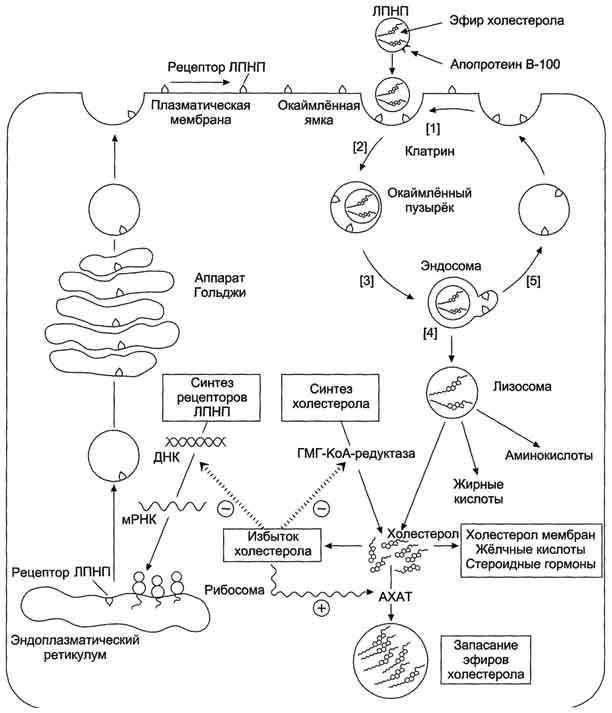
Синтез рецепторов ЛПНП и их последующие превращения. После взаимодействия ЛПНП с рецептором (1) окаймлённые ямки вместе с рецептором и ЛПНП поглощаются по механизму эндоцитоза (2). В образовавшейся эндосоме снижается значение рН за счёт работы протонного насоса, использующего энергию АТФ. При снижении рН рецепторы ЛПНП отделяются от ЛПНП (3), и большая часть рецепторов возвращается в плазматическую мембрану (5). Таким образом, рецепторы ЛПНП могут многократно использоваться клеткой. После удаления рецептора ЛПНП эндосомы сливаются с лизосомами, и гидролитические ферменты лизосом расщепляют компоненты эндосом (4). В результате освобождается холестероп, который может, быть использован для формирования структуры мембран, в клетках печени для синтеза жёлчных кислот, в клетках эндокринной системы для синтеза стероидных гормонов.
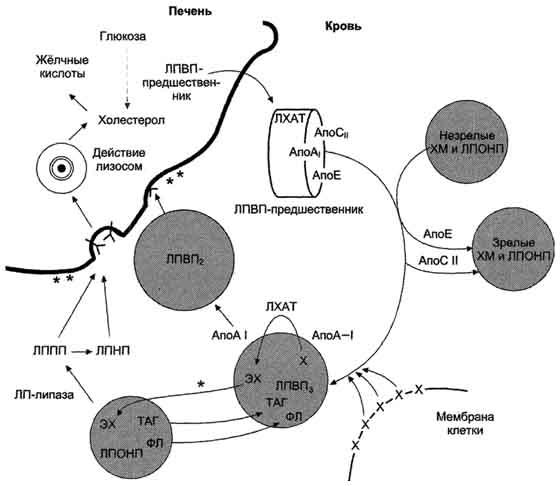
Рис. 8-70. Роль ЛПВП и ЛПНП в обратном транспорте холестерола в печень. Незрелые ЛПВП-предшественники обогащаются холестеролом, который поступает в ЛПВП при участии фермента ЛХАТ с поверхности клеток и других липопротеинов, содержащих холестерол. Незрелые ЛПВП, обогащаясь холестеролом, превращаются в ЛПВП3 - частицы сферической формы и большего размера. ЛПВП3 обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП при участии "белка, переносящего эфиры холестерола"*. ЛПВП3 превращается в ЛПВП2, размер которых увеличивается за счёт накопления триацилглицеролов. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые доставляют холестерол в печень. Часть ЛПВП захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-I. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой**, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. X - холестерол, ЭХ - эфиры холестерола, ФЛ - фосфолипиды, ЛХАТ - лецитин-холестеролацилтрансфераза, А-I - апопротеин, активатор ЛХАТ.
Молекулярные механизмы патогенеза атеросклероза
Развитие атеросклероза проходит несколько стадий .
Процесс начинается с повреждения эндотелия сосудов, причём повреждение может иметь различные механизмы. Важнейший механизм - повреждение эндотелия за счёт изменённой структуры ЛПНП, например в результате активации свободнорадикального ПОЛ в составе ЛПНП; повреждение провоцируется свободными радикалами, образующимися в процессе метаболизма или поступающими извне. В ходе ПОЛ в ЛПНП изменяется не только структура самих липидов, но и нарушается структура апопротеинов. Окисленные ЛПНП захватываются макрофагами через скевенджер-рецепторы. Этот процесс не регулируется количеством поглощённого холестерола, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются холестеролом и превращаются в "пенистые клетки", которые проникают в субэндотелиальное пространство. Это приводит к образованию жировых полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества "пенистых клеток" происходит повреждение эндотелия сосудов. В норме клетки эндотелия секретируют простагландин I2 (простациклин I2), который ингибирует агрегацию тромбоцитов. При повреждении клеток эндотелия тромбоциты активируются. Во-первых, они секретируют тромбоксан А2 (ТХ А2, который стимулирует агрегацию тромбоцитов, что может привести к образованию тромба в области атеросклеротической бляшки; во-вторых, тромбоциты начинают продуцировать пептид - тромбоцитарный фактор роста, стимулирующий пролиферацию ГМК. ГМК мигрируют из медиального слоя во внутренний слой артериальной стенки и способствуют таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью (коллагеном,
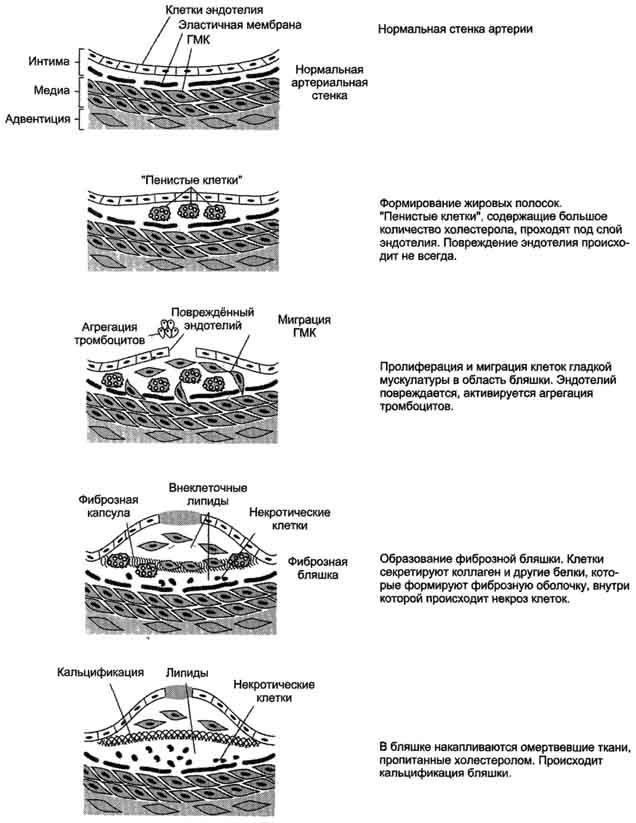
Рис. 8-76. Развитие атеросклеротической бляшки в клетках эндотелия кровеносных сосудов.
эластином); клетки под фиброзной оболочкой некротизируются, а холестерол откладывается в межклеточном пространстве. На этой стадии в центре бляшки образуются даже холестериновые кристаллы. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта. Чаще всего атеросклеротические бляшки развиваются в артериях миокарда, поэтому наиболее распространённое заболевание, развивающееся в результате атеросклероза, - инфаркт миокарда.
Биохимические основы лечения атеросклероза и предупреждения развития инфаркта миокарда
Важным лечебным фактором, снижающим риск развития гиперхолестеролемии и атеросклероза, является гипокалорийная и гипохолестериновая диета. Поступление холестерола с пищей не должно превышать 300 мг/сут .
Холестерол - стероид животного происхождения, поэтому он поступает в организм при употреблении животных жиров и жирного мяса. Растительная пища не содержит холестерола, поэтому у людей среднего и старшего возраста она должна составлять основу рациона.
К лечебным и профилактическим факторам относят обогащение пищи полиеновыми жирными кислотами семейства ω-3, уменьшающими риск тромбообразования. Ненасыщенные жирные кислоты способствуют более быстрому выведению холестерола из организма, хотя механизм этого явления до конца не выяснен. В то же время доказано, что полиеновые кислоты подавляют синтез тромбоцитарного фактора роста и таким образом замедляют развитие атеросклеротической бляшки.
Витамины С, Е, А, обладающие антиоксидантными свойствами, ингибируют перекисное (свободнорадикальное) окисление липидов в ЛПНП и поддерживают нормальную структуру липидов ЛПНП и их метаболизм.
Однако меры по исправлению диеты недостаточны при лечении выраженной гиперхолестеролемии и атеросклерозе. Лечение гиперхолестеролемии, как правило, комплексное.
Один из принципов лечения - "размыкание" цикла энтерогепатической циркуляции жёлчных кислот. Для этого используют лекарства типа холестирамина - полимера, который в кишечнике адсорбирует жёлчные кислоты, выделяется с фекалиями и таким образом уменьшает возврат жёлчных кислот в печень. В печени увеличивается
Таблица 8-11. Основы диеты, снижающей количество холестерола и жиров в организме человека
|
Проводимое вмешательство |
Количество холестерола и жиров |
Источники питания |
|
Снижение потребления общего количества жиров Снижение насыщенных жиров |
<30% суточной энергии <7-10% |
Уменьшить потребление масла, маргарина, цельного молока, мороженого, жирных сыров, жирного мяса, шоколада |
|
Использование пищи с высоким содержанием белка |
|
Рыба, цыплята и индейка (без шкурки), телятина |
|
Использование сложных углеводов, клетчатки, содержащейся во фруктах и овощах |
~ 35-40 г/сут клетчатки и пектинов растений |
Фрукты, овощи, бобы и соя, неочищенные зерновые продукты |
|
Снижение холестерина в пище |
<300 мг/день |
Не более 2 яиц в неделю, печень 2 раза в месяц |
|
Умеренное увеличение использования масел, содержащих полиеновые жирные кислоты |
Мононенасыщенные (10-1 5% энергии) Полиненасыщенные (7-10% энергии) |
Подсолнечное, кукурузное, оливковое масло |
захват холестерола из крови для синтеза новых жёлчных кислот. Препараты типа холестирамина называют секвестрантами жёлчных кислот.
Наиболее эффективные препараты, применяемые при лечении атеросклероза, - ингибиторы ГМГ-КоА-редуктазы. Эти препараты - антибиотики, например мевакор, в печени трансформируются в активную форму и эффективно ингибируют регуляторный фермент биосинтеза холестерола. Такие препараты могут практически полностью подавить синтез собственного холестерола в организме. В этих условиях печень увеличивает захват холестерола из крови. Для этого в клетках печени почти вдвое увеличивается синтез белков-рецепторов Л ПНП и, соответственно, увеличивается захват ЛПНП из крови. Таким образом концентрация холестерола в крови даже у больных с гетерозиготной формой семейной гиперхолестеролемии может быть доведена практически до нормы.
Лекарственные препараты - фибраты (клофибрат, фенофибрат) - ускоряют катаболизм ЛПОНП, активируя ЛП-липазу. Эти препараты также активируют окисление жирных кислот в печени, уменьшая тем самым синтез триацилглицеролов и эфиров холестерола и, как следствие, секрецию ЛПОНП печенью. Клофибрат индуцирует синтез ферментов пероксисом, способных окислять жирные кислоты. Фибраты обычно применяют при сочетании гипертриглицеролемии и гиперхолестеролемии. Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
АБЕЛЛЯ МЕТОД (L. L. Abell) — один из методов количественного определения общего холестерина в сыворотке крови.
Основан на способности эфирной вытяжки холестерина давать с уксусным ангидридом и серной к-той цветную реакцию (реакция Либерманна — Бурхардта), интенсивность к-рой определяется колориметрически.
78. Общая схема источников поступления и путей расходования аминокислот в тканях. Динамическое состояние белков в организме. Причины необходимости постоянного обновления белков организма. «Незаменимые» аминокислоты.
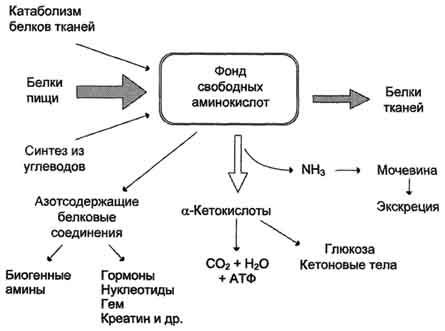
Источники и пути использования аминокислот
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ ОРГАНИЗМА Кажущаяся стабильность химического состава целостного организма является результатом существования определенного равновесия между скоростями синтеза и распада его составляющих. Внедрение в биохимическую и клиническую практику метода меченых атомов позволило доказать, что белки нужны не только растущему, но и сформировавшемуся организму, когда его рост прекратился, т.е. имеются доказательства существования в организме механизма постоянного обновления химических составных частей тела. При нормальных физиологических условиях, как и при патологических состояниях, скорости синтеза и распада специфических веществ определяются, помимо нервно-гормонального влияния, химической природой веществ и внутриклеточной их локализацией. В растущем организме скорость синтеза многих компонентов органов и тканей преобладает над скоростью их распада. Тяжелые изнуряющие болезни, а также голодание, напротив, характеризуются преобладанием скорости катаболизма над скоростью синтеза. Почти все белки тела, включая структурные белки, гемоглобин, белки плазмы и других биологических жидкостей организма, также подвергаются постепенному распаду и синтезу. Например, более половины белков печени, сыворотки крови и слизистой оболочки кишечника подвергается распаду и ресинтезу в течение 10 дней. Медленнее обновляются белки мышц, кожи и мозга.
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н; Для детей незаменимыми также являются аргинин и гистидин.
79. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6. Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови.
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму и анаболизму, а также специфическим реакциям, в результате которых синтезируются биологически активные соединения.
Катаболизм большинства аминокислот начинается с Отщепления α-аминогруппы.Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
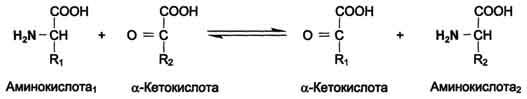
А. Трансаминирование
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр~1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты,за исключением лизина, треонина и пролина.