
- •5.2.3. Виды патологических состояний у человека, связанные
- •1.1. Проявления, механизмы развития и регуляция апоптоза на уровне клетки
- •1.1.2. Многообразие пусковых механизмов апоптоза
- •1.1.3. Пути передачи внутриклеточных сигналов к развитию апоптоза (частные события)
- •1.1.4. Общий путь индукции апоптоза
- •1.1.5. Эндогенные регуляторы апоптоза
- •1.2. Роль апоптоза в многоклеточном организме
- •1.2.1. Апоптоз, процессы формообразования и клеточного гомеостаза на уровне организма
- •1.2.2. Роль апоптоза в иммунных процессах
- •1.3. Место апоптоза в патологии
- •Участие апоптоза а формировании типовых патологических процессов Изменение выраженности апоптоза
- •Повышение вероятности развития злокачественных опухолей
- •1.3.2. Патологические процессы, обусловленные ослаблением апоптоза
- •1.3.3. Патологические процессы,
- •2.1. Словарь сокращений и терминов
- •2.1.3. Цитокины
- •2.1.4. Конкретные иммунологические эффекторные реакции
- •2.2. Определение понятия «иммунитет»
- •2.3. Главные функции иммунной системы
- •2.4.1. Органы лимфопоэза
- •2.4.2. Характеристика лимфоцитов
- •2.5. Гуморальные факторы иммунитета
- •2.6. Стадии развития иммунного ответа
- •2.7. Иммунная подсистема кожи
- •2.8. Иммунная система слизистых оболочек
- •2.9. Патологические процессы с участием иммунной системы
- •2.9.1. Полноценная иммунная система
- •2.9.2. Генетические дефекты в иммунной системе
- •Дефект гуморального звена иммунитета (антитела, комплемент)
- •2.9.2.2. Патологические процессы с участием иммунной системы при общем тяжелом патологическом процессе в организме
- •2.9.3. Иммуностимулирующая терапия, неспецифичная по антигену
- •3.1. Аллергены и аллергенность
- •3.1.1. Номенклатура аллергенов
- •3.1.2. Идентификация и очистка аллергенов
- •3.1.3. Нашивные аллергены как гетерогенная и изменчивая популяция
- •3.2. Иммуноглобулин е:
- •3.2.1. Модель запуска синтеза IgE
- •Связывание аллергена поверхностным иммуноглобулином на в-клетке
- •Процессинг аллергена
- •Активация транскрипции на Запуск.Переключающий специфическом регионе Ig рекомбинации на синтез локуса IgE
- •3.2.2. Сигнал индукции синтеза IgE,
- •3.2.5. Независимая от взаимодействия cd40 с cd154 индукция синтеза IgE
- •3.2.6. Вспомогательные молекулы, усиливающие и сдерживающие влияния
- •Cd28 (т-клетка)
- •Усиление
- •Усиление экспрессии с080 (в-клетка)
- •3.2.7. Избирательность включения тъ2-клеток в IgE-omeem
- •3.2.8. Возможные способы оценки опосредуемого Тп2-клетками аллергического ответа в клинических условиях
- •3.3. Некоторые замечания
- •4.1.1. Классификация
- •4.1.2. Краткие эпидемиологические данные
- •4.1.3. Этиологические факторы канцерогенеза
- •4.1.4. Характерные свойства опухолей
- •4.1.5. Взаимоотношения опухоли и организма
- •4.1.6. Стадии развития
- •4.2.1. Изменения кариотипа
- •4.2.2. Признаки клеточной трансформации в культуре
- •4.2.3. Иммортализация опухолевых клеток
- •4.2.4. Межклеточная кооперация
- •4.3. Молекулярные механизмы опухолевого роста
- •4.3.1. Эндокринная, паракринная и аутокринная регуляция
- •4.3.2. Митогенная «рефлекторная дуга»
- •4.3.3. Клеточный цикл
- •4.3.4. Перенос митогенного сигнала
- •Неактивный Ras
- •I I ядро
- •Мекк мек »► erk
- •4.3.5. Реализация митогенного сигнала
- •4.3.6. Апоптоз
- •4.3.7. Механизмы опухолевой трансформации
- •I Мутантные по р53 клетки I доминируют в опухоли
- •Нормальный эпителий
- •5.1. Феномен стресса
- •5.1.1. Стресс-реакция
- •Стрессор
- •Побочные эффекты стресс-реакции адаптация (восстановление гомеостаза)
- •5.1.2. Стресс-система
- •Периферические и черепные нервы, кровь
- •Стресс-реакция
- •5.1.3. Стресс-лимитирующие системы
- •Стрессор
- •Ограничание высвобождения а и на в цнс и органах
- •I Ограничение cmpecc-реекции и ее повреждающих эффектов I
- •5.1.4. Роль соотношения активностей
- •5.1.5. Адаптивные и повреждающие эффекты стресс-реакции
- •5.2. Эмоциональный стресс и связанные с ним патологические состояния
- •5.2.1. Особенности эмоциональных стрессоров и эмоциональной стресс-реакции
- •5.2.2. Стрессорные патологические состояния и их возможные механизмы
- •5.2.2.1. Роль стресс-системы в формировании эмоционального стресса и патогенезе стрессорных повреждений
- •Субъективная оценка фактора
- •Слабая стресс-реакция или отсутствие стресс-реакции
- •5.2.3. Виды патологических состояний у человека, связанные с эмоциональным стрессом, и их механизмы
- •2 Х е м а 5.7. Патогенез первичного стрессорного повреждения сердца [Meerson f., 1991]
- •Стрессор
- •I | Активация стресс-системы. Стресс-реакция | Действие на сердце избытка катехоламинов и других гормонов. Активация аденилат-циклазы, фосфолипазы с
- •Нарушение функционирования Na -, к*- и Са2*- насосов сарколеммы, Са2* насоса спр
- •5.2.3.1.1. Ишемическая болезнь сердца и инфаркт миокарда
- •Уменьшение периферического сопротивления сосудов
- •5.2.3.1.2. Внезапная сердечная смерть
- •Отличительные признаки
- •Стрессорная аритмическая болезнь сердца
- •5.2.3.1.3. Гипертоническая болезнь
- •IЯзвенное поражение желудка
- •5.2.3.3. Система крови и иммунная система при эмоциональном стрессе
- •Уменьшение синтеза антител
- •5.2.3.4. Психический статус при эмоциональном стрессе и посттравматическое стрессовое расстройство
- •5.2.3.4.1. Нарушения психического статуса
- •5.2.3.4.2. Посттравматическое стрессовое расстройство2
- •5.2.4. Основы предрасположенности и устойчивости к стрессорным повреждениям
- •5.3. Принципы профилактики и коррекции стрессорной патологии
- •5.3.1. Профилактика и коррекция с помощью защитных эффектов адаптации к факторам среды
- •5.3.2. Коррекция с помощью
- •5.3.3. Использование приемов психотерапии при стрессорных психосоматических расстройствах
- •6.1. Характеристика боли
- •6.2. Физиология боли
- •6.2.1. Анатомо-функциональная организация ноцицептивной системы
- •6.2.1.2. Периферические алгогены
- •6.2.1.3. Первое переключение ноцицептивной информации (первичное ноцицептивное реле)
- •6.2.1.6. Обработка ноцицептивной информации в коре больших полушарий
- •6.2.2. Антиноцицептивная система мозга
- •6.3. Патофизиология боли
- •6.3.1. Соматогенные болевые синдромы
- •6.3.1.2. Механизмы развития вторичной гипералгезии
- •6.3.2. Патофизиология нейрогенных болевых синдромов
- •6.3.2.3. Периферические механизмы нейрогенной боли
- •7.1. Современные представления о свертывании крови
- •7.1.1. Механизмы свертывания крови
- •I Сосудистая стенка .
- •|Г* Фосфолипаза Аг
- •3 (Простат
- •I римооксан а2 pgi2
- •7.1.2. Механизмы ингибирования свертывания крови. Фибринолиз
- •7.2. Современные представления о природе тромбозов
- •7.2.1. Основные причины развития тромбозов
- •7.2.2. Лабораторная диагностика вероятности развития тромбозов
- •7.3. Геморрагии
- •7.3.1. Виды и основные причины развития геморрагии
- •7.3.2. Лабораторная диагностика геморрагических состояний
- •7.5. Лекарственная коррекция патологии гемостаза
4.3.6. Апоптоз
Апоптоз (или программируемая клеточная гибель) — широко распространенный биологический феномен клеточного «самоубийства», которое индуцируется либо разнообразными внешними стимулами, либо неразрешимыми «внутренними» конфликтами (например, невозможностью репарации повреждений ДНК). Роль апоптоза велика не только в формообразо
вательных процессах во время эмбриогенеза (формирование органов, замена одних тканей другими, резорбция временных органов и т.д.), но и в поддержании тканевого гомеостаза во взрослом организме. В регуляции тканевого гомеостаза клеточная гибель выполняет функцию, комплементарную митозу. У опухолевых клеток программа клеточной гибели во многих случаях блокирована, что вносит существенный вклад в увеличение массы опухоли.
Феноменология. Существует два типа клеточной гибели: некроз и апоптоз (клеточное «убийство» и «самоубийство» соответственно), различающиеся как индуцирующими эти процессы стимулами, так и механизмом их осуществления.
Некроз — метаболическая катастрофа, вызванная тяжелыми повреждениями клеточных структур. Для него характерно раннее увеличение объема клетки и митохондрий с последующим их автолизом, тогда как внутриядерные нарушения обнаруживаются позднее (таким образом, вектор видимых изменений направлен от периферии клетки к ее центру — ядру).
Апоптоз как явление физиологическое распространен гораздо шире. С его участием проходят морфообразовательные процессы в эмбриогенезе, позитивная и негативная селекция Т- и В-лимфоцитов, индуцированная глюкокортикоидами гибель лимфоцитов, а также гибель клеток при их естественном старении. Усиленный апоптоз ведет к инволюции органа, что встречается и в физиологических условиях (например, молочная железа в постлактационном периоде), и при патологии (например, при дегенеративных заболеваниях центральной нервной системы).
Опухолевые клетки имеют селективное преимущество перед нормальными, поскольку механизм апоптоза у них зачастую дефектен (в частности, о выживании опухолевых клеток в условиях гипоксии см. далее). Кроме того, у многих из них развивается резистентность к различным химиопрепара-там и к облучению, которые индуцируют гибель также по механизму апоптоза. Морфологически апоптоз проявляется вначале в конденсации и маргинации хроматина, уменьшении объема клетки и фрагментации клеточного ядра, в характерной складчатости плазматических мембран (вектор изменений — от центра клетки к периферии). Одним из ключевых моментов апоптоза, знаменующим необратимость процесса, является распад ДНК. Процесс заканчивается фрагментацией клетки с образованием так называемых апоптотических телец, которые быстро фагоцитируются макрофагами или соседними клетками без сопутствующей воспалительной реакции.
Механизмы апоптоза. Прорыв в выяснении механизмов апоптоза у млекопитающих был достигнут в результате изучения весьма, казалось бы, экзотического объекта — нематоды Caenorhabditis elegans, на определенной стадии развития кото
рой в строгой очередности погибает 131 соматическая клетка из 1090 имеющихся [Horvitz, 1986]. Эта оказавшаяся исключительно ценной модель позволила идентифицировать более десятка участвующих в апоптозе генов. В частности, ced-З и ced-4 (cell death abnormal) необходимы для клеточной гибели и при их дефектах клетки не погибают; напротив, ced-9 кодирует белок, предотвращающий апоптоз (его мутации сопряжены с массовой клеточной гибелью). Продукт гена ced-З, как оказалось, является протеазой.
Принципиальное значение имел тот факт, что механизмы апоптоза чрезвычайно консервативны и сохраняют свои фундаментальные черты у весьма далеких в эволюционном отношении организмов. Это обстоятельство позволило идентифицировать у млекопитающих (и, в частности, у человека) гены, гомологичные генам апоптоза у нематоды.
Гомологи ced-9 — члены семейства bcl-2. У млекопитающих гомологами ced-9 являются члены семейства bcl-2 [ген bcl-2 впервые обнаружен в участке хромосомной транслокации t(14; 18) в В-клеточной фолликулярной лимфоме]. Его роль антиапоптическая, он предотвращает гибель клеток. Белок, кодируемый bcl-2 (мол. масса 26 кДа), локализован преимущественно в мембране митохондрий и не содержит последовательностей с уже известными каталитическими или иными функциями. Фосфорилирование серина в Bcl-2 инактивирует его и может, таким образом, играть регуляторную роль.
Механизм апоптоза у млекопитающих неизмеримо сложнее, чем у нематод (анализ генов последних был лишь начальным, хотя и очень важным толчком). Так, у bcl-2 млекопитающих имеется множество гомологов, образующих семейство и по-разному участвующих в программируемой клеточной гибели. Все белки этого семейства объединены общностью структуры — присутствием функционально важных областей ВН1, ВН2 и ВИЗ (Bcl-2 homology regions 1, 2 и 3), но могут быть подразделены на две группы соответственно их антиапоптическому (Bcl-2, BHRF1, MCL-1, Bcl-xL) или про-апоптическому (Вах, Bcl-xs, Bak) действию. Белок-супрессор р53 активирует Ьах и ингибирует bcl-2-гены, что, возможно, является механизмом апоптоза, индуцируемого у клеток с поврежденной ДНК на границе G1/S (см. выше). Вместе с тем необходимо заметить, что индукция апоптоза может происходить как опосредованно через р53, так и независимо от него.
Члены семейства способны к гомо- и гетеродимеризации. Так, Вах образует гомодимеры и гетеродимеры с Bcl-2, Bcl-xL и другими белками. Комплексирование проапоптических и антиапоптических белков ведет, по-видимому, к их взаимному «погашению», в результате чего конечный результат (индукция апоптоза или, напротив, его отмена) определяется «балан-
Схема 4.3. Взаимоотношения семейства Bcl-2 и семейства ICE-подобных протеаз при индукции апоптоза
Сигнал выживания
Сигнал гибели

т

'Активация ICE-подобных протеаз
1
![]()
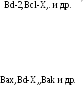
Расщепление
специфических
субстратов
(ламины, PARP,
RNP и др.)
Апоптоз
Ламины — белки, составляющие основу ядерной мембраны; PARP — poly (ADP-ribose) polymerase, фермент, участвующий в репарации ДНК; RNP — рибонуклеопротеидные комплексы. А — активация; И — ингибирова-ние.
сом сил». Отношение Bcl-2 к Вах определяет чувствительность данной клетки к апоптическим стимулам (в связи с этим говорят о реостате Bcl-2/Вах). Поскольку гибель опухолевых клеток под воздействием химиопрепаратов и облучения происходит по механизму апоптоза, то резистентность опухолей к этим воздействиям может быть обусловлена повышенной экспрессией bcl-2.
Гомологи ced-З — члены семейства протеаз. У млекопитающих гомологом гена нематоды ced-З является ген специфической цистеиновой протеазы ICE, расщепляющей предшественник интерлейкина-ip. Его искусственная (в условиях генно-инженерных экспериментов) гиперэкспрессия в культивируемых клетках вызывает апоптоз. iCE функционирует в виде тетрамера двух субъединиц размером 10 и 20 кДа и имеет несколько гомологов с разной субстратной специфичностью. Хотя участие ICE в апоптозе несомненно, мишени ее протео-литической активности пока не определены.
Функциональные взаимоотношения между семейством Bcl-2 и семейством ICE-подобных протеаз в настоящее время не установлены окончательно, хотя в апоптических сигнальных путях первые явно стоят «выше по течению» (схема 4.3).
Fas/APO-1 (CD95) — рецепторы специфических индукторов апоптоза. Большое функциональное значение имеет механизм апоптоза, индуцируемого через специфические рецепторы — CD95 (трансмембранный белок-рецептор размером 45 кДа, который при связывании со специфическим лигандом или антителами передает сигнал к апоптозу) и TNF-R (tumor necrosis factor receptor — рецептор фактора некроза опухолей).
Эти рецепторы, объединяемые сходством внеклеточных доменов, входят в состав большого семейства.
Лигандами (молекулами, специфически взаимодействующими с рецепторами TNF-R и CD95), являются соответственно TNF и CD95-L, которые представляют собой трансмембранные белки, но могут функционировать и в растворимой, «свободной» форме. Особенно интересен с онкологической точки зрения TNF — цитокин, производимый многими клетками (макрофагами, моноцитами, лимфоидными клетками, фибробластами) в ответ на воспаление, инфекцию и другие стрессорные воздействия. Он индуцирует широкий спектр иногда противоположных по направленности реакций, включая лихорадку, шок, некроз опухоли, анорексию; индуцирует иммунорегуляторные сдвиги, клеточное размножение, дифференцировку и апоптоз. Эффекты TNF опосредованы через два рецептора (трансмембранные белки размером 55 и 75 кДа, TNF-RI и TNF-RI I соответственно), по крайней мере один из которых присутствует во всех клетках.
Взаимодействие трех молекул TNF с TNF-RI «сшивает» рецепторы с образованием тримера, что запускает каскад последующих разветвленных реакций, ответственных за плейо-тропные эффекты TNF. Их непосредственный итог зависит от того, какие именно сигнальные белки окажутся рекрутированными в состав первичного комплекса. Тримеризация рецептора дает начало самосборке под плазматической мембраной сложной конструкции, существующей благодаря белок-белковому взаимодействию «стыковочных узлов», получивших название «доменов смерти» (death domains), — специфической последовательности, присутствующей во внутриклеточной части рецептора и абсолютно необходимой для передачи цито-токсического сигнала (рис. 4.15).
В комплекс рекрутируются белки TRADD (TNFRI — associated death domain protein), FADD/MORT1 (Fas — associated protein with death domain) и RIP (receptor — interacting protein), С-концевые участки которых содержат «домены смерти» (RIP, кроме того, является серин/треониновой киназой). В комплексе также участвуют TRAF1 и TRAF2 (TNFR — associated proteins 1 и 2). В свою очередь N-концевой домен FADD взаимодействует с ICE-подобной протеазой MACH (MORT1 — associating CED homolog), известной и как FLICE (FADD-like ICE), непосредственно запускающей апоптический протеаз-ный каскад. В то время как FADD включает механизм апоптоза, другие участники комплекса индуцируют иные эффекты: TRAF2 и RIP активируют NF-кВ (транскрипционный фактор плейотропного действия, оказывающий антиапоптическое действие) и JNK (см. выше).
Активация комплекса NF-кВ происходит своеобразно: фосфорилирование ингибирующей субъединицы 1кВ приво-

Анти-апоптоз
JNK
Рис. 4.15. Модель рекрутирования сигнальных молекул при активации TNF-RI, индуцирующей апоптоз и другие клеточные реакции. Вызываемая лигандом тримеризация TNF-RI ведет к рекрутированию TRADD (путем связывания с цитоплазматическим доменом рецептора через «домены смерти» — полностью заштрихованные участки). TRADD служит платформой для связывания двух дополнительных белков, обладающих «доменами смерти», — RIP и FADD, а также TRAF2, который не обладает этим доменом; в последнем случае взаимодействуют N-концевая последовательность TRADD и С-кон-цевая последовательность TRAF2 (частично заштрихованный участок). В то время как FADD индуцирует апоптический протеазный каскад, TRAF2 и RIP активируют транскрипционный фактор широкого спектра действия NF-kZ? (оказывает антиапоптическое действие) и киназный каскад. Пояснения в тексте.
дит к ее высвобождению из цитоплазматического комплекса, включающего также ДНК-связывающие субъединицы р50 и р65 (последняя известна также как Rel-A). Гетеродимер p50/Rel-A транслоцируется затем в ядро клетки, где связывается со специфической последовательностью ДНК.
Таким образом, тримеризация TNF-RI ведет к активации по крайней мере трех сигнальных путей, что объясняет разнообразие биологических эффектов TNF.
