
- •Лекция 1
- •1.1. Задачи и разделы физической химии
- •1.2. Основные термодинамические понятия и определения
- •1.3. Первый закон термодинамики
- •1.4. Работа рассширения при различных процессах. Энтальпия.
- •1.5. Закон гесса.
- •1.6. Теплоёмкость. Уравнение кирхгофа.
- •Лекция 2
- •2.1. Второй закон термодинамики. Энтропия.
- •2.2. Расчёт изменения энтропии для различных процессов. Постулат планка.
- •2.2.1. Расчёт энтропии для равновесных (обратимых) процессов.
- •2.2.2. Расчёт изменения энтропии в ходе химической реакции.
- •2.2.3. Расчёт изменения энтропии в ходе самопроизвольных (необратимых) процессов.
- •2.3. Энергия гиббса, энергия гельмгольца. Уравнение гиббса–гельмгольца.
- •2.4. Самопроизвольное протекание химической реакции. Расчет изменения энергии гиббса в химических реакциях.
- •2.5. Химический потенциал. Активность и летучесть. Расчет химического потенциала.
- •2. Для смеси идеальных газов:
- •Лекция 3
- •3.1. Термодинамика химического равновесия. Константа химического равновесия. Закон действующих масс.
- •3.2. Принцип ле–шателье.
- •3.3. Изотерма химической реакции.
- •3.4. Связь стандартного изменения энергии гиббса реакции с константой равновесия.
- •3.5. Равновесие в гетерогенных реакциях
- •3.6. Влияние температуры на химическое равновесие. Уравнения изохоры и изобары химической реакции.
1.6. Теплоёмкость. Уравнение кирхгофа.
Теплоёмкость – то количество теплоты, которое необходимо сообщить или отнять телу или системе, чтобы их температура изменилась на 1 градус. Теплоёмкость — величина экстенсивная, так как зависит от размера системы. Теплоёмкость, рассчитанная на 1 моль вещества, называется мольной, а на единицу массы – удельной.
Различают:
— истинную
теплоёмкость: ![]() [
[![]() ]. (1.25)
]. (1.25)
— среднюю
теплоёмкость: ![]() . (1.26)
. (1.26)
Наиболее часто используются следующие теплоемкости:
1. Изохорная теплоемкость. При нагреве или охлаждении вещества при постоянном объеме справедливо:
. ![]() . (1.27)
. (1.27)
2. Изобарная теплоемкость. При нагреве или охлаждении вещества при постоянном давлении справедливо:
. ![]() . (1.28)
. (1.28)
Следует знать, что теплоёмкость при постоянном давлении Ср больше, чем теплоёмкость при постоянном объёме СV, так как нагревание вещества при постоянном давлении сопровождается работой расширения, т.е.
![]() . (1.29)
. (1.29)
Для идеальных газов справедливо уравнение Майера:
![]() . (1.30)
. (1.30)
Величина R (универсальная газовая постоянная) равна работе расширения 1 моля идеального газа (при р = const) при увеличении его температуры на 1 градус.
Отношение
![]() обозначается символом
обозначается символом![]() (адиабатический
коэффициент),
который всегда больше нуля (
(адиабатический
коэффициент),
который всегда больше нуля (![]() > 0).
> 0).
Зависимость теплоёмкости веществ в области не очень низких температур (Т ≥ 298 К) обычно выражается в виде следующих полиномов:
![]() . (1.31)
. (1.31)
![]() . (1.32)
. (1.32)
Значения a, b, c, c´, d приведены в справочниках физико-химических и термодинамических величин.
Рассмотрим уравнение Кирхгоффа, описывающее зависимость энтальпии реакции от температуры:
 , (1.33)
, (1.33)
где
![]() ,
,
т. е. разность между суммой теплоёмкостей продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
Для вычисления интеграла необходимо знать зависимость теплоёмкости от температуры для всех веществ, что не всегда возможно. Поэтому уравнение Кирхгоффа применяют в трёх приближениях.
При наиболее грубом приближении полагают, что Сp = 0, т.е. считают равными суммарные теплоёмкости продуктов и исходных веществ. Тогда
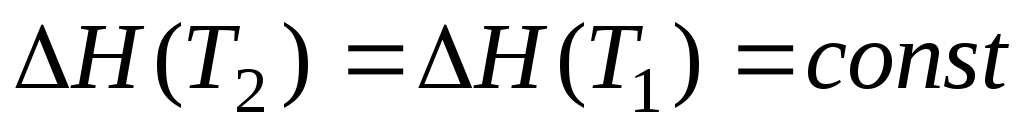 ,
,
т.е. тепловой эффект считается не зависящим от температуры. Этим приближением пользуются, если теплоемкости некоторых участников реакции неизвестны.
Во втором приближении считают разность теплоёмкостей постоянной величиной СР = const. Тогда
![]() . (1.34)
. (1.34)
Это уравнение применяют только для небольшого интервала температур Т2 – Т1, в котором известны величины теплоёмкостей.
В наиболее точном приближении используют зависимость всех СРi от температуры. Если теплоемкости веществ даны в виде полиномов, например (1.34), то уравнение Кирхгоффа можно проинтегрировать, после чего оно будет иметь следующий вид:
 . (1.35)
. (1.35)
Последнее уравнение можно использовать только в том интервале температур Т2 – Т1, для которого определены коэффициенты ai, bi, ci температурной зависимости теплоёмкостей веществ.
Лекция 2
Второй закон термодинамики. Энтропия. Вычисление изменения энтропии для различных процессов. Постулат Планка. Энергия Гиббса и энергия Гельмгольца. Уравнение Гиббса-Гельмгольца. Самопроизвольное протекание химических реакций. Расчет изменения энергии Гиббса в химических реакциях. Химический потенциал. Активность и летучесть.
