
Praktikum_po_fizike_1 / №11определение отношения
.doc
Лабораторная работа № 11
Определение отношения удельных теплоемкостей газов
Цель работы: найти экспериментальным путем для воздуха отношение теплоемкости при постоянном давлении СР к теплоемкости при постоянном объеме СV – γ=СР/CV.
Приборы и принадлежности: баллон объемом 20 – 40 л, жидкостный манометр, насос Комовского.
Теория работы
Изменение температуры тела при его нагревании зависит от его химического состава, массы и условий, при которых происходит нагревание. Для характеристики тепловых свойств тел вводится понятие теплоемкости.
Теплоемкость – это количество теплоты, которое необходимо сообщить телу, чтобы повысить его температуру на один градус Кельвина:
![]() ;
;
![]() .
.
Тепловые свойства веществ, из которых состоят тела, характеризуются двумя величинами.
Удельной теплоемкостью c – под которой понимают количество теплоты, необходимое для повышения температуры единицы массы вещества на один градус Кельвина:
![]() ;
;
![]() .
.
Молярной теплоемкостью cμ – определяется теплотой, идущей на нагревание одного моля вещества на один градус Кельвина:
![]() ;
;
![]() ,
,
где ν – количество молей.
Влияние условий нагревания на величину теплоемкости (C, c, cμ) следует непосредственно из первого начала термодинамики:
ΔQ = dU+pdV.
Если процесс нагревания протекает изохорически, т.е. V = const, a pdV = 0, то вся подводимая к телу теплота пойдет только на изменение внутренней энергии (dU). В случае изобарического процесса нагревания, когда постоянным сохраняется давление, такое же изменение внутренней энергии потребует большего количества теплоты. Ведь нагревание всегда приводит к росту давления, значит чтобы сохранить условие нагревания (р = const), необходимо увеличить объем занимаемый газом, при этом будет выполнена работа dA = pdV за счет дополнительного, по сравнению с изохорическим нагреванием, количества теплоты. Т.к. температура является мерой внутренней энергии, то ее изменение на одну и ту же величину при изохорическом и изобарическом нагревании означает, что и температура при этом меняется на одну и ту же величину. Учитывая, что при изобарическом процессе для этого понадобилось большее количество теплоты, сделаем вывод, что теплоемкость, определяемая при постоянном давлении, всегда больше теплоемкости при постоянном объеме: СР > CU; cP > cV; cμp > cμV.
Отметим, что другие условия нагревания дадут и другие значения теплоемкостей. Однако в конкретном изопроцессе величины СР, с или сμ имеют определенные числовые значения и являются однозначной характеристикой тепловых свойств тел. Важнейшими являются удельные и молярные теплоемкости для изобарических и изохорических процессов. Именно они приводятся в справочниках.
Для молярных теплоемкостей газов теория дает выражения:
![]() ;
;
![]() ,
,
где
i
– число степеней свободы молекул газа,
т.е. число независимых координат,
определяющих состояние тела;
![]() - универсальная газовая постоянная.
Отношение теплоемкостей газов Ср
к СV:
- универсальная газовая постоянная.
Отношение теплоемкостей газов Ср
к СV:
![]() зависит только от числа степеней свободы,
т.е. определяется атомной структурой
газов. Так, для одноатомных газов γ=1,66,
двухатомных – 1,41, трехатомных – 1,33 и
т.д. Величина γ играет большую роль в
молекулярной физике. Она используется,
например, при описании адиабатических
процессов, определении скорости
распространения звука в газах, исследований
течения газов по трубам со звуковыми и
сверхзвуковыми скоростями.
зависит только от числа степеней свободы,
т.е. определяется атомной структурой
газов. Так, для одноатомных газов γ=1,66,
двухатомных – 1,41, трехатомных – 1,33 и
т.д. Величина γ играет большую роль в
молекулярной физике. Она используется,
например, при описании адиабатических
процессов, определении скорости
распространения звука в газах, исследований
течения газов по трубам со звуковыми и
сверхзвуковыми скоростями.
Известно несколько способов определения теплоемкостей Ср и Сv и их отношения опытным путем. В нашей работе будет использован адиабатический метод, в основу которого положен процесс адиабатического расширения газа. Напомним, что под адиабатическими понимают процессы изменения состояния газов протекающие без теплообмена с окружающей средой. Такие процессы описываются законом Пуассона:
pVγ
= const
или в другой форме
![]() = сonst.
(1)
= сonst.
(1)
Если в закрытый баллон, соединённый с манометром, накачать воздух, то после выравнивания его температуры с температурой T0 внешней среды, мысленно выделенный объём газа V1 (V1 не объем баллона) будет находиться под давлением p1 = p0 + Δp1 (2), где p0 – атмосферное давление; Δp1 – добавочное давление, регистрируемое манометром. Таким образом состояние I газа будет характеризоваться параметрами: p1, V1, T0.
Если
теперь на короткое время открыть кран,
то воздух в баллоне расширится, часть
его выйдет из баллона, а объём мысленно
выделенной части газа увеличится, т.е.
V2
> V1.
Процесс будет продолжаться до тех пор,
пока давление в баллоне не сравняется
с атмосферным. В этот момент кран
закрывают. Этот процесс можно считать
адиабатическим. При этом состояние II
будет характеризоваться параметрами
p0,
V2,
T2,
причём T2
< T0,
т.к. газ будет теперь иметь более низкую
температуру, чем температура окружающей
среды. Применяя к состояниям I
и II
уравнение Пуассона (1), получим
![]() или
или
 (3). С момента закрытия крана приток
тепла извне приведёт к нагреванию газа
в баллоне до температуры окружающей
среды T0.
Газ будет нагреваться при постоянном
объёме, давление при этом возрастёт до
p2
> p0,
p2
= p0
+ Δp2
(4). Состояние III
будет характеризоваться параметрами:
p2,
V2,
T0.
Поскольку температура состояний I
и III
одинакова (процесс изотермический), на
основании закона Бойля-Мариотта получим:
(3). С момента закрытия крана приток
тепла извне приведёт к нагреванию газа
в баллоне до температуры окружающей
среды T0.
Газ будет нагреваться при постоянном
объёме, давление при этом возрастёт до
p2
> p0,
p2
= p0
+ Δp2
(4). Состояние III
будет характеризоваться параметрами:
p2,
V2,
T0.
Поскольку температура состояний I
и III
одинакова (процесс изотермический), на
основании закона Бойля-Мариотта получим:
![]() или
или
![]() .
(5)
.
(5)
Возведём обе
части уравнения (5) в степень γ:
 (6).
Используя уравнение (3) и (6), получим:
(6).
Используя уравнение (3) и (6), получим:
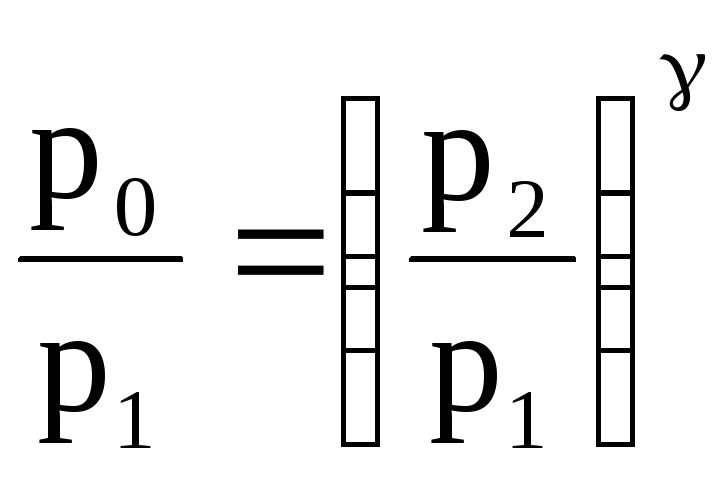 (7). Логарифмируя уравнение (7) и решая
его относительно γ, получим:
(7). Логарифмируя уравнение (7) и решая
его относительно γ, получим:
![]() .
(8)
.
(8)
На основании
(2) и (4) можно записать
![]() ,
,
![]() и получить:
и получить:
![]() (9),
(9),
![]() .
(10)
.
(10)
Подставив (9) и (10) в (8), получим:
 .
(11)
.
(11)
Учитывая, что
![]() и
и
![]() значительно меньше единицы, на основании
приближённого равенства
значительно меньше единицы, на основании
приближённого равенства
![]() при x << 1, имеем
при x << 1, имеем
![]() (12), а если используемый в работе манометр
будет жидкостным, то
(12), а если используемый в работе манометр
будет жидкостным, то
![]() и уравнение (12) будет иметь вид:
и уравнение (12) будет иметь вид:
![]() .
(13)
.
(13)
О писание
установки
писание
установки
Установка (рис.1) состоит из стеклянного баллона 1, соединенного с жидкостным манометром 2 и через кран 3 с насосом. Посредствам крана 4 баллон может сообщаться с атмосферой.
Порядок выполнения работы
-
Открыть кран 3 и закачать в баллон с помощью насоса такое количество воздуха, чтобы возникшая разность высот уровней жидкости в манометре Δh составила 300-400 мм. Закрыть кран 3.
-
Выждав некоторое время, в течение которого нагревшийся при закачивании в баллон воздух охладится до температуры окружающей среды, и уровни жидкости в манометре установятся, измерить с точностью до миллиметра разность уровней Δh1. Величина Δh1 определяет избыточное давление газа Δp1 в баллоне:
Δp1 = ρgΔh1,
где ρ – плотность жидкости в манометре, g – ускорение свободного падения.
-
Открыть кран 4 и удерживать его в таком положении до тех пор, пока не прекратиться шипение воздуха, выходящего из баллона. После чего немедленно закрыть кран. В этот момент давление воздуха в баллоне соответствует атмосферному p0.
-
В течение некоторого времени, наблюдать за изменением разности уровней жидкости в манометре. Это происходит потому, что охладившийся в результате адиабатического расширения воздух в баллоне нагревается из-за притока тепла извне. Процесс будет продолжаться до тех пор, пока температура газа в баллоне не сравняется с температурой окружающей среды, при этом изменение положения уровней жидкости в манометре прекратится.
-
Измерить возникшую разность уровней в манометре в этом состоянии – Δh2, определяющую избыточное давление Δp2 газа в баллоне:
Δp2 = ρgΔh2.
-
Повторить опыт 5-6 раз и записать полученные данные в таблицу:
|
Номер опыта |
Δh1 |
Δh2 |
<Δh1> |
<Δh2> |
<γ> |
i |
|
|
|
|
|
|
|
|
-
По средним значениям <Δh1> и <Δh2> вычислить значение <γ> по формуле (13).
-
Используя полученное значение <γ> и формулу
 ,
определить число степеней свободы i
и указать к каким газам следует причислить
воздух (одно-, двух-, многоатомным).
,
определить число степеней свободы i
и указать к каким газам следует причислить
воздух (одно-, двух-, многоатомным).
Контрольные вопросы
-
Что называется теплоемкостью, удельной теплоемкостью?
-
Что называется молярной теплоемкостью?
-
Чему равна внутренняя энергия газа?
-
Какие теплоемкости различают для газов в зависимости от условий нагревания?
-
Для каких процессов вводится понятие двух теплоемкостях – ср и сv?
-
Почему ср > сv?
-
Какой процесс называется адиабатическим?
-
Запишите уравнение адиабатического процесса.
-
Как изменяется температура при адиабатическом процессе?
-
Вывести расчетную формулу для определения γ.
-
Что понимают под степенями свободы молекул?
-
От чего зависит число степеней свободы молекул газа?
-
Как связано число степеней свободы и теплоемкости газа?
