
Лекція 1. Основні поняття та закони термодинаміКи
Теплотехніка –наука, яка вивчає процеси одержання та використання теплоти в різних виробництвах, а також машини та апарати, які використовуються для сіх цілей.
Технічна термодинаміка – вивчає процеси взаємного перетворення теплоти та роботи, а також властивості тіл, за допомогою яких проходить це перетворення.
Термодинамічна система – сукупність матеріальних тіл, які можуть взаємодіяти енергетично між собою і навколишнім середовищем.
Термодинамічний стан системи: сукупність властивостей, які відповідають даній системі (тілу). Ці властивості називаються термодинамічними параметрами стану термодинамічної системи.
Поступова зміна стану тіла, що відбувається в результаті його взаємодії з навколишнім середовищем, називається термодинамічним процесом.
Рівноважні
стани (![]() )
і рівноважний процес (
)
і рівноважний процес (![]() )
можна зобразити у вигляді діаграм (рис.
1.1, а).
)
можна зобразити у вигляді діаграм (рис.
1.1, а).
Круговим процесом або циклом називається процес, в результаті здійснення якого тіло повертається у початковий стан (рис. 1.1, б).
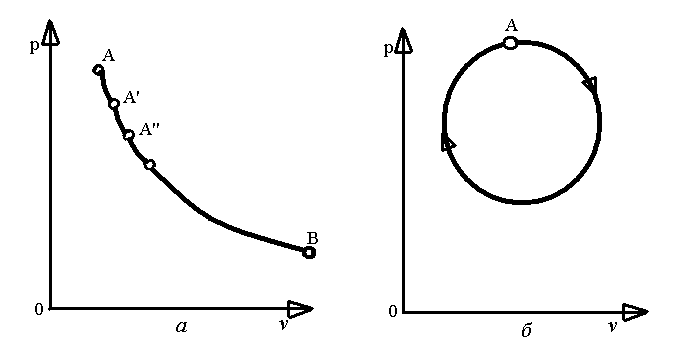
Рис.1.1. Діаграми термодинамічних процесів.
Термічні
параметри стану.
Якщо тиск робочого тіла більший за
атмосферний, тоді використовують
манометр,
який
фіксує надлишковий тиск
![]() (рис. 1.2).
(рис. 1.2).
![]() (1.1)
(1.1)
Якщо
тиск в посудині менший за барометричний,
тоді застосовують прилад – вакуумметр,
який фіксує розрідження, або вакуумметричний
тиск
![]() ,
тобто показує, наскільки тиск в посудині
менший за атмосферний
,
тобто показує, наскільки тиск в посудині
менший за атмосферний
![]() .
(1.2)
.
(1.2)
![]() (1.3)
(1.3)
Абсолютна температура вимірюється за шкалою Кельвіна:
![]() .
(1.4)
.
(1.4)
де
![]() – температура за шкалою Цельсія.
– температура за шкалою Цельсія.
Питомий
об’єм,
![]() ,
м3/кг
– об’єм, що займає одиниця маси речовини:
,
м3/кг
– об’єм, що займає одиниця маси речовини:
![]() ,
(1.5),
,
(1.5),
де
![]() – маса речовини, кг;
– маса речовини, кг;![]() – об’єм, який вона займає, м3.
– об’єм, який вона займає, м3.
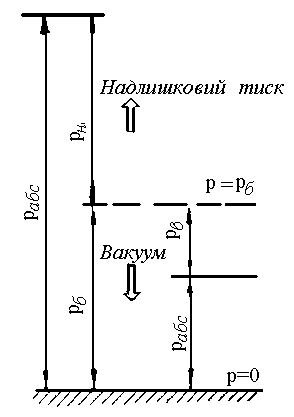
Рис. 1.2. Схема до розрахунку абсолютного тиску.
Термодинамічне рівняння стану. Для 1 кіломоля ідеального газу рівняння стану має вигляд рівняння Клапейрона-Менделеєва:
![]() ,
(1.6)
,
(1.6)
де
![]() – абсолютний тиск, Па;
– абсолютний тиск, Па;![]() – об’єм 1 кіломоля газу,
– об’єм 1 кіломоля газу,![]() ;
;![]() – універсальна газова стала;
– універсальна газова стала;![]() – абсолютна температура, К.
– абсолютна температура, К.
Значення
![]() вираховується для нормальних умов:
вираховується для нормальних умов:
![]() .
(1.6):
.
(1.6):
![]() .
(1.7)
.
(1.7)
Для 1 кг ідеального газу:
![]() ,
(1.8)
,
(1.8)
де
![]() – питомий об’єм газу;
– питомий об’єм газу;![]() – питома газова стала,
– питома газова стала,![]() ;
;![]() – маса 1 кіломоля,
– маса 1 кіломоля,![]() .
.
Помноживши (1.8) на масу газу, одержимо рівняння стану для довільної кількості речовини:
![]() .
(1.9)
.
(1.9)
де
![]() – об’єм маси газу,
– об’єм маси газу,![]() .
.
Для проведення термодинамічних розрахунків систем з газовими сумішами чи розчинами необхідно знати їхній склад. Склад суміші може бути заданий:
масовими частками
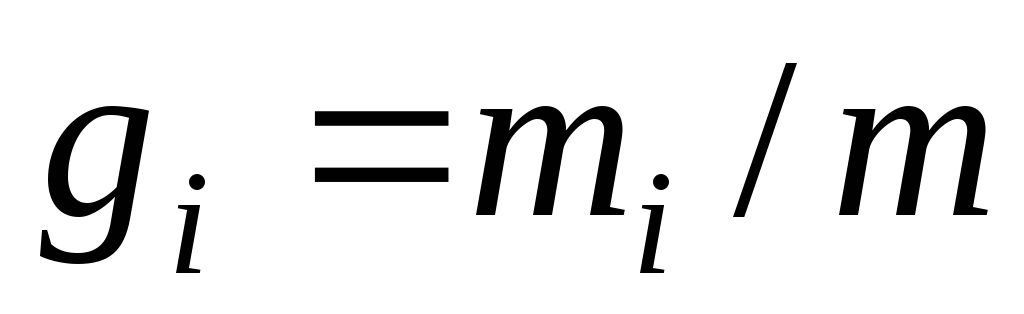 ,
де
,
де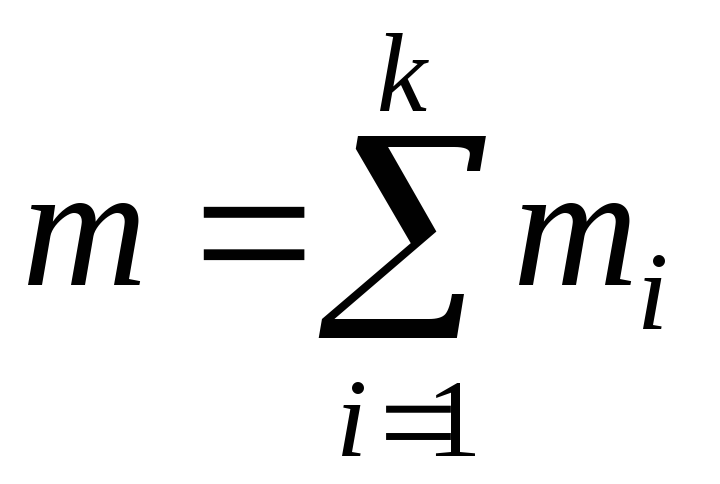 ;
;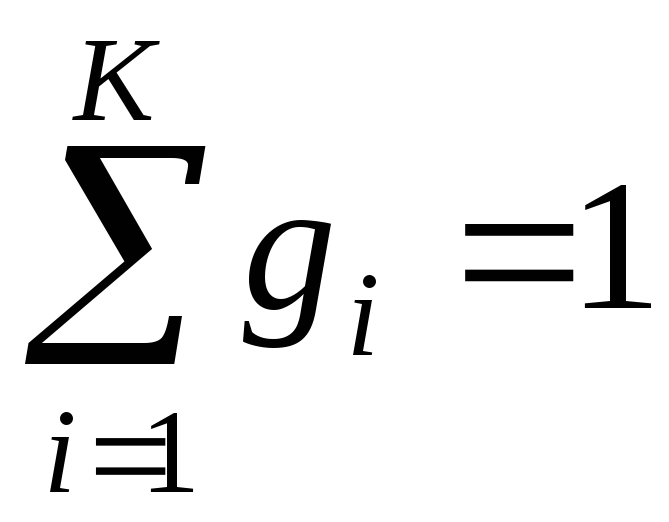 ;
;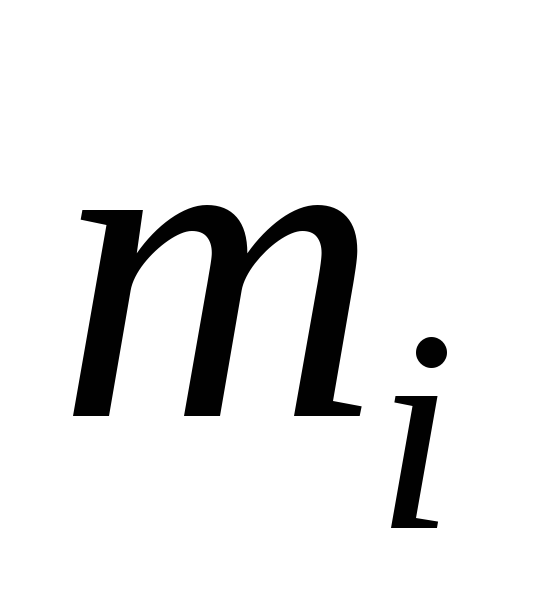 і
і – маси компонента і суміші;
– маси компонента і суміші;мольними частками
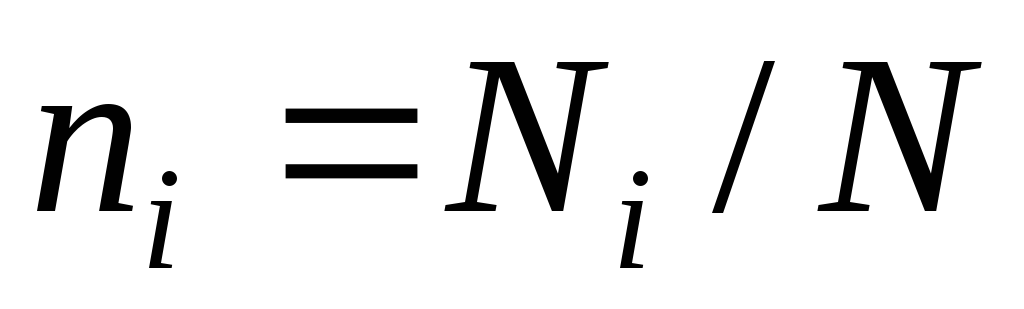 ,
де
,
де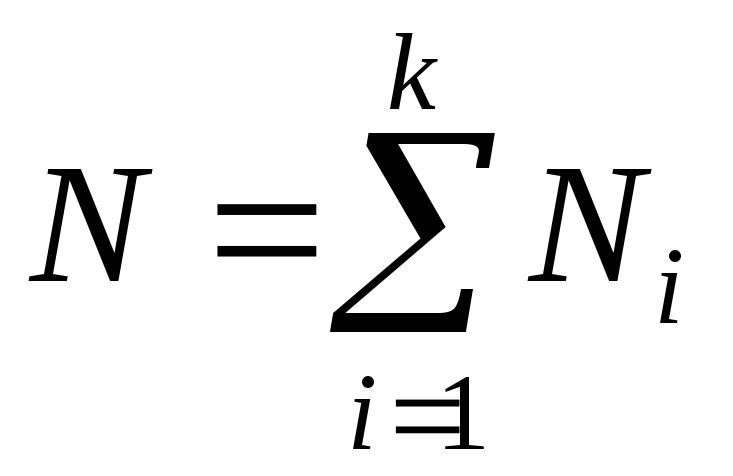 ;
;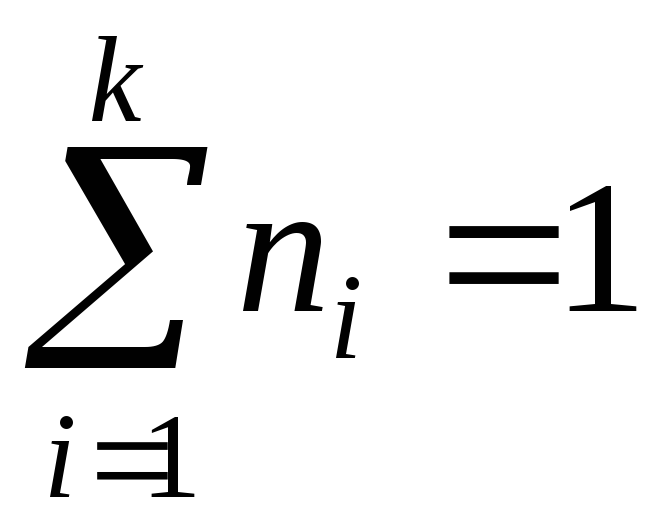 ;
;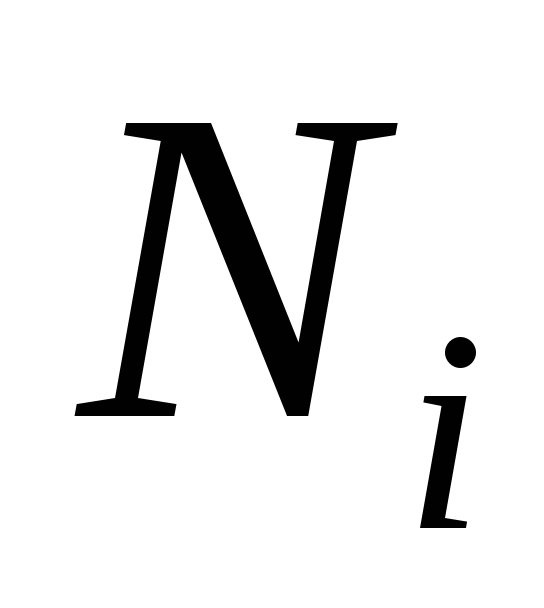 і
і – число кіломолів компонента і суміші;
– число кіломолів компонента і суміші;об'ємними частками
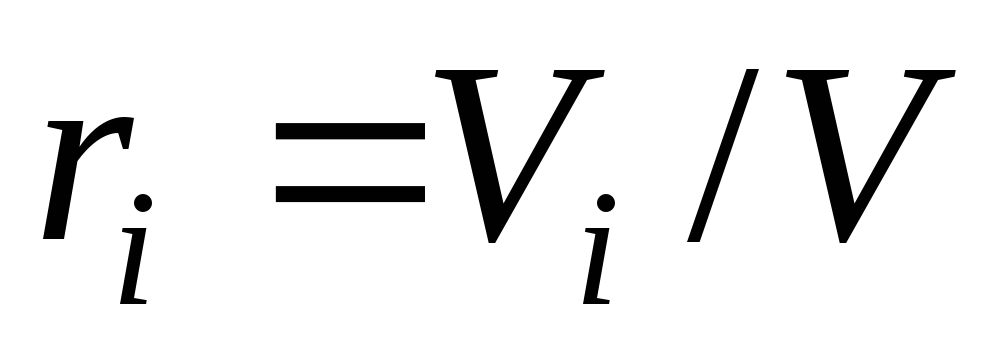 ,
де
,
де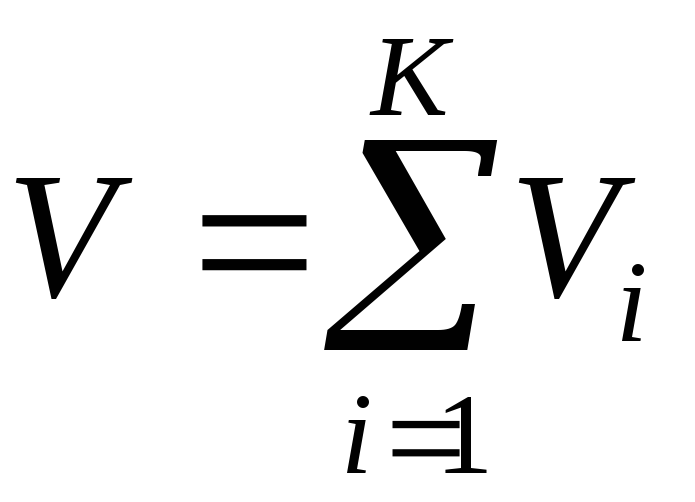 (закон Амага);
(закон Амага);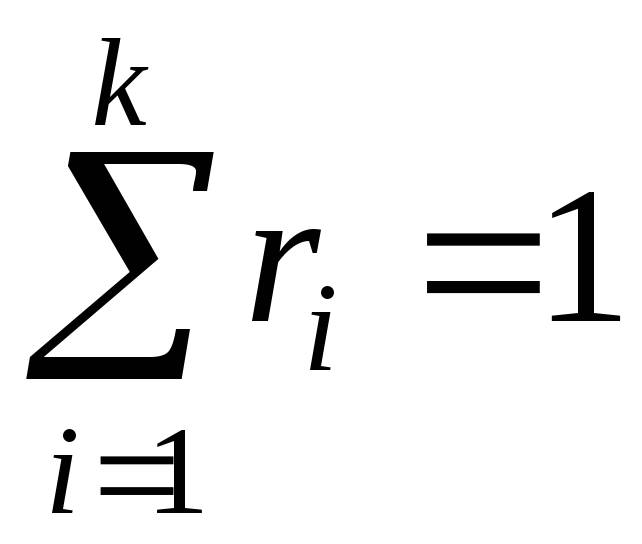 ;
;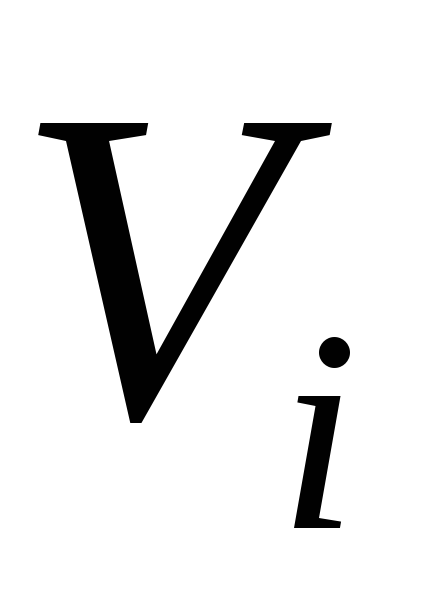 і
і – об'єми компонента (приведений об'єм)
і суміші при однакових тиску і температурі;
– об'єми компонента (приведений об'єм)
і суміші при однакових тиску і температурі;
Оскільки
згідно закону Авагадро мольні об'єми
всіх компонентів суміші газів рівні,
то
![]() ,
а
,
а![]() .
Тоді
.
Тоді![]() .
.
Склад суміші ідеальних газів може бути також заданий парціальними тисками рi. Парціальний тиск рi – це тиск i-го компонента газової суміші за умови, що він займає весь об'єм, призначений для суміші, при температурі суміші.
Закон Дальтона. Сума парціальних тисків окремих газів, що входять у суміш, дорівнює повному тиску суміші тобто:
![]() .
(1.10)
.
(1.10)
Таким чином, кожен газ у посудині займає весь об'єм при температурі суміші, знаходячись під власним парціальним тиском.
Рівняння стану для i-го компонента газової суміші:
![]() .
(1.11)
.
(1.11)
Рівняння стану для суміші ідеальних газів має вигляд:
![]() .
(1.12)
.
(1.12)
![]() –газова
стала суміші
–газова
стала суміші
![]() ;
;![]() – маса 1 кіломоля суміші,
– маса 1 кіломоля суміші,![]() .
.
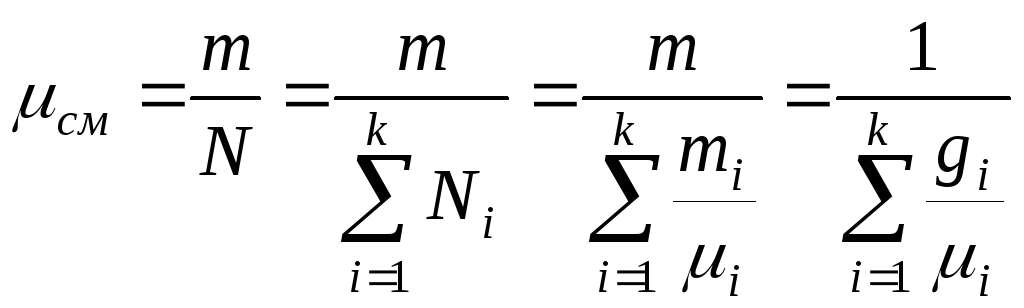 .
(1.13)
.
(1.13)
Термічні
параметри стану.
Внутрішня енергія
![]() ,
Дж, – це
енергія,
яка складається з кінетичної енергії
хаотичного руху молекул і потенціальної
енергії взаємодії молекул. Питома
внутрішня енергія вимірюється в Дж/кг:
,
Дж, – це
енергія,
яка складається з кінетичної енергії
хаотичного руху молекул і потенціальної
енергії взаємодії молекул. Питома
внутрішня енергія вимірюється в Дж/кг:
![]() .
(1.14)
.
(1.14)
Зміна внутрішньої енергії в будь-якому процесі:
![]() (1.15)
(1.15)
Для замкненого (кругового) процесу зміна внутрішньої енергії:
![]() .
(1.16)
.
(1.16)
Енергія
газу, що знаходиться у зовнішньому
середовищі з тиском
![]() і займає об’єм
і займає об’єм![]() ,
складається з внутрішньої енергії
,
складається з внутрішньої енергії![]() і потенціальної енергії тиску
і потенціальної енергії тиску![]() і називається ентальпією газу в даному
стані:
і називається ентальпією газу в даному
стані:
![]() .
(1.17)
.
(1.17)
Розглянемо повну енергію газу під поршнем з вантажем G (рис. 1.3).
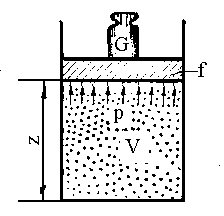
Рис. 1.3. Схема до визначення ентальпії.
Ентальпія газу в посудині під поршнем:
![]() .
(1.18)
.
(1.18)
Потенціальна енергія тиску:
![]() .
(1.19)
.
(1.19)
Зміна ентальпії не залежить від характеру процесу, а залежить лише від початкового і кінцевого станів:
![]() .
(1.20)
.
(1.20)
Ентропія – параметр стану, диференціал якого дорівнює відношенню нескінченно малої кількості тепла в елементарному оборотному процесі до абсолютної температури, яка на малій ділянці процесу є постійною величиною:
![]() ;
;![]() .
(1.21)
.
(1.21)
Зміна ентропії в будь-якому процесі:
![]() .
(1.22)
.
(1.22)
Всі ці параметри мають властивість адитивності.
Термодинамічний
процес і його енергетичні характеристики.Енергетичними характеристиками
термодинамічного процесу є робота (![]() )
і теплота
)
і теплота![]() .
.
Елементарна питома робота проти зовнішніх сил:
![]() .
(1.23)
.
(1.23)
Для кінцевого процесу (рис.1.4):
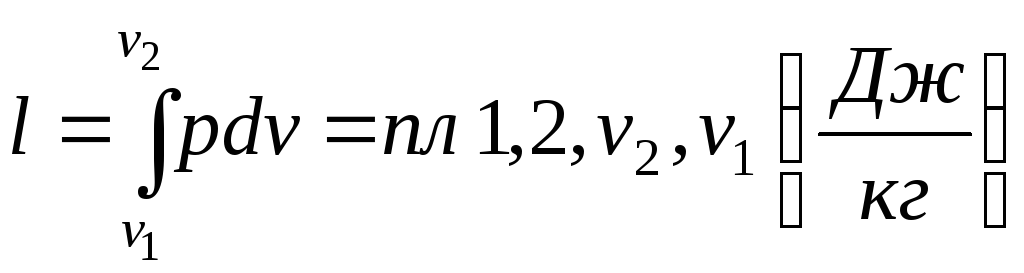
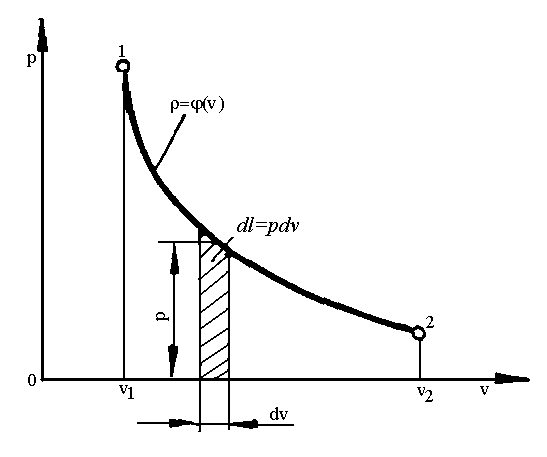 .
(1.24)
.
(1.24)
Рис. 1.4. Схема до обчислення роботи в термодинамічному процесі.
Елементарна питома теплота:
![]() .
(1.25)
.
(1.25)
Для кінцевого процесу кількість тепла, віднесеного до 1 кг речовини (рис.1.5):
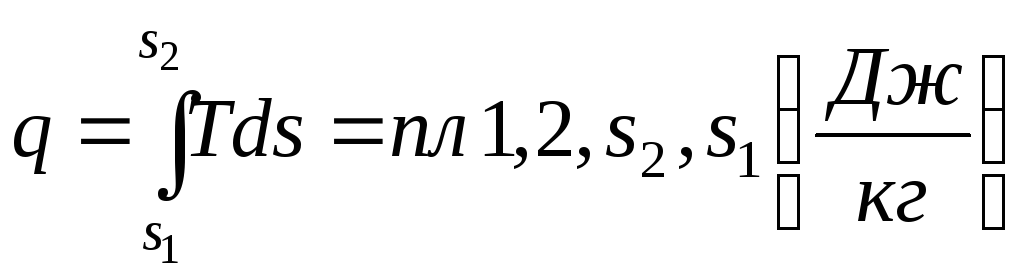
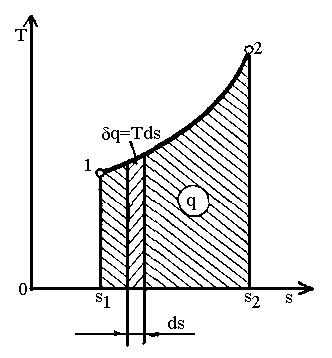 .
(1.26)
.
(1.26)
Рис.
1.5.
![]() діаграма термодинамічного процесу.
діаграма термодинамічного процесу.
Теплоємність – відношення теплоти, яка підводиться або відводиться у процесі до відповідної зміни температури тіла:
![]() .
Істинна теплоємність:
.
Істинна теплоємність:
![]() .
(1.27)
.
(1.27)
Розрізняють
теплоємності: масову
![]() ,кДж/(кгК),
віднесену до 1 кг робочого тіла; об’ємну
,кДж/(кгК),
віднесену до 1 кг робочого тіла; об’ємну
![]() ,кДж/(м3К),
віднесену до 1 м3
при нормальних умовах;
,кДж/(м3К),
віднесену до 1 м3
при нормальних умовах;
![]() ,
кДж/(кмольК),
віднесену до 1 кмоля речовини. Зв’язок
між цими теплоємностями такий:
,
кДж/(кмольК),
віднесену до 1 кмоля речовини. Зв’язок
між цими теплоємностями такий:
![]() ;
;
![]() .
(1.28)
.
(1.28)
Для ідеальних газів зв’язок між ізобарною і ізохорною теплоємностями встановлює закон Майєра:
![]() .
(1.29)
.
(1.29)
Для мольних теплоємностей:
![]() кДж/(кмольК).
(1.30)
кДж/(кмольК).
(1.30)
Відношення ізобарної і ізохорної теплоємностей називається показником адіабати:
![]() .
(1.31)
.
(1.31)
Теплоємність залежить від температури (рис.1.6):
![]()
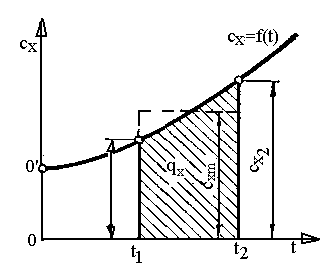 (1.32)
(1.32)
Рис.1.6. Залежність теплоємності від температури.
Для практичних розрахунків приймають:
![]() .
(1.33)
.
(1.33)
Виходячи з поняття істинної теплоємності, кількість питомої теплоти в процесі:
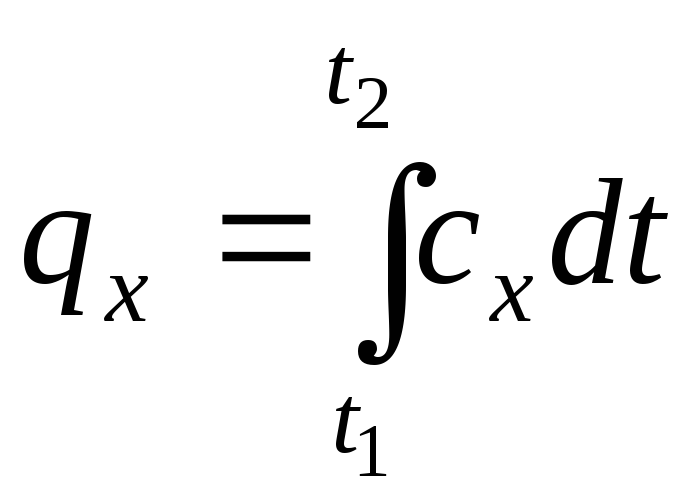 .
(1.34)
.
(1.34)
Ця ж кількість питомої теплоти, виражена через середню теплоємність:
![]() .
(1.35)
.
(1.35)
Тоді середня теплоємність
![]()
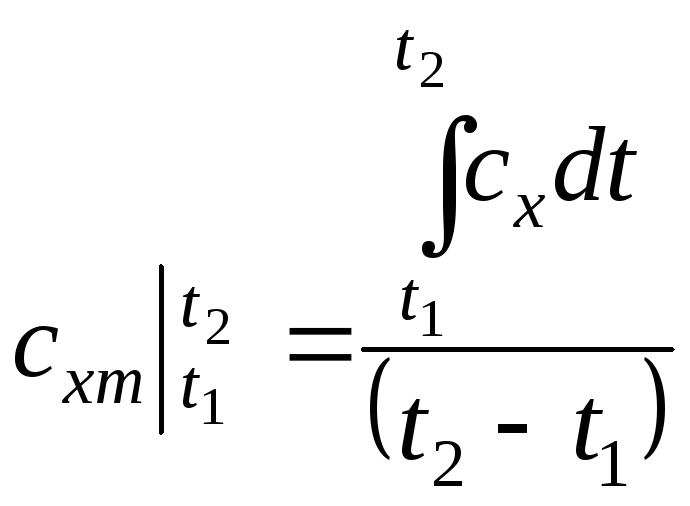 .
(.1.36)
.
(.1.36)
Здійснимо перетворення
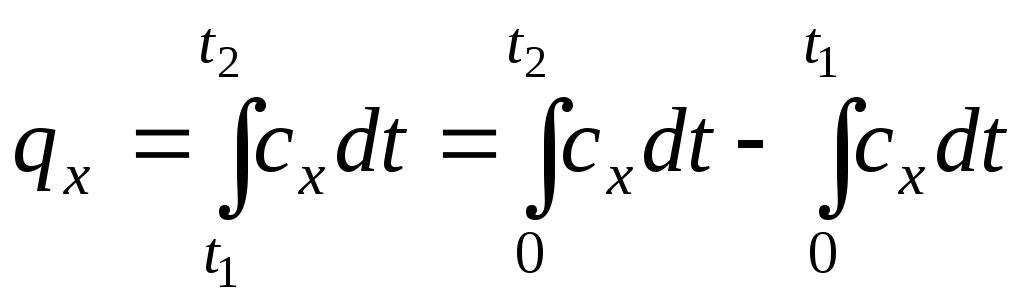 .
(1.37)
.
(1.37)
Проте:
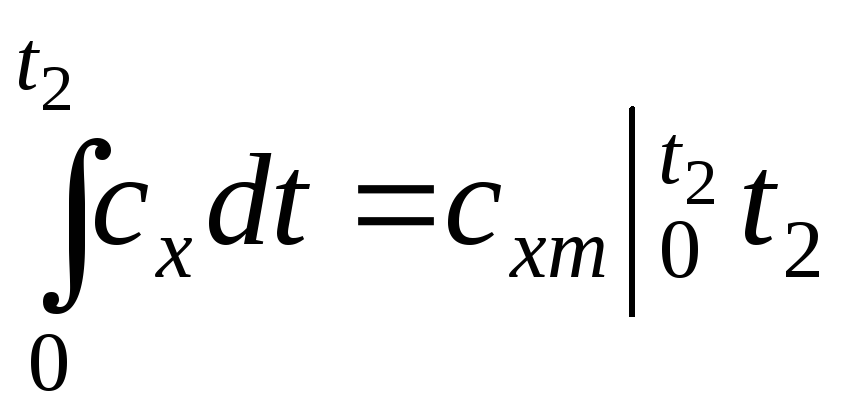 ;
;
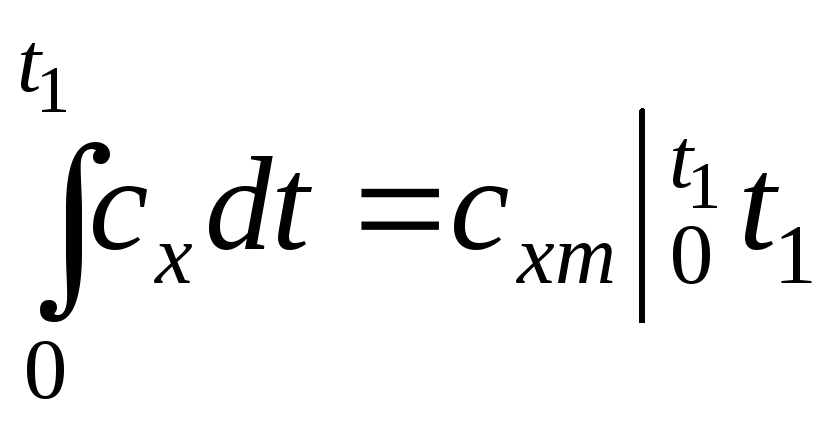 .
(1.38)
.
(1.38)
Тоді остаточно:
![]() .
(1.39)
.
(1.39)
Кількість теплоти в процесі для маси m, кг, чи об’єму V, м3, речовини:
![]() .
(1.40)
.
(1.40)
Теплоємність газової суміші:
масова
![]() ;
об’ємна
;
об’ємна![]() ;
мольна
;
мольна![]() .
(1.41)
.
(1.41)
Значення мольних теплоємностей у відповідності з класичною молекулярно-кінетичною теорією, у припущенні, що вони не залежать від температури, наведені в табл.1.1.
Таблиця 1.1.
