
Решение
Для разбавленной серной кислоты характерны:
а) образует средние и кислые соли
H2SO4 + NaOH = NaHSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
б) изменяет цвет лакмуса и фенолфталеина
Лакмус в нейтральной среде – фиолетовый, а в кислой среде – красный.
Фенолфталеин в нейтральной среде – бесцветный, а в кислой среде – бесцветный.
171. При окислении фосфора 60%-ным раствором азотной кислоты ( = 1,37
г/мл) получены оксид азота (II), и ортофосфорная кислота, на нейтрали-
зацию которой потребовалось 25 мл 25% раствора гидроксида натрия
( = 1,28 г/мл), причем образовался дигидрофосфат натрия. Рассчитайте
объем азотной кислоты, взятой для окисления фосфора и объем выде-
лившегося газа (при н.у.).
Решение
1.Найдем массу раствора 25% гидроксида натрия, который идет на нейтрализацию ортофосфорной кислоты:
m(р-ру)
= V(р-ру)
*
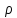 (р-ру)
(р-ру)
m(р-ру)
= 25
*
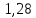 = 32 г
= 32 г
2.Найдем массу гидроксида натрия, которая содержится в 32 г 25% раствора:
m(NaOH) = m(р-ру) * w(NaOH)
m(NaOH) = 32 * 0,25 = 8 г
3.Найдем массу ортофосфорной кислоты, которая нейтрализуется 8 г гидроксида натрия:
х г 8 г
H3PO4 + NaOH = NaH2PO4 + H2O
98 г 40 г
х = m(H3PO4)
=
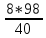 = 19,6 г
= 19,6 г
4.Найдем массу азотной кислоты и объем газа, который выделяется при окислении фосфора:
y г 19,6 г z л
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
315 г 294 г 112 л
y
= m(HNO3)
=
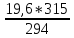 = 21 г
= 21 г
z
= V(NO)
=
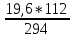 = 7,47 л
= 7,47 л
5.Найдем массу 60%-ного раствора азотной кислоты, в которой содержится 21 г кислоты:
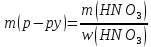
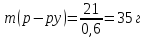
6. Найдем объем 60%-ного раствора азотной кислоты массою 35 г:
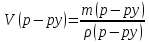
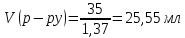
181. Составьте уравнения полуреакций восстановления оксида свинца (IV) в
кислой и щелочной средах. В каком случае значение стандартного по-
тенциала восстановления будет выше? Реагируют ли с PbO2 при стан-
дартных условиях следующие восстановители:
а) в кислой среде Fe2+; H2C2O4; б) в щелочной среде I2; Al.
Решение
1.Уравнение полуреакций восстановления оксида свинца (IV) в кислой и щелочной средах:
PbO2 + 4H+ + 2e = Pb2+ + 2H2O
PbO2 + 8OH- + 2e = 3[Pb(OH)4]2- + 2H2O
2.Стандартный потенциал восстановления в кислой среде – 1,46 В.
Стандартный потенциал восстановления в щелочной среде – 0,22 В.
Вывод: стандартный потенциал восстановления будет выше в кислой среде.
3.Для того, чтоб следующие восстановители реагировали с PbO2, нужно чтоб их стандартный потенциал восстановления были меньше чем стандартный потенциал восстановления PbO2 в соответствующей среде.
а) в кислой среде Fe2+; H2C2O4
Стандартный потенциал восстановления Fe2+ - (- 0,77) В.
Стандартный потенциал восстановления H2C2O4 - (- 0,49) В.
б) в щелочной среде I2; Al.
Вывод: PbO2 при стандартных в кислой среде будет реагировать как с Fe2+, так и с H2C2O4.
Стандартный потенциал восстановления I2 - 0,54 В.
Стандартный потенциал восстановления Al - (- 1,66) В.
Вывод: PbO2 при стандартных в щелочной среде будет реагировать только с Al.
197. Приготовлено 200 мл раствора сульфата железа (II) из навески
FeSO4.7H2O массой 27,8 г. Какой объем подкисленного раствора
KMnO4, для которого С (1/5 KMnO4) = 0,1 моль/л, потребуется на окис-
ление 50 мл приготовленного раствора FeSO4?
Решение
1.Найдем массу FeSO4, которая находится в 27,8 г FeSO4.7H2O:
27,8 г х г
FeSO4.7H2O → FeSO4 + 7H2O
278 г 152 г
х = m(FeSO4)
=
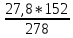 = 15,2 г
= 15,2 г
2.Найдем нормальную концентрацию FeSO4:
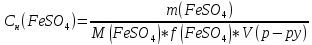
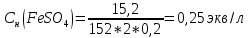
3.Найдем нормальную концентрацию KMnO4:
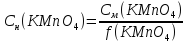
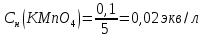
4.Найдем объем подкисленного раствора KMnO4 (за законом эквивалентности), который потребуется на окисление 50 мл приготовленного раствора FeSO4:

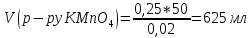
208. Составьте уравнения реакций последовательного перехода:
3. Оксид хрома (III) хромат калия дихромат калия
сульфат хрома (III) гидроксид- хрома (III) оксид хрома (III).
Решение
Cr2O3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 5H2O
2K2CrO4 + 2HCl = K2Cr2O7 + 2KCl + H2O
K2Cr2O7 + 3Na2SO3 + H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
Cr2(SO4)3 + 6KOH = 2Cr(OH)3↓ + 3K2SO4
2Cr(OH)3 = Cr2O3 + 3H2O
221. Пероксид водорода является окислителем по отношению к гексациано-
феррату (II) калия в кислой среде и восстановителем по отношению к
гексацианоферрату (III) калия в щелочной среде. В обоих случаях изме-
няется только заряд комплексных ионов, но не их состав. Составить
уравнения протекающих реакций. Какими реакциями можно доказать
присутствие в растворе ожидаемых продуктов окисления и восстановле-
ния железа?
Решение
2K4[Fe(CN)6] + H2O2 + H2SO4 = 2K3[Fe(CN)6] + 2H2O + K2SO4
H2O2 + 2K3[Fe(CN)6] + 2KOH = 2K4[Fe(CN)6] + O2 + 2H2O
Присутствие в растворе K3[Fe(CN)6] можно доказать взаимодействием с FeSO4 при этом выпадает темно-синий осадок «турбулевой сини».
2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓ + 3K2SO4
Присутствие в растворе K4[Fe(CN)6] можно доказать взаимодействием с FeСl3 при этом выпадает темно-синий осадок «берлинской лазури».
3K4[Fe(CN)6] + 4FeСl3 = Fe4[Fe(CN)6]3↓ + 12KCl
