
Решение
Гидро́лиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений.
Из этих солей FeSO4, Na2SO4, Na2SiO3 гидролизу будут подвергаться только FeSO4 (образована слабым основанием Fe(OH)2 и сильной кислотой H2SO4 – гидролиз по катиону) и Na2SiO3 (образована сильным основанием NaOH и слабою кислотою H2SiO3 – гидролиз по аниону). Na2SO4 гидролизу подвергаться не будет, потому что образованный сильным основанием NaOH и сильной кислотой H2SO4.
1.Гидролиз FeSO4:
1 – степень гидролиза
2FeSO4 + 2H2O ↔ (FeOH)2SO4 + H2SO4
2Fe2+ + 2SO42- + 2H2O ↔ 2(FeOH)+ + SO42- + 2H+ + SO42-
Fe2+ + H2O ↔ (FeOH)+ + H+
2 – степень гидролиза
(FeOH)2SO4 + 2H2O ↔ 2Fe(OH)2↓ + H2SO4
2(FeOH)+ + SO42- + 2H2O ↔ 2Fe(OH)2↓ + 2H+ + SO42-
(FeOH)+ + H2O ↔ Fe(OH)2↓ + H+
Реакция среды будет кислая.
Окраска индикаторов
Лакмус – красный, фенолфталеин – бесцветный и метилоранж – розовый.
2.Гидролиз Na2SiO3:
1 – степень гидролиза
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH
2Na+ + SiO32- + H2O ↔ Na+ + HSiO3- + Na+ + OH-
SiO32- + H2O ↔ HSiO3- + OH-
2 – степень гидролиза
NaHSiO3 + H2O ↔ H2SiO3↓ + NaOH
Na+ + HSiO3- + H2O ↔ H2SiO3↓ + Na+ + OH-
HSiO3- + H2O ↔ H2SiO3↓ + OH-
Реакция среды будет щелочная.
Окраска индикаторов
Лакмус – синий, фенолфталеин – малиновый и метилоранж – желтый.
3. Выражение константы гидролиза (по каждой ступени)
1 – степень гидролиза
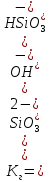
2 – степень гидролиза
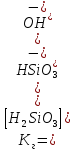
4.Рассчитаем константу гидролиза по I ступени:
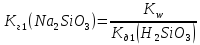
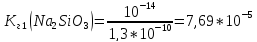
5. Рассчитаем степень гидролиза:

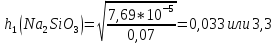
6. Определяем рН в растворе соли указанной концентрации:
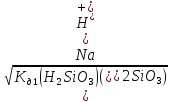
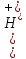
pH = - lg[Н+]
pH
= - lg
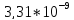 = 8,48
= 8,48
7. Объясняем, как повлияет на степень гидролиза и величину рН
а) нагревание:
При увеличении температуры степень гидролиза и величину рН увеличиваются, потому что увеличивается концентрация соли Na2SiO3, что прогидролизувала.
б) добавление кислоты:
При добавлении кислоты степень гидролиза увеличивается, а величина рН – уменьшается, потому что H+ связывает OH- в воду и равновесия реакции гидролиза Na2SiO3 смещается в сторону образования продуктов реакции.
в) добавление щелочи:
При добавлении щелочи степень гидролиза уменьшается, а величина рН – увеличивается, потому что OH- равновесия реакции гидролиза Na2SiO3 смещается в сторону образования реагентов и соответственно в растворе накапливаются ионы OH-.
110. В чем заключается суть теории Бренстеда-Лоури? Написать в протоли-
тической форме (с участием воды) процесс ионизации и гидролиза пред-
ложеного иона, объяснить его амфотерные свойства, отметить сопря-
женные пары.
11. HAsO42-
Решение
Протолитическая (протонная) теория кислот и оснований была предложена в 1923 году независимо друг от друга датским учёным Й. Брёнстедом и английским учёным Т. Лаури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А ↔ В + Н+ (А — кислота, В — основание). Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили общее название протолитов.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2 ↔ А2 + В1.
1. Процесс ионизации и гидролиз HAsO42-
HAsO42- + H2O ↔ H2AsO4- + OH-
HAsO42- + H2O ↔ AsO43- + H3O+
2.Объяснить амфотерные свойства HAsO42-:
HAsO42- будет проявлять амфотерные свойства, потому что он может как отдавать протон, то есть проявлять свойства кислоты, так и принимать протон, то есть проявлять свойства основания.
3.Отмечаем сопряженные пары:
Сопряженными парами будут H2AsO4- ↔ HAsO42- и HAsO42- ↔ AsO43-.
