
Производство азотной кислоты
.rtfПроизводство азотной кислоты
Азотная кислота – очень важное и нужно вещество, важная минеральная кислота. По общему объему производства она уступает только серной. В промышленном производстве используется 2 сорта:
- Разбавленная (содержит 50-60% HNO3);
- Концентрированная (содержит 96-98% HNO3).
Азотная кислота производится буквально из воды из воздуха с участием аммиака. Все составляющие части тщательным образом фильтруются и очищаются от примесей, как твердых, так и газообразных.

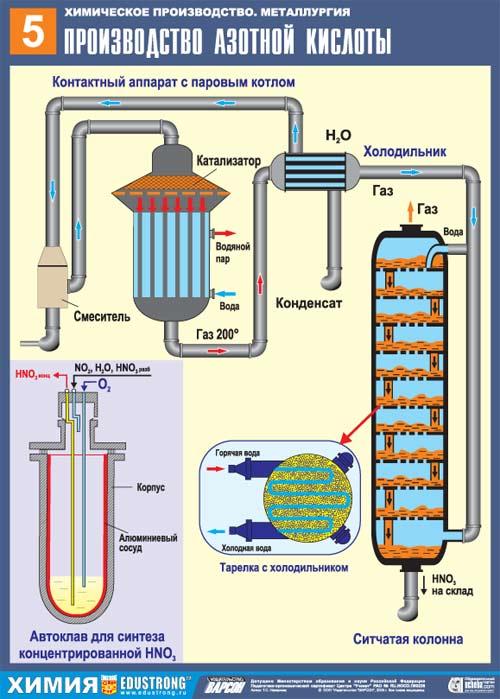
Современная химическая промышленность производит азотную кислоту с помощью каталитического окисления аммиака кислородом, содержащимся в воздухе. Использование катализатора позволяет получить NO, легко переходящий в NO2. А он в свою очередь в соединении с водой в присутствии кислорода воздуха дает в итоге азотную кислоту. Катализатором в данном случае служат сплавы на основе платины.
В результате производства получается азотная кислота, концентрация которой не превышает 60%. Далее происходит процесс концентрации до 97-98% и образуется так называемая «дымящая» азотная кислота. При температуре ниже 41С преобразуется в бесцветные вещество кристаллической структуры.
Свойства азотной кислоты
Азотная кислота активный и даже агрессивный окислитель органических и неорганических веществ. Интересен факт, что в разбавленном виде она окисляет все металлы, за исключением платины, серебра, родия и иридия, буквально растворяет железо! А в концентрированном состоянии азотная кислота пассивирует металлы. На поверхности металла образуется тонкий, но прочный слой оксида, который дальше не растворяется и защищает металл от разъедания. Концентрированная азотная кислота очень токсична и выделяет на воздухе ядовитые газы (оксиды азота). Концентрированная азотная кислота должна храниться в герметичной таре в прохладном и темном месте, т.к. на свету и под воздействием тепла частично разлагается!
Азотная кислота с точки зрения практического применения
Она входит в состав белков и других с биологической точки зрения.

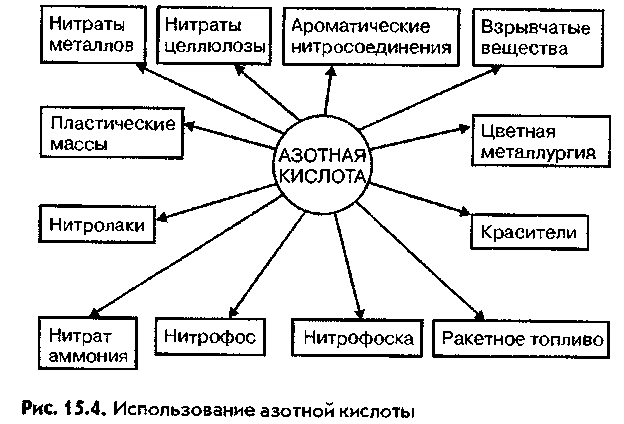
Примерно половина производимой азотной кислоты идет на получение азотных минеральных удобрений. Азот - необходимый для жизни и развития растений элемент. Но в свободном виде он недоступен растениям и может быть усвоен ими исключительно в виде солей азотной кислоты, называемых нитратами. В процессе землепользования запас азота в почве постепенно истощается и нуждается в пополнении. Из азотной кислоты получают удобрения, называемые селитрами. Самые популярные из них - натриевая (или Чилийская) селитра и калийная селитра.
Кроме удобрений азотная кислота идет на производство различных синтетических красителей и нитролаков. Ее используют для производства пластмассы и взрывчатых веществ, а так же лекарственных препаратов, для производства серной кислоты, в качестве окислителя горючего в ракетной технике и т.д.
ХимИндустрия

Компания "ХимИндустрия" реализуем техническую, слабую, концентрированную и неконцентрированную азотную кислоту по выгодной стоимости во все регионы России (Нижний Новгород, Приволжский округ, Центральный округ, другие регионы Российской Федерации) и в крупных объемах. По всем вопросам связанным с покупкой, ценой и дополнительными условиями продажи HNO3 Вы можете обратится к нашим специалистам.
Использование азотной кислоты
Заводы азотной кислоты



ДнепрАЗОТ
Производство азотной кислоты взрывоопасно из-за использования в нем горючих и взрывоопасных веществ — NH и природного газ. Применение производство азотных и сложных минеральных удобрений производство нитратов натрия, калия, кальция в гидрометаллургии производство взрывчатых веществ производство серной и фосфорной кислот получение ароматических нитросоединений производство красителей входит в состав ракетного топлива травление и растворение металлов в металлургии травление полупроводниковых материалов.

Чем опасна азотная кислота
Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи.
Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. В то же время обращение с азотной кислотой менее опасно, чем, например, с серной, она быстро испаряется и не остаётся в неожиданных местах. Брызги азотной кислоты следует смывать большим количеством воды, а ещё лучше смачивать раствором соды.
Дымящая азотная кислота при хранении под действием теплоты и на свету частично разлагается:
4HNO3
= 2H2O + 4NO2 + O2

