
- •22.1. Основные типы трансформаторов, элементы конструкции
- •22.2. Автотрансформаторы
- •22.3. Регулирование напряжения
- •22.4. Тепловой режим трансформаторов
- •22.5. Номинальная мощность и нагрузочная способность трансформаторов
- •23.1. Распределительные устройства с одной системой сборных шин
- •23.2. Распределительные устройства с двумя системами сборных шин
- •23.3. Распределительные устройства кольцевого типа
- •23.4. Упрощенные схемы распределительных устройств
- •24.1. Задание на технический проект электрической станции, подстанции
- •24.2. Требования, предъявляемые к схемам электроустановок
- •24.3. Схемы тепловых конденсационных электростанций
- •24.4. Схемы теплофикационных электростанций
- •24.5. Схемы атомных электростанций
- •24.6. Схемы гидростанций и гидроаккумулирующих станций
- •24.7. Схемы трансформаторных подстанций
- •25.2. Токоограничивающие устройства
- •25.3. Ограничение токов однофазного короткого замыкания в сетях 110-1150 кВ
- •25.4. Ограничение тока короткого замыкания и распределительных устройствах 6—10 кВ электростанций с помощью токоограничивающих реакторов
- •26.2. Рабочие машины системы собственных нужд электростанций и их характеристики
- •26.3. Системы собственных нужд тепловых электростанций
- •26.4. Системы собственных нужд атомных электростанций
- •26.5.Системы собственных нужд гидростанций и гидроаккумулирующих станций
- •26.6. Система сцбственных нужд подстанций
- •27.1. Назначение аккумуляторных батарей
- •27.3. Электрохимические реакции в аккумуляторе. Электродвижущая сила. Внутреннее сопротивление. Саморазряд. Сульфатация пластин
- •27.4. Характеристики разряда аккумулятора
- •27.5. Характеристики заряда аккумулятора
- •27.6. Преобразователи энергии
- •27.7. Режимы работы аккумуляторной батареи
- •27.8. Определение числа аккумуляторов в батарее и их емкости
27.3. Электрохимические реакции в аккумуляторе. Электродвижущая сила. Внутреннее сопротивление. Саморазряд. Сульфатация пластин
Если замкнуть внешнюю цепь заряженного аккумулятора, появится электрический ток. При этом происходят следующие реакции:
у отрицательной пластины
![]()
у положительной пластины
![]()
где е — заряд электрона, равный
![]()
На каждые две молекулы расходуемой кислоты образуются четыре молекулы воды, но в то же время расходуются две молекулы воды. Поэтому в итоге имеет место образование только двух молекул воды. Складывая уравнения (27.1) и (27.2), получаем реакцию разряда в окончательном виде:
![]()
Уравнения (27.1) - (27.3) следует читать слева направо.
При разряде аккумулятора на пластинах обеих полярностей образуется сульфат свинца. Серная кислота расходуется как у положительных, так и у отрицательных пластин, при этом у положительных пластин расход кислоты больше, чем у отрицательных. У положительных пластин образуются две молекулы воды. Концентрация электролита при разряде аккумулятора снижается, при этом в большей мере она снижается у положительных пластин.
Если изменить направление тока через аккумулятор, то направление химической реакции изменится на обратное. Начнется процесс заряда аккумулятора. Реакции заряда у отрицательной и положительной пластин могут быть представлены уравнениями (27.1) и (27.2), а суммарная реакция — уравнением (27.3). Эти уравнения следует теперь читать справа налево. При заряде сульфат свинца у положительной пластины восстанавливается в перекись свинца, у отрицательной пластины — в металлический свинец. При этом образуется серная кислота и концентрация электролита повышается.
Электродвижущая сила и напряжение аккумулятора зависят от множества факторов, из которых важнейшими являются содержание кислоты в электролите, температура, ток и ею направление, степень заряженности. Связь между электродвижущей силой, напряжением и током может быть запи-
сана следующим образом:
при
разряде

где Е0 - обратимая ЭДС; Eп - ЭДС поляризации; R — внутреннее сопротивление аккумулятора.
Обратимая ЭДС — это ЭДС идеального аккумулятора, в котором устранены все виды потерь. В таком аккумуляторе энергия, полученная при заряде, полностью возвращается при разряде. Обратимая ЭДС зависит только от содержания кислоты в электролите и температуры. Она может быть определена аналитически, исходя из теплоты образования реагирующих веществ.
Реальный аккумулятор находится в условиях, близких к идеальным, если ток ничтожно мал и продолжительность его прохождения также мала. Такие условия можно создать, если уравновесить напряжение аккумулятора некоторым внешним напряжением (эталоном напряжения) с помощью чувствительного потенциометра. Напряжение, измеренное таким образом, называется напряжением при разомкнутой цепи. Оно близко к обратимой ЭДС. В табл. 27.1 приведены значения этого напряжения, соответствующие плотности электролита от 1,100 до 1,300 (отнесены к температуре 15°С) и температуре от 5 до 30 °С.
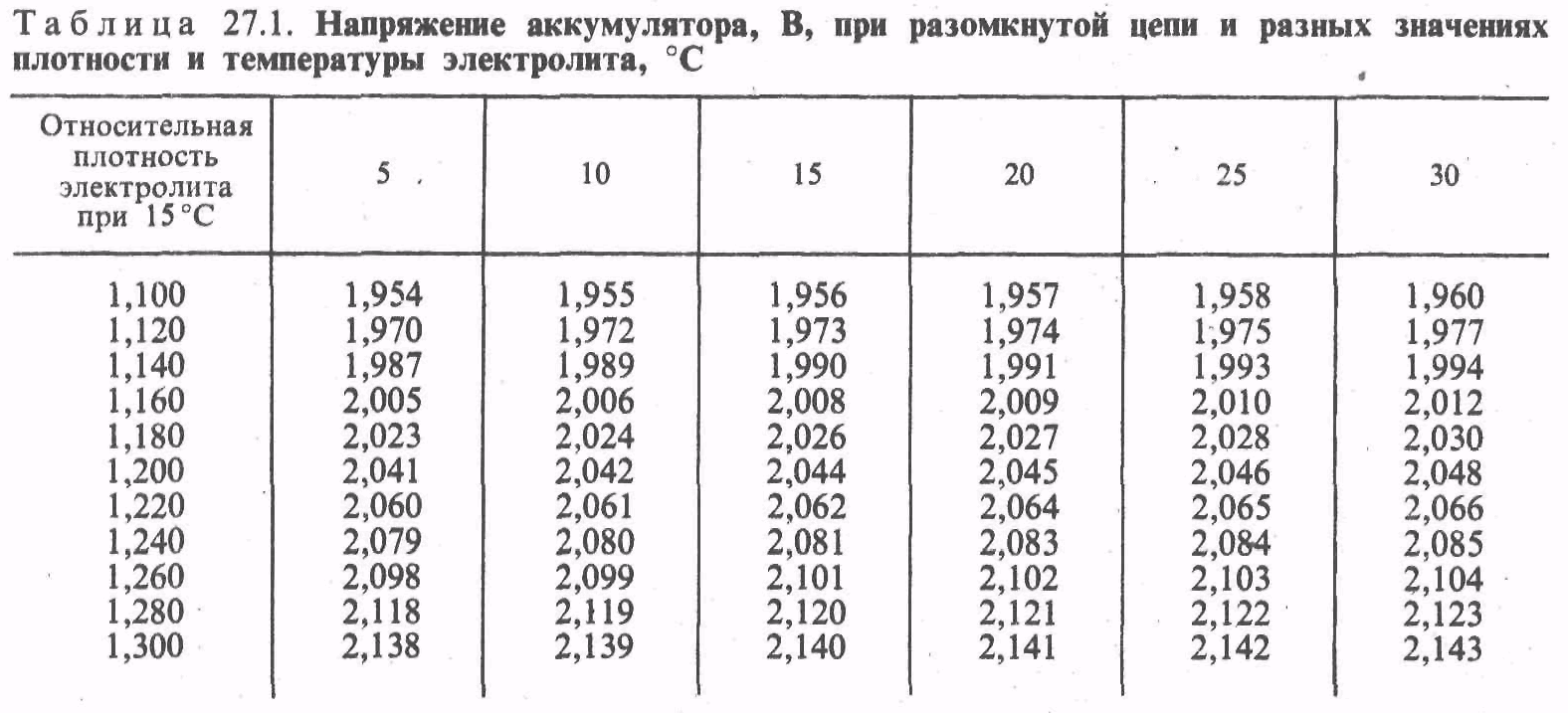
Как видно из -таблицы, при плотности электролита 1,200, обычной для стационарных аккумуляторов, и температуре 25 °С напряжение аккумулятора при разомкнутой цепи равно 2,046 В. В процессе разряда плотность электролита несколько снижается. Соответствующее снижение напряжения при разомкнутой цепи составляет всего несколько сотых долей вольта. Изменение напряжения при разомкнутой цепи, вызванное изменением температуры, ничтожно мало и представляет скорее теоретический интерес.
Если через аккумулятор проходит некоторый ток в направлении заряда или разряда, напряжение аккумулятора изменяется вследствие внутреннего падения напряжения и изменения ЭДС, вызванного побочными химическими и физическими процессами у электродов и в электролите. Изменение ЭДС аккумулятора, вызванное указанными необратимыми процессами, называется поляризацией. Основными причинами поляризации в аккумуляторе являются изменение концентрации электролита в порах активной массы пластин по отношению к концентрации его в остальном объеме и вызываемое этим изменение концентрации ионов свинца. При разряде кислота расходуется, при заряде образуется. Реакция происходит в порах активной массы пластин, и приток или удаление молекул и ионов кислоты происходит через диффузию. Последняя может иметь место только при наличии некоторой разности концентраций электролита в области электродов и в остальном объеме, которая устанавливается в соответствии с током и температурой, определяющей вязкость электролита. Изменение концентрации электролита в порах активной массы вызывает изменение концентрации ионов свинца и ЭДС. При разряде вследствие понижения концентрации электролита в порах ЭДС уменьшается, а при заряде вследствие повышения концентрации электролита ЭДС повышается.
Электродвижущая сила поляризации направлена всегда навстречу току. Она зависит от пористости пластин, тока и
температуры. Сумма обратимой ЭДС и ЭДС поляризации, т. е. Е0 ± Еп, представляет собой ЭДС аккумулятора под током или динамическую ЭДС. При разряде она меньше обратимой ЭДС, а при заряде — больше. Напряжение аккумулятора под током отличается от динамической ЭДС только на значение внутреннего падения напряжения, которое относительно мало. Следовательно, напряжение аккумулятора под током также зависит от тока и температуры. Влияние последней на напряжение аккумулятора при разряде и заряде значительно больше, чем при разомкнутой цепи.
Если разомкнуть цепь аккумулятора при разряде, напряжение его медленно увеличится до напряжения при разомкнутой цепи вследствие продолжающейся диффузии электролита. Если разомкнуть цепь аккумулятора при заряде, напряжение его медленно уменьшится до напряжения при разомкнутой цепи.
Неравенство концентраций электролита в области электродов и в остальном объеме отличает работу реального аккумулятора от идеального. При заряде аккумулятор работает так, как если бы он содержал очень разбавленный электролит, а при заряде — очень концентрированный. Разбавленный электролит все время смешивается с более концентрированным, при этом некоторое количество энергии выделяется в виде тепла, которое при условии равенства концентраций могло бы быть использовано. В результате энергия, отданная аккумулятором при разряде, меньше энергии, полученной при заряде. Потеря энергии происходит вследствие несовершенства химического процесса. Этот вид потерь является основным в аккумуляторе.
Внутреннее сопротивление аккумулятора. Внутреннее сопротивление слагается из сопротивлений каркаса пластин, активной массы, сепараторов и электролита. Последнее составляет большую часть внутреннего сопротивления. Сопротивление аккумулятора увеличивается при разряде и уменьшается при заряде, что является следствием изменения концентрации раствора и содержания суль-
фата в активной массе. Сопротивление аккумулятора невелико и заметно лишь при большом разрядном токе, когда внутреннее падение напряжения достигает одной или двух десятых долей вольта.
Саморазряд аккумулятора. Саморазрядом называется непрерывная потеря химической энергии, запасенной в аккумуляторе, вследствие побочных реакций на пластинах обеих полярностей, вызванных случайными вредными примесями в использованных материалах или примесями, внесенными в электролит в процессе эксплуатации. Наибольшее практическое значение имеет саморазряд, вызванный присутствием в электролите различных соединений металлов, более электроположительных, чем свинец, например меди, сурьмы и др. Металлы выделяются на отрицательных пластинах и образуют со свинцом пластин множество короткозамкнутых элементов. В результате реакции образуются свинцовый сульфат и водород, который выделяется на металле загрязнения. Саморазряд может быть обнаружен по легкому выделению газа у отрицательных пластин.
На положительных пластинах саморазряд происходит также вследствие обычной реакции между свинцом основы, перекисью свинца и электролитом, в результате которой образуется сульфат свинца.
Саморазряд аккумулятора происходит всегда: как при разомкнутой цепи, так и при разряде и заряде. Он зависит от температуры и плотности электролита (рис. 27.2), причем с повышением температуры и плотности электролита саморазряд увеличивается (потеря заряда при температуре 25 °С и плотности электролита 1,28 принята за 100%). Потеря емкости новой батареи вследствие саморазряда составляет около 0,3% в сутки. С возрастом батареи саморазряд увеличивается.
Ненормальная сульфатация пластин. Свинцовый сульфат образуется на пластинах обеих полярностей при каждом разряде, что видно из уравнения реакции разряда. Этот сульфат имеет

тонкое кристаллическое строение и зарядным током легко восстанавливается в металлический свинец и перекись свинца на пластинах соответствующей полярности. Поэтому сульфатация в этом смысле - нормальное явление, составляющее неотъемлемую часть работы аккумулятора. Ненормальная сульфатация возникает, если аккумуляторы подвергаются чрезмерному разряду, систематически недозаряжаются или остаются в разряженном состоянии и бездействии в течение длительного времени, а также если они работают с чрезмерно высокой плотностью электролита и при высокой температуре. В этих условиях тонкий кристаллический сульфат становится более плотным, кристаллы растут, сильно расширяя активную массу, и трудно восстанавливаются при заряде вследствие большого сопротивления. Если батарея находится в бездействии, образованию сульфата способствуют колебания температуры. При повышении температура мелкие кристаллы сульфата растворяются, а при последующем ее понижении сульфат медленно выкристаллизовывается и кристаллы растут. В результате колебаний температуры крупные кристаллы образуются за счет мелких.
У сульфатированных пластин поры закупорены сульфатом, активный материал выдавливается из решеток и пластины часто коробятся. Поверхность сульфатированных пластин становится жесткой, шероховатой, и при растирании
материала пластин между пальцами ощущается как бы песок. Темно-корич-невые положительные пластины стано-вятся светлее, и на поверхности высту-пают белые пятна сульфата. Отрицательные пластины становятся твердыми, желовато-серыми. Емкость сульфатиро-шнного аккумулятора понижается.
Начинающаяся сульфатация может быть устранена длительным зарядом лалым током. При сильной сульфатации необходимы особые меры для приведе-гая пластин в нормальное состояние.
