
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
1.2.4. Озонирование
Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранить привкусы и запахи, а также провести обеззараживание. Озонированием можно очистить сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др. Озон - газ бледно-фиолетового цвета. В природе он находится в верхних слоях атмосферы. При температуре -111,9 ºС озон превращается в нестойкую жидкость темно-синего цвета. Физико-химический состав озона: относительная молекулярная масса 48, плотность при температуре 0 ºС и давлении 0,1 МПа 2,154 г/л, температура плавления 192,5 С, теплота образования 143,64 кДж/моль. Коэффициент растворимости в воде при 0 °С 0,49, при 20 °С 0,29. Окислительно-восстановительный потенциал 2,07 В. Чистый озон взрывоопасен, так как при его разложении высвобождается значительное количество тепла, очень токсичен. Максимально допустимая концентрация в воздухе рабочей зоны 1·10-4 мг/м3. Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3=О2+О). Озон окисляет все металлы, кроме золота, превращая их в оксиды.
В водном растворе озон диссоциирует быстрее, чем в воздухе. Очень быстро диссоциирует в слабощелочных растворах. В кислотных растворах озон проявляет большую стойкость. В чистом сухом воздухе он разлагается очень медленно. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии, например, погибают в несколько тысяч раз быстрее, чем при обработке воды хлором. Растворимость озона в воде зависит от РН и наличия в воде растворимых веществ. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона, присутствие щелочей - снижает. Действие озона в процессе окисления может происходить в трех различных направлениях:
-непосредственное окисление с участием одного атома кислорода;
-присоединение целой молекулы озона к окисляемому веществу с образованием озонидов;
-каталитическое усилие окисляющего воздействия кислорода, присутствующего в озонированном воздухе.
Механизм реакции разложения озона довольно сложен, на что влияет множество факторов - условия перехода озона из газовой фазы в жидкость, соотношения между парциальным давлением газа и его растворимостью в водном растворе, кинетика окисления озона и находящихся в воде загрязнений. При диспергировании озона в воду идут два основных процесса: окисление и дезинфекция, кроме того, происходит значительное обогащение воды растворимым кислородом. Окисление веществ может быть прямым и непрямым. Оно также может осуществляться катализом и озонолизом.
Примером прямых реакций может являться окисление ряда органических и минеральных веществ (Fe2+, Mn2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты.
Непрямое окисление осуществляется радикалами, например, группой ОН и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения. Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих загрязнителей. Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются.
Каталитическое воздействие озонирования заключается в усилении окислительной способности кислорода, который присутствует в озонированном воздухе. Озон получают из кислорода воздуха под воздействием электрического тока в генераторах. Озон подается в воду в виде озоно-воздушной смеси - около 3% О3. Для усиления процесса окисления смесь диспергируют в сточной воде на мельчайшие пузырьки газа.
Озонирование представляет собой процесс абсорбции, сопровождаемой химической реакцией в жидкой фазе. Примерная схема установки для очистки сточных вод озоном приведена на рисунке 1.6.:
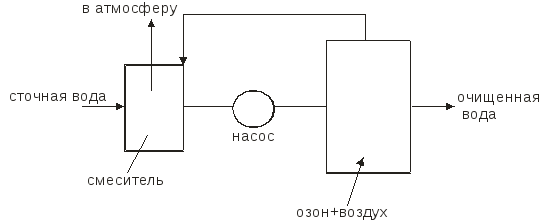
Рис.1.6. Схема очистки сточных вод озоном
Поскольку озон по своим свойствам приближается к сильным отравляющим веществам и превосходит синильную кислоту, то есть разбавляют до безопасных концентраций, деструкцию озона или его утилизацию. Необходимо отметить высокую перспективность методов озонирования с обработкой воды ультразвуком или ультрафиолетовым облучением, что приводит к усилению его окислительной способности.
