
- •Оглавление
- •Предисловие
- •МОДУЛЬ 1. ОБЩЕТЕОРЕТИЧЕСКИЕ ВОПРОСЫ НЕОРГАНИЧЕСКОЙ ХИМИИ
- •РАЗДЕЛ 1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
- •4.2.3. Сродство к электрону
- •4.2.4. Электроотрицательность
- •РАЗДЕЛ 3. ХИМИЧЕСКАЯ СВЯЗЬ
- •РАЗДЕЛ 4. РАСТВОРЫ И ДИСПЕРСНЫЕ СИСТЕМЫ
- •6.1. Дисперсные системы
- •РАЗДЕЛ 5. ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ
- •8.1. Степень окисления
- •9.2. Аккумуляторы
- •МОДУЛЬ 2. ХИМИЯ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- •12.4.1. Бинарные соединения металлов
- •12.6.5. Применение
- •12.7.4. Применение
- •12.9.5. Применение
- •МОДУЛЬ 3. ХИМИЧЕСКАЯ ИДЕНТИФИКАЦИЯ И АНАЛИЗ ВЕЩЕСТВА
- •РАЗДЕЛ 7. ОБЗОР СОВРЕМЕННЫХ МЕТОДОВ АНАЛИЗА ВЕЩЕСТВА
- •13.2. Титриметрический анализ
- •Тема 14. Физические методы анализа

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
12.4.1.Бинарныесоединенияметаллов
Врасплавах некоторых металлов обнаружены соединения типа металлметалл (интерметаллиды). Состав их не удовлетворяет привычному пред-
ставлению о валентности: Mg2Cu, MgNi2, Cu5Zn8 др. Многие металлы образуют друг с другом несколько металлидов, например AgZn, AgZn3 Ag5Zn8. Это металлоподобные вещества с преимущественно металлическим типом связи. Среди интерметаллических соединений открыто большое количество соединений со специфическими, очень ценными свойствами. Например,
Ni3Fe и Ni3Al обладают жаропрочностью, а Nb3Sn (при 18,5 К) и V3Ga (при 16,5 К) – сверхпроводимостью. Эти соединения используются для получения сильных магнитных полей. Магнит такого рода с массой, равной одному килограмму, создает магнитное поле, приблизительно равное полю двадцатитонного магнита с железным сердечником.
Металлы обладают выраженными восстановительными свойствами, с неметаллами – типичными окислителями они образуют бинарные соедине-
ния, табл.12.2.
Таблица 12.2
Бинарные соединения металлов
оксиды- |
Na2O, BaO |
нитриды- |
Na3N, AlN |
пероксиды- |
Na2O2, BaO2 |
карбиды- |
Be2C, CaC2 |
галиды- |
KCl, CaF2 |
фосфиды- |
Ca3P2, Na3P |
сульфиды- |
MnS, Al2 S3 |
бориды- |
AlB, Mg3B2 |
гидриды- |
LiH, CaH2 |
силициды- |
Mg2Si, Al4Si3 |
Многие из них можно рассматривать как соли очень слабых кислот, которые в водных растворах полностью гидролизуются:
Na2O2 + 2H2O = 2 NaOH + H2O2 ,
CaC2 + 2 H2O = Ca(OH)2 + C2H2 ,
Al2S3 + 6 H2O = 2 Al(OH)3 + 3H2S.
Наиболее характерны для металлов соединения с кислородом. Не окисляются лишь немногие металлы – золото, серебро и платиновые. Оксиды их получают косвенным путем:
AuCl3 + 3NaOH = Au(OH)3 + 3NaCl, Au(OH)3 = AuOOH + H2O,
2 AuOOH = Au2O3 + H2O.
Оксиды могут служить классическим примером зависимости состава и свойств соединений от положения элемента в Периодической системе – его электронной структуры.
Неорганическая химия. Курс лекций |
-177- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Впределах одного периода свойства оксидов и гидроксидов могут изменяться от основных к кислотным через амфотерные, а химическая связь от преимущественно ионной, в соединениях с минимальной степенью окисления металла, к типично ковалентной – с максимальной.
Аналогичное изменение свойств наблюдается у одного и того же металла по мере повышения степени окисления его атома. При увеличении степени окисления металла убывает радиус иона и увеличивается его поляризующее действие. В связи с этим диссоциация гидроксидов переходит от основного типа к амфотерному и далее к кислотному.
Среди соединений металлов с неметаллами особое место занимают металлоподобные вещества, не подчиняющиеся классическим представ-
лениям о валентности: W2C, Ti6O, Fe3C, TiN и др. Они имеют переменный состав (их часто называют бертоллидами), а также «смешанную» имическую связь (металлическую, ионную, ковалентную). Относительная доля той или иной связи в разных бертоллидах может меняться в широких пределах. Образовавшиеся бертоллиды сохраняют, как правило, многие свойства исходного металла, в частности, непрозрачность, довольно высокую электропроводность и металлический блеск. Но, по сравнению с исходным металлом, у них обычно увеличивается твердость, тугоплавкость и снижается активность. Например, карбид гафния (HfC) с добавкой карбида титана (TiC) плавится при 4200°С и является одним из самых тугоплавких материалов.
12.4.2.Взаимодействиеметалловскислотами
Вхимической практике наиболее часто используются соляная, серная и азотная кислоты. Состав продуктов взаимодействия с ними в значительной степени зависит от концентрации кислоты, активности металла, температуры
идругих факторов. Однако в большинстве случаев некоторые общие закономерности легко прослеживаются.
Всоляной кислоте и других бескислородных кислотах роль окислителя играют ионы водорода (Н+), поэтому с ними взаимодействуют металлы, стоящие в ряду напряжений до водорода, вытесняя его:
Al + 6HCl = 2AlCl3 + 3H2, Ео (Al/Al3+) = –1,66 B,
Ео (H2/2H +) = 0,00 B, ЭДС = 0 + 1,66 = 1,66 В.
Скорость взаимодействия HCl с металлами, образующими нерастворимые соли (PbCl2), с течением времени замедляется. Металлы, стоящие в ряду напряжений после водорода, с указанными кислотами не взаимодействуют.
Разбавленная серная кислота реагирует с металлами различной активности аналогично соляной:
Неорганическая химия. Курс лекций |
-178- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
2Al + 3H2SO4 = Al2 (SO4)3 + 3H2 .
В случае малорастворимых и нерастворимых сульфатов (PbSO4) снижается площадь контакта кислоты с поверхностью металла и взаимодействие практически прекращается.
Концентрированная серная кислота служит окислителем особенно при нагревании. Окислителем в этом случае является сульфат-ион SO42-, поэтому с ней взаимодействуют и некоторые металлы, стоящие в ряду напряжений после водорода (Cu, Ag и др.). Приближенно взаимодействие концентрированной серной кислоты с металлами различной активности можно представить схемой.
актив. Ме → сульфат + H2S + H2O
H2SO4(к) + ср. акт. Ме → сульфат + S + H2O мал. акт. Ме → сульфат + SO2 + H2O
Соответствующие полуреакции приведены ниже
SO42- + 10H+ +8ē = H2S + 4 H2O |
Eо = 0,31 B, |
SO42- + 4H+ + 2ē = SO2 + 2 H2O |
Eо = 0,31 B, |
SO42- + 8H+ + 6ē = S + 4 H2O |
Eо = 0,15 B. |
Например: |
|
8Na + 5 H2SO4(к) = 4Na2 SO4 + H2S + 4H2O, 3Cd + 4 H2SO4(к) = 3CdSO4 + S + 4 H2O,
2Bi + 6 H2SO4(к) = Bi2 (SO4)3 + 3SO2 + 6 H2O.
Каждая из рассмотренных реакций не исключает возможности частичного образования продуктов другого состава, здесь речь идет здесь о преимущественном протекании того или иного процесса. В ряде случаев вообще трудно отдать предпочтение одному из них. Например, по мере разогревания раствора в ходе взаимодействия цинка с серной кислотой состав продуктов меняется:
Zn + 2H2SO4(к) = ZnSO4 + SO2 + H2O,
3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4 H2O,
4Zn + 5H2SO4(к) = 4Zn SO4 + H2S + 4 H2O.
Некоторые металлы средней активности (Fe, Co, Ni, Cr и др.) пассивируются концентрированной серной кислотой, вероятно, образуя нерастворимые оксиды, и без нагревания с ней не взаимодействют.
Неорганическая химия. Курс лекций |
-179- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Взаимодействие разбавленной азотной кислоты с металлами различ-
ной активности можно приближенно выразить схемой:
активные Ме → нитрат + NH3 (NH4NO3) + H2O
HNO3( разб) + ср. акт. Ме→ нитрат + N2 (N2O, N2O3, HNO2) +Н2O
малоакт. Ме → нитрат + NO + H2O
4Ca + 10 HNO3 = 4Ca(NO3)2 + NH4NO3 +3 H2O, 4Mg + 10 HNO3 = 4Mg(NO3)2 + N2O + 5H2O, 5Co + 12 HNO3 = 5Co(NO3)2 + N2 + 6H2O,
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Следует помнить, что HNO3 взаимодействует с металлами практически без выделения водорода (не более 1 %), так как роль окислителя в ней играют нитрат-ионы NO3-. Чем более разбавлена кислота и активнее металл, тем глубже идет процесс восстановления иона NO3- .
HNO3 концентрированная является одним из самых сильных окислителей. Основным продуктом восстановления в случае концентрированной HNO3 будет NO2 и только при взаимодействии с наиболее активными металлами (щелочными и щелочноземельными) образуется N2O.
Если металл при этом проявляет низкую степень окисления (один – три), то он входит в состав нитрата, служа катионом: KNO3, Ba(NO3)2, Fe(NO3)3; при более высокой степени окисления он образует собственную кислородсодержащую кислоту или оксид:
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + H2O,
Re + 7HNO3 = HReO4 + 7NO2 +3H2O,
Ru + 8HNO3 = RuO4 + 8NO2 + 4H2O.
Концентрированная азотная кислота аналогично серной пассивирует на холоде некоторые довольно активные металлы (Al, Cr, Fe), например, для железа предложена следующая схема образования пассивирующей пленки:
3Fe + 8HNO3 = Fe3O4 + 8NO2 + 4H2O
3Fe + 4H2O – 8ē = Fe3O4 + 8H+ |
1 |
||
NO3- +2H+ + 1ē = NO2 + H2O |
|
8 |
|
|
|
|
|
3Fe +8H+ +8NO3- = Fe3O4+8NO2 + 4H2O.
Fe3O4 = FeO · Fe2O3.
Неорганическая химия. Курс лекций |
-180- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Азотная кислота является единственной кислотой, вcе соли которой растворимы в воде.
12.4.3. Взаимодействиеметалловсосмесямикислот
Смеси кислот: HNO3 + HCl и HNO3 + HF являются лучшими растворителями для малоактивных d-металлов шестого периода:
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O, 3Ta + 5HNO3 + 21HF = 3H2[TaF7] + 5NO + 10H2O.
Азотная кислота в этих соединениях окисляет металл до максимальной степени окисления, восстанавливаясь при этом до NO; Cl- или F- образуют устойчивые комплексы с металлами. При избытке кислот равновесие в системе смещается в сторону продуктов реакции.
12.4.4.Взаимодействиеметалловсводой, щелочами
Стандартный электродный потенциал системы
2H2O + 2ē = H2 +2OH-
составляет – 0,628B, поэтому с водой взаимодействуют только довольно активные металлы (потенциал которых меньше указанной величины). Причем, взаимодействие протекает с высокой скоростью, если образующийся гидроксид растворим в воде:
2Na + 2H2O = 2NaOH + H2 ,
Mg + 2H2O 1000 С→Mg(OH)2 +H2 .
При образовании малорастворимых гидроксидов процесс постепенно замедляется, а некоторые сравнительно активные металлы (Zn, Al) практически не взаимодействуют с водой, так как в первый момент на поверхности их образуется тонкий слой нерастворимого оксида или гидроксида, препятствующий дальнейшему окислению металла.
В присутствии щелочей малорастворимые амфотерные оксиды и гидроксиды переходят в раствор в виде гидроксокомплексов, что способствует дальнейшему взаимодействию металлов с водой, например:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2 .
При сплавлении амфотерных металлов со щелочами образуются соли кислородсодержащих кислот металлов
Неорганическая химия. Курс лекций |
-181- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Be + 2NaOH = Na2BeO2 + H2 .
Электродный потенциал многих металлов (преимущественно d-элемен- тов) за счет наличия на их поверхности оксидных пленок значительно смещается в сторону положительных значений, в связи c этим металлы не могут вытеснять водород и взаимодействуют со щелочами в присутствии сильных окислителей и, как правило, при нагревании
2Nb + 5KNO3 + 2NaOH = 2NaNbO3 + 5KNO2 + H2O .
При рассмотрении химических свойств следует помнить, что со щелочами взаимодействуют только те металлы, соединения которых обладают амфотерными или преимущественно кислотными свойствами.
12.5. Металлывприроде. Способыполученияметаллов
Вследствие высокой активности большинство металлов находится в природе в виде соединений. Лишь немногие встречаются в самородном состоянии: Au, Ag, Pt, Hg, Cu (в песчаных россыпях, в жильных образованиях горных пород и т. д.). Состав руд чрезвычайно разнообразен, часто металлы представлены в них в видеоксидныхилисульфидныхминералов.
Оксидные минералы |
Сульфидные минералы |
|||
гематит |
Fe2O3 |
|
гaленит |
PbS |
боксит |
Al2O3 |
· n H2O |
арсенопирит |
FeAsS |
куприт |
Cu2O |
|
пирит |
FeS2 |
касситерит |
SnO2 |
|
молибденит |
MoS2 |
пиролюзит |
MnO2 |
халькопирит |
СuFeS2 |
|
Минералы-соли
Карбонаты:
CaCO3 – кальцит (мел, мрамор, известняк); SrCO3 – стронцианит;
CaCO3 · MgCO3- доломит.
Сульфаты: BaSO4 – барит;
CaSO4 2H2O – гипс; Na2SO4·10H2O – мирабилит;
Галиды:
KCl – сильвин;
NaCl · KCl – сильвинит;
KCl ·MgCl2 ·H2O – карналлит; 3NaF· AlF3 – криолит;
Силикаты и алюмосиликаты: ZrSiO4 – циркон;
3BeO· Al2O3· 6SiO2 –берилл;
Неорганическая химия. Курс лекций |
-182- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Na2O (K2O) ·Al2O3 ·2SiO2 – нефелин.
Полиметаллическиее руды: FeTiO3 – ильменит (титанат); CaWO4 – шеелит (вольфрамат); PbCrO4 – кроксит (хромат) и др.
Некоторые металлы не образуют рудных залежей. Их принято называть рассеянными – Ga, In, Tl и др.
Получением металлов занимается металлургия – одна из наиболее древних отраслей химической технологии. Несмотря на то, что реальные процессы получения большинства металлов сложны, многостадийны и включают различные методы, в развитии современной металлургии легко прослеживаются основные направления: пирометаллургия, гидрометаллургия и электрометаллургия.
Пирометаллургия. Пирометаллургическими считаются методы высокотемпературного извлечения металлов из различных соединений. Чаще всего это процессы восстановления: более активными металлами Al, Mg, Ca, Na и др. (металлотермия), кремнием (силикатотермия), водородом, гидридами металлов и т. д.
В том случае, если не предъявляются особые требования к чистоте получаемого металла, восстановителем может быть углерод или CO (карботермия). Углерод применяется при восстановлении железа из Fe2O3 или Fe3O4 (доменный процесс), олова из касситерита, меди из куприта:
SnO2 + C = Sn + CO2 , 2Сu2О + С = 4Сu + CО2.
Не все металлы можно получить восстановлением углеродом или СО. Например, реакция
Cr2O3 + 3CO = 2Cr +3CO2, G0 = 274,6 кДж
не может протекать даже при довольно высоких температурах, в то время как алюмотермия легко осуществима
Cr2O3 + 2Al = 2Cr + Al2O3.
Металлотермия используется обычно при восстановлении наиболее устойчивых соединений.
Некоторые металлы (например, марганец) с углеродом образуют карбиды, поэтому в ряде случаев более экономичным методом является силикатотермия
MnO2 + Si = Mn + SiO2 .
Неорганическая химия. Курс лекций |
-183- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Восстановление водородом проводится, как правило, тогда, когда необходимо получить сравнительно чистый металл. Водород используется, например, для получения чистого железа; вольфрама из WO3; рения из
NH4ReO4; осмия из (NH4)2OsCl6 и др.
MoO3 + 3H2 = Mo + 3H2O, 2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O.
Сульфидные руды подвергают окислительному обжигу, а карбонатные
– прокаливанию. Полученные оксиды затем восстанавливают: 2PbS + 3O2 = 2PbO + 2SO2;
PbO +CO = Pb + CO2;
ZnCO3 = ZnO + CO2; 2ZnO + C = 2Zn + CO2 .
К пирометаллургии относят обычно и хлорную металлургию. Ее развитие по настоящему началось в 50-е годы прошлого столетия. Сущность метода заключается в хлорировании сырья в присутствии восстановителя или без него и дальнейшей переработке хлоридов. Например:
TiO2 + C + 2Cl2 = TiCl4 + CO2 , TiCl4 + 2Mg = Ti + 2MgCl2 .
Преимуществами метода хлорирования являются: высокая скорость процесса, полнота использования сырья, возможность разделения большого числа компонентов за счет различной летучести и термической устойчивости хлоридов.
Гидрометаллургия связана с низкотемпературными процессами получения металлов, протекающими в растворах (преимущественно в водных). В гидрометаллургических процессах обычно подбирается растворитель, который переводитврастворметаллиоставляетнераствореннойпустуюпороду
CuS + Fe2(SO4)3 = CuSO4 + 2FeSO4 + S.
Медь из раствора может быть выделена восстановлением более активным металлом или электролизом.
Гидрометаллургическим методом отделяют Ag, Au, Pb и другие металлы от пустой породы. Для перевода золота в раствор используют цианиды. Затем его восстанавливают из раствораболееактивным металлом
4Au + O2 + 8NaCN + 2H2O = 4Na[Au(CN)2] + 4NaOH,
Au + 2CN- – 1 ē = [Au(CN)2]- |
|
4 , |
|
||
O2 + 2H2O + 4ē = 4OH- |
|
1 |
Неорганическая химия. Курс лекций |
-184- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
4Au + O2 + 8CN- + 2H2O = 4 [Au(CN)2]- + 4OH- ,
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au .
Особое место в гидрометаллургии занимает экстракция – извлечение ценного компонента раствора с помощью растворителя, не смешивающегося с раствором. Часто в экстракции используют не чистый растворитель, а его раствор, содержащий подходящий реагент. В настоящее время создана целая отрасль металлургии, использующая различные химические экстрагенты для выделения металлов из смесей.
Электрометаллургия включает процессы получения металлов с применением электрического тока – это электротермия и электролиз.
Впервом случае электрический ток служит источником создания высоких температур (например, выплавка стали в электропечах); во втором – используется для непосредственного выделения металлов из соединений. Электролиз в настоящее время успешно применяется в промышленном получении щелочных и щелочноземельных металлов (электролиз
расплавов солей NaCl, CaCl2 и др.), алюминия.
Высокочистые металлы обладают улучшенными химическими, физическими, механическими, а в ряде случаев просто уникальными, свойствами. Например, хрупкие титан, цирконий, ниобий после очистки от следов кислорода, азота, водорода имеют высокую пластичность. Молибден, полученный
ввиде монокристалла, можно завязывать в петлю. Монокристаллы тугоплавких металлов не разрушаются в плазме, а высокочистое железо по устойчивости к коррозии не уступает "благородным" металлам.
Впоследние годы разработаны и успешно применяются методы полу-
чения металлов высокой степени чистоты, с помощью которых содержание примесей снижается до 10-8–10-10 %. Такая глубокая очистка достигается обычно сочетанием нескольких методов. Рассмотрим некоторые из них.
Химические методы. Большая часть их сводится к выделению в чистом виде какого-либо соединения металла с последующим его разложением. Например, тонкий порошок железа (пирофорное железо) может быть получен в результате термической диссоциации оксалата железа:
FeC2O4 = Fe + 2CO2
Титан, цирконий и некоторые другие металлы можно очистить йодидным способом. Металлический титан образует с парообразным йодом легколетучий TiJ4, который разлагается на раскаленных титановых нитях на чистый титан и свободный йод.
Ti + 2J2 , |
TiJ4 , |
Ti + 2J2 . |
черновой |
|
чистый |
Неорганическая химия. Курс лекций |
-185- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Дистилляционные методы. Эти методы основаны на различной летучести металла и примесей. Наиболее эффективным среди этих способов считается перегонка в вакууме. Она может быть многократной. Таким образом производится очистка Ca, Sr, Ba, Mg и др.
Кристаллизация из расплава. Сущностью данного метода является различное распределение примесей в твердой и жидкой фазах металла.
Широкое применение в практике получила зонная плавка (зонная кристаллизация). Образец очищаемого металла помещают в печь специальной конструкции, в которой нагревают до плавления лишь небольшой участок (зону) металла. При медленном передвижении этой печи вдоль образца перемещается и его расплавленная зона. Участок металла, который более не нагревается, начинает кристаллизоваться. Примеси растворимы в расплаве и переходят в соседнюю расплавленную зону. В результате по мере перемещения расплавленной зоны вдоль образца металла примеси также перемещаются по образцу и накапливаются в его конце. Этот конец обрезают и получают хорошо очищенный слиток металла.
Контрольныевопросыиупражнения
1.Какие продукты образуются при горении магния на воздухе? Напишите уравнения реакций их взаимодействия с водой.
2.Металлическая ртуть часто содержит примеси металлов – цинка, олова, свинца. Для их удаления ртуть обрабатывают раствором Hg(NO3)2. На чем основан такой способ очистки ртути?
3.Почему алюминий вытесняет водород из воды только при добавлении щелочи? Напишите уравнение соответствующей реакции.
4.Чем объясняется близость атомных радиусов ниобия и тантала, молибдена и вольфрама, технеция и рения?
5.Напишите уравнение взаимодействия Pt с окислительной смесью
HCl + HNO3.
6.Напишите электронную конфигурацию атома ванадия. Распределите валентные электроны по орбиталям. Определите возможные степени окисления.
7.При переработке 7 т золотоносной руды было израсходовано 45,8 кг цинка. Рассчитайте процентное содержание золота в руде. Сколько граммов золота извлечено из руды, если было получено 380 г Na[Au(CN)2]?
8.При обработке 80 г сплава алюминия с никелем раствором едкого натрия выделилось 28 л водорода (н. у.). Определите процентный состав сплава.
9.Необратимому гидролизу подвергаются соединения: гидрид калия, силицид бария, фосфид натрия, карбид бария, надпероксид калия, нитрид кальция, метаалюминат натрия, пероксид бария, карбид алюминия. Напишите уравнения соответствующих реакций.
Неорганическая химия. Курс лекций |
-186- |
РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
10.Металлический алюминий можно перевести в ионы [Al(OH)6]3-, AlO2-. Напишите молекулярные и ионно-молекулярные уравнения реакций. Укажите условия образования того и другого иона.
11.Цинк получают электролизом сульфатных растворов. Напишите соответствующие уравнения.
12.Серебро получают цианидным способом. Напишите соответствующие молекулярные и ионно-молекулярные уравнения реакций.
12.6.Химияs-металловиихсоединений
S-металлы составляют IА- и IIА-подгруппы Периодической системы элементов Д.И. Менделеева. Шесть металлов (Li, Na, K, Rb, Cs, Fr) называют щелочными, так как их гидроксиды хорошо растворимы в воде и полностью диссоциируют на ионы. Подгруппу IIА образуют элементы: Be, Mg, Ca, Sr, Ba, Ra. Ввиду большого сходства Ca, Sr и Ba со щелочными металлами IА-подгруппы их часто называют щелочно-земельными металлами. Франций, завершающий IА-группу, и радий, завершающий IIАгруппу, являются радиоактивными.
На предпоследнем уровне у атомов Li и Be два электрона, а у остальных элементов – восемь, что является причиной заметного отличия свойств лития от остальных щелочных металлов, а бериллия – от магния и щелочноземельных металлов. Атомы s-металлов – сильные восстановители. В пределах подгруппы от Li к Fr и от Be к Ra происходит увеличение радиусов атомов, уменьшение энергии ионизации и, следовательно, повышение их восстановительной активности.
Еион, кДж/моль |
520 |
496 |
419 |
403 |
375 |
384 |
rа, нм |
0,155 |
0,189 |
0,236 |
0,248 |
0,268 |
0,280 |
Еион, кДж/моль |
899 |
738 |
590 |
549 |
503 |
509 |
Э+ → Э2+ |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
rа, нм |
0,133 |
0,160 |
0,197 |
0,215 |
0,221 |
0,235 |
Сравнивая значения потенциалов ионизации, радиусов атомов s-металлов можно сделать следующие выводы:
–высокая восстановительная активность этих металлов проявляется при низких значениях их потенциалов (энергий) ионизации и электроотрицательностей (ЭО);
–в пределах подгруппы сверху вниз (от Li к Cs и от Be к Ba) происходит увеличение радиусов атомов, уменьшение энергии ионизации, и, следовательно, повышение их восстановительной активности. Поэтому щелочные металлы являются очень сильными восстановителями, легко отдавая электрон при химическом взаимодействии;
Неорганическая химия. Курс лекций |
-187- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
– атомы Be, Mg и щелочноземельных металлов имеют меньшие атомные радиусы, значительно большие энергии ионизации по сравнению с атомами щелочных металлов, и в итоге менее выраженные металлические свойства. Восстановительные свойства металлов IIА группы хотя и велики, но все же менее выражены, чем у элементов I группы.
Степень окисления щелочных металлов во всех соединениях +1, а бериллия, магния и щелочноземельных +2.
12.6.1. Распространениевприродеиполучение
Самым распространённым элементом в земной коре среди щелочных металлов является Na (2,5 мас. %), среди щелочноземельных – Ca (2,96 мас. %), наименее – соответственно Cs (3,7 · 10-4 масс. %) и Ве (6 ·10-4 мас. %). Франций радиоактивен и малодоступен, период полураспада его наиболее долгоживущего изотопа 223 Fr составляет всего 21,8 мин.
s-металлы находятся в природе в виде соединений.
|
IА – подгруппа |
|
IIА – подгруппа |
|
сильвинит |
KCl·NaCl |
|
||
сильвин |
KCl |
флюорит |
CaF2, |
|
карналлит |
KCl·MgCl2·6H2O |
кальцит |
CaCO3, |
|
галит |
NaCl |
магнезит |
MgCO3, |
|
мирабилит |
Na2SO4·10H2O |
|||
доломит |
MgCO3·CaCO3, |
|||
|
|
|||
|
|
гипс |
CaSO4·2H2O, |
Рубидий принадлежит к рассеянным элементам, своих минералов он не образует. Источником для получения Rb и Cs могут быть природные минерализованные воды.
В промышленности s- металлы получают электролизом расплава хлоридов (Li, Na, Be, Mg, Ca) или гидроксидов (K, Na), а также восстановлением в вакууме кальцием из хлоридов (Rb, Cs) или алюминия из ок-
сидов (Sr, Ba).
При электролизе расплавов на катоде выделяется металл
(Ме+ + е- = Ме, Ме²+ + 2е = Меº), а на аноде – хлор (2Cl¯ – 2e = Cl2°)
или кислород (4OH¯ – 4e = O2 + 2H2O). Металлотермическое восстановление протекает по уравнениям
2RbCl + Ca = 2Rb + CaCl2 ,
3SrO + 2Al = 3Sr + Al2O3 ,
BeF2 + Mg = Be + MgF2 .
Франций и радий получают путем ядерных реакций.
Неорганическая химия. Курс лекций |
-188- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
В связи с высокой химической активностью s-металлов их хранят в герметичной таре под слоем керосина или масла (за исключением Be, Mg).
12.6.2. Физическиесвойства
Все s-металлы серебристо-белого цвета, за исключением Cs, имеющего золотисто-жёлтую окраску. Щелочные металлы характеризуются низкими температурами плавления, которые равномерно уменьшаются от 181 (Li) до 29 ºС (Cs); малой плотностью, которая увеличивается от 0,53 (Li) до 1,87г/см3 (Cs) и высокой удельной электропроводностью. В кубической гранецентрированной решётке этих металлов наиболее прочная металлическая связь проявляется у атомов Li, что обусловливает его более высокую температуру плавления и низкую электропроводность по сравнению с другими щелочными металлами
(табл.12.3)
.Таблица 12.3
Физические свойства и распространение элементов ІА-группы
Металл |
|
Li |
Na |
K |
Rb |
Cs |
Fr |
|
|
|
|
|
|
|
|
t пл., 0C |
|
179,0 |
97,8 |
63,6 |
39,0 |
28,0 |
23,0 |
Плотность, г/см3 |
|
0,53 |
0,97 |
0,86 |
1,53 |
1,9 |
2,2 |
|
|
|
|
|
|
|
|
Содержание |
в |
3,2 10-3 |
2,5 |
2,5 |
1,5 10- |
3,7 10-4 |
Радиоакт. |
земной коре, мас. |
|
|
|
2 |
|
|
|
% |
|
|
|
|
|
|
|
Бериллий, магний и щелочноземельные металлы имеют большие температуры плавления и плотность по сравнению со щелочными металлами. Так как рассматриваемые металлы при кристаллизации образуют различные типы кристаллических решёток (Ве, Mg – гексагональную; Ca, Sr – в гранецентрированную кубическую; Ва – в объемно-центрированную кубическую), то температуры их плавления и плотности изменяются немонотонно. Так, наиболее легкоплавкий металл Mg (650 °С), наименее – Ве (1285 °С), самый лёгкий металл Са (1,54 г/см3), наиболее тяжёлый – Ва (3,76 г/см3). Их твёрдость значительно выше, чем щелочных металлов (например, бериллий имеет твёрдость стали, но хрупок) (табл. 12.4).
Таблица 12.4
Физические свойства и распространенность элементов ІІА группы
Металл |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
t пл., 0C |
1284 |
651 |
851 |
757 |
710 |
700 |
Плотность, |
1,85 |
1,74 |
1,54 |
2,63 |
3,76 |
6,00 |
г/см3 |
|
|
|
|
|
|
Содержание |
6 10-4 |
2,40 |
2,96 |
4 10-2 |
5 10-2 |
1 10- |
в земной |
|
|
|
|
|
10 |
коре, мас.% |
|
|
|
|
|
|
Неорганическая химия. Курс лекций |
-189- |
РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
12.6.3. Химическиесвойства
Отношение к неметаллам. При обычных условиях s-металлы окисляются кислородом воздуха. При этом Rb и Cs воспламеняются при обычных условиях, Na и К – при нагревании, а на поверхности Be и Mg образуются прочные оксидные плёнки ВеО и MgO, которые предохраняют их от дальнейшего окисления. Сгорая в кислороде, литий образует оксид – Li2O, натрий
– в основном пероксид Na2O2, калий, рубидий и цезий – надпероксиды КО2, RbO2, CsO2, а щелочноземельные металлы – оксиды СаО, SrO, ВаО.
Все металлы, за исключением Ве, взаимодействуют с водородом, образуя гидриды
2Na + H2 = 2NaH,
Ca + H2 = CaH2 .
Все s-металлы при нагревании взаимодействуют с неметаллами: галогенами, серой, фосфором и др., образуя соответственно галогениды (KCl ) , сульфиды (BaS), фосфиды (Na3Р). Известны карбиды стехиометрического (Nа4С, Ве2С) и нестехиометрического состава (ВеС2, Li2С2, СаС2, ВаС2). С азотом взаимодействуют Li, Be, Mg и щелочноземельные металлы с образованием нитридов (Li3 N, Ca3N2).
В целом, взаимодействие s-металлов с простыми веществами можно отразить схемами (рис. 12.2, рис. 12.3.):
а) Металлы IА группы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сплавы, |
интерметаллиды |
|
||||||||||||||||||||||||||||||||||
только Li |
|
|
Li2C2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭН |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
800 °C |
|
Ме |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Li |
|
Li2O |
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
О |
|
|
(изб. |
) |
|
|
|
|
|
|
|
|
|
|
|
|
Гаl |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
2 |
Э |
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||||||||||||||||||||||||||
Na |
|
|
Na2O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭГ (Г = F, Cl, Br, J) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с J |
|
|
при t |
|
|
|||||||||||||||||||
K, Rb, Cs |
|
|
ЭО2 |
Li, |
Na, |
|
|
K - при t |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
P |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
Э N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э3Р |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э2S, Э2Sn |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
(n max = 2(Li), 5(Na), |
6(K, Rb, Cs) |
|
||||||||||||||||||||||||||||||||||||||||
Рис 12.2
Неорганическая химия. Курс лекций |
-190- |
РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
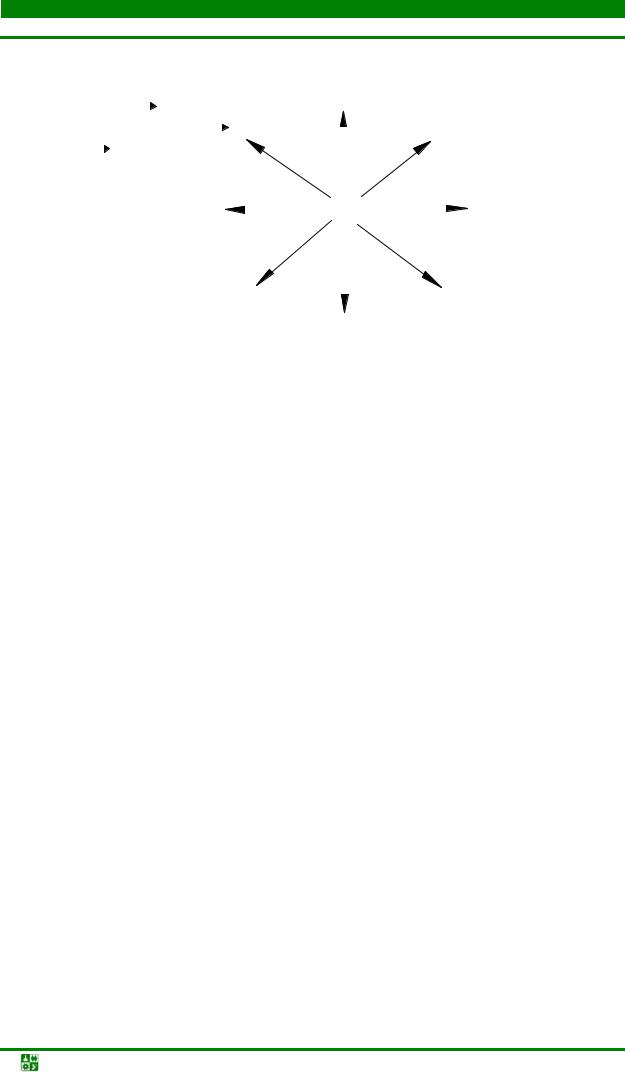
б) металлы IIА-группы
|
|
|
|
|
|
|
|
|
|
|
сплавы, |
интерметаллиды |
|
|
||||||||||||||||||||||||||
|
|
Be |
|
|
|
|
Be2C, BeC2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭН2 (кроме Be) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Mg, Ca, Sr, Ba |
|
|
|
|
|
|
|
|
|
|
|
|
Ме |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
ЭС2 |
(t ~1200 °C) |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mg при высоком Р |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
t |
|
Н |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
(реакция протекает |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
всреде аргона) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гаl |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
Э3Р2 |
|
|
|
|
|
|
|
|
|
|
Э |
|
|
2 |
|
|
|
|
ЭГ2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Э3N2 |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭО |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭS
Отношение к воде. В электрохимическом ряду напряжений s- металлы стоят далеко слева от водорода и имеют стандартные электродные потенциалы от –3,05В (Li) до –1,85В (Be). Наиболее отрицательное значение потенциала среди всех металлов имеет Li, что объясняется малым радиусом его иона Li + (0,068 нм) и высокой энергией гидратации (506 кДж/моль) в водном растворе. Из положения в ряду напряжений следует, что все металлы восстанавливают воду
2Li + 2H2O = 2LiOH + H2 ,
Ca + 2H2O = Ca(OH)2 + H2 .
При этом натрий плавится, калий – воспламеняется, рубидий и цезий взрываются, что объясняется выделением значительного количества тепла ( H < 0) и увеличением энтропии ( S < 0) при образовании иона Ме+. В то же время на поверхности бериллия и магния образуется защитная оксидная плёнка, которая предохраняет их от взаимодействия с водой. Однако магний с кипящей водой реагирует, так как в этих условиях оксидная плёнка, состоящая из Mg(OH)2, растворяется.
Отношение к кислотам. Все металлы взаимодействуют с разбавленными и концентрированными кислотами
2K + H2SO4(р) = K2SO4 + H2 ,
8Na +10HNO3(р) = NH4NO3 + 8NaNO3 + 3H2O , 4Ca + 5H2SO4(к) = H2S + 4CaSO4 + 4H2O .
Исключение составляют HF, H3PO4 и те металлы, фториды и фосфаты которых малорастворимы в воде (LiF, MgF2, CaF2, Li3PO4, Ca3(PO4)2 ).
Неорганическая химия. Курс лекций |
-191- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Бериллий пассивируется в холодных концентрированных растворах азотной и серной кислот но, являясь амфотерным металлом, взаимодействует и со щелочами, образуя бериллаты
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 .
12.6.4. Соединенияs-металлов
Гидриды – бесцветные твёрдые вещества, имеющие ионную кристаллическую решётку. Исключение составляют BeH2 и MgH2, которые занимают промежуточное положение между ионными и ковалентными соединениями и являются полимерами (BeH2)n, (MgH2)n за счет образования водородной связи между мономерами.
Термическая устойчивость гидридов щелочных металлов уменьшается от LiH к CsH, а среди гидридов щелочноземельных металлов самым устойчивым является CaH2.
При нагревании ионных гидридов происходит их разложение
2CsН =t H2 ↑ + 2Cs
Гидриды содержат анион Н-, определяющий их восстановительные свойства. Восстановительная активность ионных гидридов возрастает с увеличением относительной атомной массы металла, т. е. в ряду LiH → CsH и
CaH2 → BaH2 .
Все ионные гидриды получают при прямом взаимодействии металла с водородом. Являясь восстановителями, гидриды легко окисляются кислородом, водой, галогенами и др.
2RbH + O2 = 2RbOH,
CaH2 + 2H2O = Ca(OH)2 + 2H2↑.
Оксиды – твёрдые, термически устойчивые вещества, с ионной кристаллической решёткой, с очень высокими и сравнительно близкими по величине температурам плавления. Для Be, Mg и щелочно-земельных элементов они составляют 2825 0C для MgO и 2650 0C для SrO. Все оксиды ΙА- группы получают косвенным путём (кроме Li2O), оксиды металлов ІІАгруппы – непосредственно при взаимодействии металлов с кислородом
4Li + O2 = 2Li2O, Na2O2 + Na = 2Na2O, 2Mg + O2 = 2MgO.
Оксиды практически не проявляют окислительных свойств и не восстанавливаются водородом (∆G > 0). Все оксиды за исключением BeO и MgO энергично взаимодействуют с водой, а также с кислотами. Оксид бериллия
Неорганическая химия. Курс лекций |
-192- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
проявляет амфотерные свойства и взаимодействует при нагревании с растворами и расплавами щелочей
BeO + 2NaOH + H2O = Na2[Be(OH)4], BeO + 2NaOH = Na2BeO2 + H2O.
Пероксиды – твёрдые кристаллические вещества, являющиеся солями пероксида водорода H2O2. Их получают окислением кислородом металла (Na2O2) – для ΙА-группы или оксида (BaO2) для IIА-группы, а также действием пероксида водорода на гидроксиды
2Na + O2 = Na2O2 ,
2BaO + O2 = 2BaO2 ,
Mg(OH)2 + H2O2 = MgO2 + 2H2O.
Пероксиды являются сильными окислителями, так как содержат диамагнитный ион [O2]2-, менее устойчивый, чем молекула О2
Na2O2 + 2FeSO4 + 2H2SO4 = Na2SO4 + Fe2(SO4)3 + 2H2O.
BaO2 + 2KI + 2H2O = Ba(OH)2 + I2 + 2KOH.
Вто же время пероксиды могут проявлять восстановительные свойства
идиспропорционировать
5Na2O2 + 2KMnO4 + 8H2SO4 = 5Na2SO4 + 2MnSO4 + 5O2 + K2SO4 + 8H2O, 2Na2O2 + 2CO2 = 2Na2CO3 + O2 ,
[O2]2- - 2e = O2 |
|
1 |
|
||
[O2]2- +2e = 2O2- |
|
1. |
|
При растворении в воде эти соединения подвергаются практически полному гидролизу, так как кислотные свойства H2O2 выражены очень слабо
Na2O2 + H2O = 2NaOH + H2O2 ,
BaO2 + 2H2O = Ba(OH)2 + H2O2 .
Надпероксиды (супероксиды) щелочных металлов – твердые вещества, являются сильными окислителями и разлагаются под действием воды, влажного воздуха, разбавленных кислот с выделением кислорода:
4KO2 + 2H2O = 4KOH + 3O2 , [O2]- – e- = O2
[O2]- + 3e- =2O2- 1.
Неорганическая химия. Курс лекций |
-193- |

РАЗДЕЛ 6. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Тема 12. Свойства металлов и их соединений
Гидроксиды щелочных и щелочно-земельных металлов – сильные основания, кроме Mg(OH)2 и Be(OH)2, т. е. основные свойства усиливаются от LiOH к FrOH и от Be(OH)2 к Ba(OH)2. Все гидроксиды – твердые кристаллические вещества, хорошо растворимые в воде, за исключением LiOH, Be(OH)2 и Mg(OH)2. Они взаимодействуют с кислотами. Гидроксид бериллия амфотерен.
Be(OH)2 + 2HCl = BeCl2 + 2H2O, Be(OH)2 + 2NaOH = Na2[Be(OH)4] .
Следует отметить, что гидроксид магния растворяется в воде в присутствии солей аммония, вследствие образования более слабого основания – гидроксида аммония:
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH4OH .
Соли щелочных металлов хорошо растворимы в воде, а многие соли металлов IIА-подгруппы малорастворимы в воде. Соли бериллия и магния в водном растворе подвергаются гидролизу.
MgCl2 + H2O = MgOHCl + HCl .
Присутствие в воде ионов магния и кальция в виде гидрокарбонатов обуславливает её жёсткость, устраняемую, например химическим путём:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl .
Соли лития и бериллия существенно отличаются по свойствам от солей других s-металлов. Так, нитратные соли лития при нагревании разлагаются с образованием оксида, а соли остальных щелочных металлов с образованием солей, например:
4LiNO3 = 2Li2O + 4NO2 + O2 , 2NaNO3 = 2NaNO2 + O2 .
Галогениды бериллия, в отличие от галогенидов магния и щелочноземельных металлов, могут образовывать комплексы
BeF2 + 2KF = K2[BeF4] или BeF2 + SiF4 = Be[SiF6] .
Окислительно-восстановительные свойства соединений s-металлов проявляются в реакциях с участием сильных восстановителей – гидридов и сильных окислителей – пероксидов и надпероксидов.
Пероксиды и надпероксиды проявляют окислительные свойства, но при действии сильных окислителей сами окисляются, могут диспропорционировать.
BaO2 + 2KI + 2H2O = I2 + Ba(OH)2 + 2KOH ,
5Na2O2 + 2KMnO4 + 8H2SO4 = 5O2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O.
Неорганическая химия. Курс лекций |
-194- |
