
- •Кафедра биохимии
- •Общие и специфические свойства крови
- •Диагностическое значение общих и специфических свойств крови
- •Состав крови
- •1. Клеточный состав крови
- •Изображение форменных элементов крови
- •2. Межклеточное вещество крови
- •Химический состав плазмы крови
- •Белки плазмы крови
- •Фракции белков плазмы крови
- •I. Альбумины
- •II. Α1-Глобулины
- •III. Α2-Глобулины
- •IV. Β-Глобулины
- •V. Γ-Глобулины
- •Ферменты плазмы крови
- •Лекция № 23 Тема: Биохимия крови 2. Особенности обмена в эритроцитах и лейкоцитах
- •ФункциИ эритроцитов
- •Строение эритроцитов
- •Химический состав эритроцитов
- •1. Плазмолемма эритроцитов
- •2. Цитоплазма эритроцитов
- •Особенность обмена веществ и энергии в эритроците
- •1. Особенность белкового обмена в эритроцитах
- •2. Особенность обмена нуклеотидов в эритроцитах
- •3. Особенность липидного обмена в эритроцитах
- •4. Особенность углеводного обмена в эритроцитах
- •5. Энергетический обмен в эритроцитах
- •6. Обезвреживание активных форм кислорода в эритроцитах
- •7. Обмен метгемоглобина
- •Строение гема
- •Использование гема
- •Синтез гема
- •Нарушения синтеза гема. Порфирии
- •Классификации порфирий
- •Синтез гемоглобина
- •Строение гемоглобина
- •Функции гемоглобина
- •Производные гемоглобина
- •Катаболизм гемоглобина
Строение гема
|
|
Гем- это порфирин, в центре которого находитьсяFe2+.Fe2+включается в молекулу порфирина с помощью 2 ковалентных и 2 координационных связей. В зависимости от заместителей различают несколько типов порфиринов: протопорфирины, этиопорфирины, мезопорфирины и копропорфирины. В основе порфириновнаходитсяпорфин, который представляет собой конденсированную систему из 4 пирролов, соединенных между собой метиленовыми мостиками (-СН=). Молекула гема имеет плоское строение. При окислении железа, гем превращается в гематин(Fe3+). |
Использование гема
Гем является простатической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450, ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы. Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени, содержащие цитохром Р450.
Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т.д.
Синтез гема
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах — для образования цитохрома Р450.
1). Аминолевулинат-синтаза, пиридоксальзависимый фермент, в матриксе митохондрий катализирует образование 5-аминолевулиновой кислоты (5-АЛК) из глицина и суцинил-КоА. Суцинил-КоА поступает из ЦТК. Реакцию ингибирует и репрессирует гем. В ретикулоцитах реакцию индуцирует железо (через железосвязывающий белок и железочувствительный элемент (IRE)). Дефицит пиридоксальфосфата снижает активность аминолевулинатсинтазы. Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфаниламиды), инсектициды, канцерогенные вещества являются индукторами аминолевулинатсинтазы. Это связано с возрастанием потребления гема системой цитохрома Р450, который участвует в метаболизме этих соединений в печени.

Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму.
2). Порфобилиноген-синтаза(Аминолевулинатдегидратаза) цитоплазматическийZn-содержащий фермент, соединяет 2 молекулы 5-аминолевулиновой кислоты в молекулу порфобилиногена. Реакцию ингибирует гем и ионы свинца. Поэтому, при отравлении свинцом в крови и моче повышается концентрация 5-АЛК.
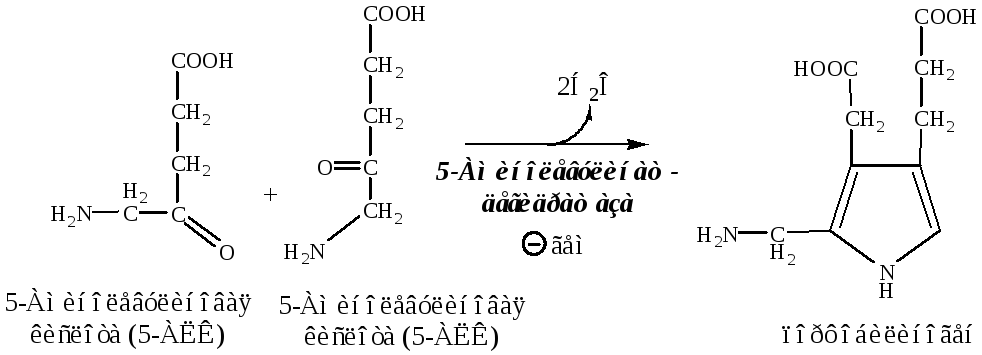
3). Порфобилиногендезаминаза в цитоплазме дезаминирует (-4NH4+) 4 молекулы порфобилиногена в молекулу гидроксиметилбилана.
4). Уропорфириноген III косинтазав цитоплазме дегидрирует гидроксиметилбилан в молекулу уропорфириногена III. Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфириноген I.
5). Уропорфириногендекарбоксилазадекарбоксилирует (-4СО2) в цитоплазме уропорфириноген III до копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии.
6). Копропорфриноген III оксидазав митохондриях декарбоксилирует (+ О2, -2СО2) копропорфириноген III в протопорфириноген IX.
7. Протопорфириногеноксидазав митохондриях окисляет (-6Н+) протопорфириноген IX в протопорфирин IX.
8). Феррохелатазав митохондриях встраиваетFe2+в молекулу протопорфирина IX с образованием гема. Источником железа для синтеза гема служит ферритин.

