
- •ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА (ЭХМА)
- •1. ПОЛЯРОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •1.1. Рабочая программа
- •1.2. Теоретические основы полярографии
- •1.3. Лабораторная работа «Определение ионов Си2+, Сd2+, Ni2+, Zп2+ при совместном присутствии»
- •1.4. Проблемные вопросы
- •2. АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •2.1. Рабочая программа
- •2.2. Теоретические основы
- •2.3. Лабораторная работа «Определение Zn2+ (Сd2+) титрованием раствором К4[Fе(СN)6] с двумя платиновыми электродами»
- •2.4. Проблемные вопросы
- •3. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •3.1. Рабочая программа
- •3.2. Теоретические основы
- •3.3. Потенциометрическое титрование
- •3.5. Лабораторная работа «Потенциометрическое комплексонометрическое титрование железа (Ш)»
- •3.6. Лабораторная работа «Определение концентрации электролита (кислота, гидролизующаяся соль) методом ионометрии»
- •3.7. Проблемные вопросы
- •4. ПРИКЛАДНАЯ СПЕКТРОСКОПИЯ
- •4.1. Классификация методов
- •4.2. Рабочая программа
- •4.3. Теоретические основы фотометрического анализа
- •4.6. Проблемные вопросы
- •5. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
- •5.1. Рабочая программа
- •5.2. Классификация тография. методов
- •5.3. Общая характеристика ионообменной хроматографии
- •5.4. Разделение Ni2+ и Zn2+ на анионите АВ-17
- •5.5. Проблемные вопросы и задания
- •ЛИТЕРАТУРА
16
3.ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
3.1.Рабочая программа
Теоретические основы метода(уравнение Нерста, влияние внешних факторов на величину электродного потенциала). Классификация методов. Титрование кислот, оснований, солей, осадительное, окислительновосстановительное, комплексонометрическое (условия, выбор электродов, расчеты); рН-метрия, методы определения рН, стеклянный электрод. Ионометрия, методы определения концентрации ионов. Ионоселективные электроды (классификация, возникновение мембранного потенциала, уравнение потенциала ИСЭ). Аппаратура метода.
|
|
3.2. Теоретические основы |
|
|
|
|
|
||||
Потенциометрические методы основаны на измерении . э.обратимыхд.с |
|
||||||||||
электрохимических |
цепей, |
когда |
рабочий (индикаторный) |
электрод имеет |
|
||||||
потенциал, близкий к равновесному. Потенциометрические методы анализа |
|
||||||||||
подразделяют на прямую потенциометрию и потенциометрическое титрование. |
|
|
|||||||||
Для |
проведения |
потенциометрического |
анализа |
обычно |
собира |
||||||
гальванический |
элемент, на |
одном |
электроде |
которого |
протекает |
||||||
электрохимическая |
реакция с участием определяемого иона или, |
ио |
|||||||||
реагирующего с |
определяемым. Этот |
электрод |
называют |
измерительным |
|
||||||
(рабочим, индикаторным). |
Потенциал |
индикаторного |
электрода |
связан |
|||||||
уравнением Нернста с концентрацией (активностью) определяемого иона: |
|
|
|||||||||
|
RТ |
ааx |
0.059 |
|
[ОХ]γох |
|
|
|
|
|
|
Е = Е° + ---- ln |
--- = Е° + ------- lg--------- |
|
|
|
|
|
|||||
|
Z F |
аred |
Z |
[Red]γRed |
|
|
|
|
|
||
Второй |
электрод - сравнения, |
его |
потенциал должен оставаться |
|
|||||||
постоянным независимо от протекания каких-либо реакций в анализируемом растворе, воспроизводимым и устойчивым во времени. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный.
Индикаторный электрод тоже должен удовлетворять ряду требований: достаточно высокой обратимостью по отношению к определяемому, ион воспроизводимости, большoй скорости установления равновесного потенциала,
химической |
скорости. Выбор |
индикаторного |
электрода |
зависит |
от типа |
||||
потенциал определяющей |
системы. Так, |
для |
определения |
+ |
Н или |
- |
|||
|
ОН |
||||||||
используются |
стеклянные |
|
электроды |
с |
водородной |
|
функцией, оксидные |
||
(сурьмяный), хингидронный. Для определения катионов и анионовэлектроды второго рода или ионселективные с соответствующей функцией. Электроды I рода: Аg+ / Аg, Нg2+ / Нg, Рt - отвечают всем требованиям и могут применяться для определения Аg+ и Нg2+ в титровании.
17
3.3. Потенциометрическое титрование
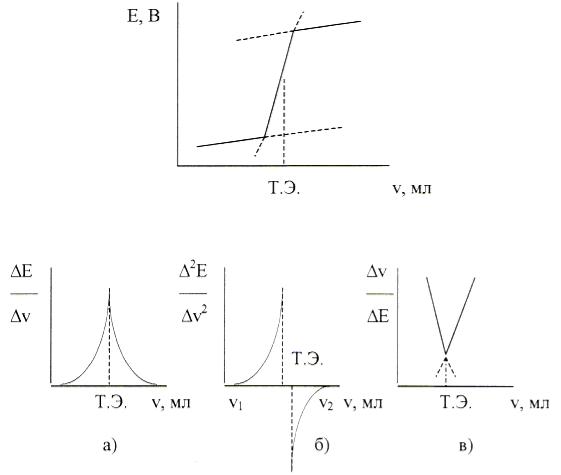
Потенциометрическое титрование - это объемно-аналитический метод, в котором точку эквивалентности определяют по резкому изменению(скачку) потенциала вблизи точки эквивалентности. Кривые потенциометрического титрования могут быть представлены в интегральном(рис.3.1) и дифференциальном (рис.3.2) виде.
Рис. 3.1. Интегральная кривая потенциометрического титрования
Рис. 3.2. Кривые потенциометрического титрования: |
|
|
а) дифференциальная; |
б) по второй производной; в) кривая Грана. |
|
Определение точки |
эквивалентности по дифференциальным |
кривым |
значительно точнее, чем по простой зависимости Е = f(V).
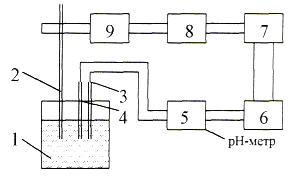
Современные установки потенциометрического титрования представляют собой автотитраторы, в качестве измерителя э.д..сприменяются высокоомные милливольтметры (рН-метры, ионометры). Схема установки для автоматического титрования (типа БАТ-15) представлена на рис.3.3.
В емкость с анализируемым раствором1 вводится дозирующая трубка 2 для подачи титранта, индикаторный электрод 4 и электрод сравнения3 (хлорсеребрянный). Подача титранта регулируется клапаном9. Напряжение Ех, пропорциональное э.д.с. системы, с выхода рН-метра 5 подается на вход БАТ, где сравнивается с заранее заданным напряжением 0Е на задатчике конечной точки
18
титрования 6. Разность заданной и экспериментально наблюдаемой величины ЕхЕ0 через усилитель 7 подается на бесконтактное реле8, которое управляет работой электромагнитного клапана 9, открывающего или закрывающего подачу титранта. При Eх = Е0 клапан прекращает подачу титранта. Объем рабочего раствора отсчитывают по бюретке.
В потенциометрическом титровании используют все типы аналитических реакций, которые отвечают следующим требованиям: высокой скорости химической реакции; протеканию реакции стехиометрически, до конца; возможности выбора индикаторного электрода.
Рис. 3.3. Схема установки для автоматического титрования
|
3.4. Прямая потенциометрия |
|
|
Методы |
прямой |
потенциометрии(ионометрии) основаны |
на |
непосредственном применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной э.д..с цепи или потенциалу электрода. Ионометрия интенсивно развивается в связи с успехами в конструировании и улучшении качест ионоселективных электродов (ИСЭ), позволяющих проводить быстро и точно определение концентрации или активности ионов.
ИСЭ - это электрохимические датчики, позволяющие потенциометрически определять некоторые ионы в присутствии других. Такой электрод представляет собой гальванический полуэлемент, состоящий из ионоселективной мембраны, внутреннего контактир\тощего раствора и внутреннего электрода сравнения. Для практического удобства все они располагаются в одном корпусе. ИСЭ могут иметь мембраны в любом агрегатном состоянии - твердом, жидком, газовом. Стеклянная мембрана гель, занимает промежуточное состояние между твердой и жидкой, теория их изучена в курсе физической химии.
В |
качестве гомогенных твердых мембран используются тонкие пластинки |
||||
кристаллических соединений, |
монокристаллов, сплавов, тонкодиспергированных |
|
|||
кристаллов, обладающих ионной проводимостью. |
|
|
|
||
В |
гетерогенных |
твердых |
мембранах |
активные |
част |
|
|
|
19 |
|
|
(труднорастворимые |
соли |
металлов«хелатных» |
соединений) внедрены и |
||
закреплены |
в |
инертной |
матрице |
из |
поливинилхлорида, полистирола, |
силиконового каучука и т.п. |
|
|
|
||
В основе возникновения потенциала ИСЭ лежит ионный , обме аналогичный обмену ионами Н+ между раствором и гелем стекла.
RT
Еинд = К + ----- + lg ам . z F
Активность определяемого иона может быть рассчитана по уравнению:
|
(Eинд - Eoинд) z F |
lg ам = |
-----------------------------, |
|
2.303 R Т |
где: EИНД. - экспериментально найденный потенциал ИСЭ. Его находят по э.д.с. исследуемого элемента:
EИНД. = ЕСР. – Е - ЕД,
где: Е - э.д.с. элемента; Еср - потенциал электрода сравнения;
Ед - диффузионный потенциал.
Отсюда: |
|
|
|
|
[Е-(Еср -Ео и н д . + Ед )]zF |
рам= - lg ам |
= ------------------------------------- |
|
|
|
2.303 R Т |
Так как: |
ам = См * γм |
|
|
[E – (Eср - Eoинд+ Ед)]z F |
|
р См = - lg См = ---------------------------------------- |
- lg γм |
|
|
|
2.303 R Т |
Аналитическое использование ИСЭ опирается на эти закономерности.
Так как выражение в скобках трудно рассчитать, существ\тот трудности, связанные с неопределенностью коэффициентов активности отдельного иона, то в практике используются несколько приемов ионометрии.
1) Метод градуировочного графи.ка Для построения градуировочного графика измеряют Е элемента при нескольких концентрациях(не
20
меньше трех) определяемого иона и постоянной ионной силе. Строят
график Е° = f(-lg С ). Затем определяют Е, помещая индикаторный
п х
электрод в анализируемый раствор и по величине Е и градуировочному
х
графику находят концентрацию иона в анализируемом растворе. При этом в анализируемом растворе стремятс я создат ь тако й ж е солево й фо н и ионну ю силу, чт о и в стандартных растворах.
2) Метод добавок. Измеряют Ех, добавляют в тот же раствор стандартный
раствор и снова измеряют +Е . Добавление стандартного раствора
х д об
практически не изменяет ионную силу, если в исследуемый раствор был добавлен индифферентный электролит
CСТ.VCТ. |
-∆Е / (0,059/Z) VX -1 |
Cx = -------------- (10 |
- ------------- ) |
Vx+Vст.+Vф |
Vx+Vст.+Vф |
∆Е = Ех+доб. - Ех |
|
Метод добавок позволяет находить концентрацию очень разбавленных растворов.
3)Метод концентрационного элемента. Составляется концентрационный элемент с двумя одинаковыми ИСЭ и помещают один из них в раствор с известной концентрацией определяемого иона, а другой в анализируемый раствор. Э.д.с. такого элемента:
RТ Сстγст
Е= ---1n-------- +
ЕD.
zF Схγх
Если состав и ионная сила обоих растворов примерно одинаковы, то
|
RТ |
Сст |
Ед → 0, а γст ≈ γх , |
то Е = --- 1п ---- |
|
|
zF |
Сx |
При Е = О Сх |
= Сст. Выполнить условие Е= 0 можно разбавлением |
|
стандартного раствора раствором фонового электролита. Таким образом можно получить значение Е до и после = Е0. Построить кривую линейного титрования в координатах Е= f(lg Сст), точка ее пересечения с осью абсцисс соответствует равенству Сх = Сст., так как здесь Е = 0 [1-4,8].
