
12
.doc12.
Внутренняя энергия (U).
Энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц.
Внутренняя энергия – однозначная функция термодинамического состояния системы, в каждом состоянии система обладает определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). При переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
К внутренней энергии не относится кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия 1 моль газа.
В идеальном газе молекулы между собой
не взаимодействуют, поэтому внутренняя
энергия 1 моль газа равна сумме кинетических
энергий
![]() молекул:
молекул:
![]() .
.
Внутренняя энергия массы m газа.
![]() ,
где M – молярная масса,
v – количество вещества.
,
где M – молярная масса,
v – количество вещества.
Работа газа.
Работа расширения идеального газа.
Если газ, расширяясь, передвигает поршень
на расстояние dt, то
производит над ним работу
![]() ,
,
![]() .
.
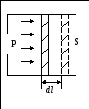
Эта формула справедлива при любом изменении объема твердых, жидких и газообразных тел.
Полная работа А, совершаемая газом
при изменении его объема от
![]() до
до
![]() ,
,
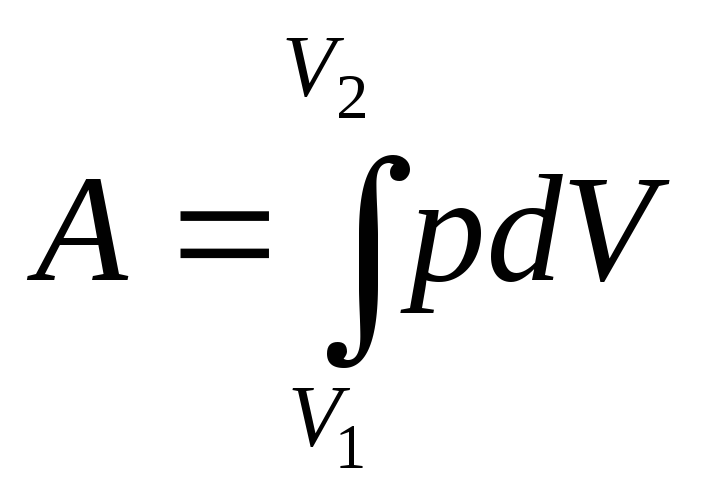 .
.
Графическое изображение работы.
Изменение давления газа при его расширении задается на рисунке произвольной кривой.
При увеличении объема на dV
совершаемая газом работа равна pdV,
т.е. определяется площадью закрашенной
полоски. Полная работа, совершаемая
газом при расширении от объема
![]() до объема
до объема
![]() определяется площадью, ограниченной
осью абсцисс, кривой p(V)
и прямыми
определяется площадью, ограниченной
осью абсцисс, кривой p(V)
и прямыми
![]() и
и
![]() .
.

Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров неравновесны, но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному).
Первый закон термодинамики.
Опыт показывает, что в соответствии с
законом сохранения энергии при любом
способе перехода системы из первого
состояния во второе изменение внутренней
энергии
![]() или
или
![]() - первое начало термодинамики. В
дифференциальной форме:
- первое начало термодинамики. В
дифференциальной форме:
![]() ,
где dU – бесконечно
малое изменение внутренней энергии
системы,
,
где dU – бесконечно
малое изменение внутренней энергии
системы,
![]() - элементарная работа,
- элементарная работа,
![]() -
бесконечно малое количество теплоты.
В этом выражении dU
является полным дифференциалом, а
-
бесконечно малое количество теплоты.
В этом выражении dU
является полным дифференциалом, а
![]() и
и
![]() таковыми
не являются.
таковыми
не являются.
Первое начало термодинамики – закон сохранения и превращения энергии применительно к термодинамическим процессам.
Если система периодически возвращается
в первоначальное состояние, то изменение
ее внутренней энергии
![]() .
Тогда, согласно первому началу
термодинамики, A=Q,
т.е. вечный двигатель первого рода
– периодически действующий двигатель,
который совершал бы большую работу, чем
сообщенная ему извне энергия, - невозможен.
.
Тогда, согласно первому началу
термодинамики, A=Q,
т.е. вечный двигатель первого рода
– периодически действующий двигатель,
который совершал бы большую работу, чем
сообщенная ему извне энергия, - невозможен.
