2579
.pdf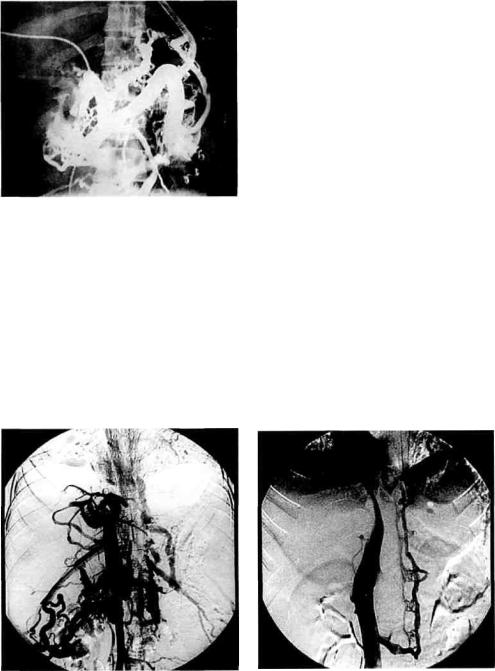
ностей селезеночной, печеночной ар- |
|
|
|
|
|
|
||||||
терий, воротной вены и ее притоков, |
|
|
|
|
|
|
||||||
нижней полой и печеночных вен |
|
|
|
|
|
|
||||||
имеет большое значение при реше- |
|
|
|
|
|
|
||||||
нии вопроса об операции. Катетери- |
|
|
|
|
|
|
||||||
зация сосудистых бассейнов исполь- |
|
|
|
|
|
|
||||||
зуется при этом и для определения |
|
|
|
|
|
|
||||||
давления. Кроме прямых методов |
|
|
|
|
|
|
||||||
портоманометрии, существуют спо- |
|
|
|
|
|
|
||||||
собы с заклиниванием катетера в пе- |
|
|
|
|
|
|
||||||
ченочных венах, измерение давления |
|
|
|
|
|
|
||||||
в варикозных венах пищевода, кото- |
|
|
|
|
|
|
||||||
рое коррелирует с портальным дав- |
|
|
|
|
|
|
||||||
лением. |
|
|
|
|
|
|
|
|
|
|
||
Визуализация и тензиометрия сосу- |
|
|
|
|
|
|
||||||
дов портального русла могут быть до- |
|
|
|
|
|
|
||||||
полнены оценкой печеночного крово- |
|
|
|
|
|
|
||||||
тока методами разведения красителей |
Рис. 10.9. Целиакография при компен- |
|||||||||||
и их экстракции из плазмы, примене- |
||||||||||||
сированной стадии портальной |
гипер- |
|||||||||||
нием электромагнитных флоуметров, |
||||||||||||
тензии. Деформация и обеднение внут- |
||||||||||||
хотя в последние годы предпочтение |
||||||||||||
рипеченочного артериального |
сосудис- |
|||||||||||
в определении кровотока |
отдается |
того рисунка. |
|
|
|
|||||||
методам, основанным на эффекте |
|
|
|
|
|
|
||||||
Допплера. |
|
|
|
|
|
|
|
|
|
|||
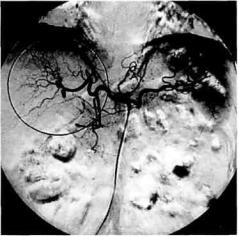
Как показывает опыт нашей кли- |
и печеночные, а также желудочно- |
|||||||||||
ники, ангиографические методы и |
сальниковая артерии. Печень имеет |
|||||||||||
данные манометрии позволяют до- |
тенденцию к уменьшению, а селезен- |
|||||||||||
статочно |
точно определить |
стадию |
ка продолжает прогрессивно увеличи- |
|||||||||
патологического процесса и динами- |
ваться, отмечается явное замедление |
|||||||||||
ку перестройки воротно-печеночно- |
наступления венозной фазы целиа- |
|||||||||||
го кровообращения при портальной |
кографии. Помимо резкого обедне- |
|||||||||||
гипертензии. |
|
|
ния артериального сосудистого ри- |
|||||||||
Ангиоархитектоника в компенси- |
сунка печени, присоединяются нару- |
|||||||||||
рованной стадии портальной гипер- |
шения |
внутрипеченочной |
порталь- |
|||||||||
тензии характеризуется лишь уме- |
ной ангиоархитектоники, появляется |
|||||||||||
ренным расширением и небольшой |
штопорообразная извитость |
артери- |
||||||||||
извитостью |
селезеночной |
артерии, |
альных |
разветвлений, |
расширяется |
|||||||
увеличением печени и селезенки. От- |
не только селезеночная, но и ворот- |
|||||||||||
мечается некоторая тенденция к за- |
ная вена. Для этой стадии заболева- |
|||||||||||
медлению венозной фазы целиакогра- |
ния характерно изменение порталь- |
|||||||||||
фии. |
Внутрипеченочный сосудистый |
ного кровотока в направлении час- |
||||||||||
рисунок обеднен лишь по периферии |
тично гепатофугального. Ретроград- |
|||||||||||
органа, а внутрипеченочная пор- |
ное |
контрастирование |
варикозных |
|||||||||
тальная |
ангиоархитектоника |
мало |
вен пищевода и желудка происходит |
|||||||||
отличается |
от нормы (рис. |
10.9). |
||||||||||
через левую желудочную и короткие |
||||||||||||
Среднее портальное давление в этой |
||||||||||||
желудочные вены. Среднее порталь- |
||||||||||||
стадии заболевания составляет 283,0 |
||||||||||||
ное |
давление составляет 393,6 ± ± |
|||||||||||
± 12,4 мм вод. ст. |
|
|
||||||||||
|
|
11,6 |
мм вод.ст. (рис. 10.10; 10.11). В |
|||||||||
В |
субкомпенсированной |
стадии |
||||||||||
декомпенсированной |
стадии |
от- |
||||||||||
портальной |
гипертензии селезеноч- |
|||||||||||
мечается удлинение не только селе- |
||||||||||||
ная артерия удлиняется с появлени- |
||||||||||||
зеночной, но и всех печеночных ар- |
||||||||||||
ем патологической извитости. |
Рас- |
|||||||||||
терий. Селезенка достигает больших |
||||||||||||
ширяется не только селезеночная, но |
размеров, наступление венозной фа- |
|
|
|
521 |
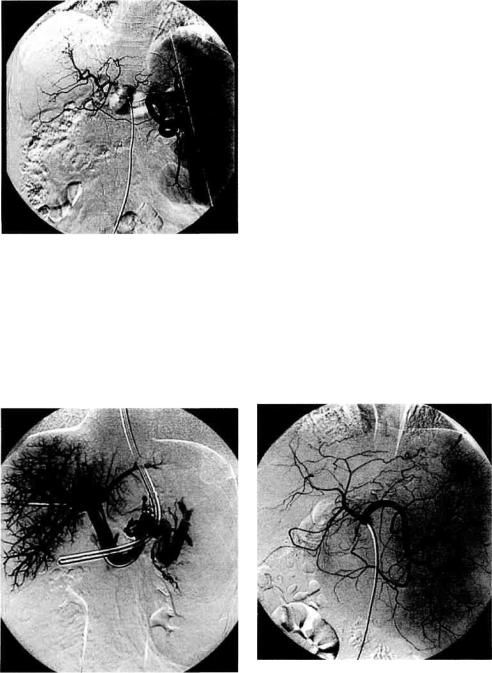


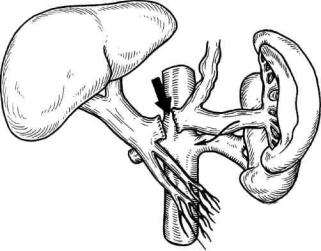
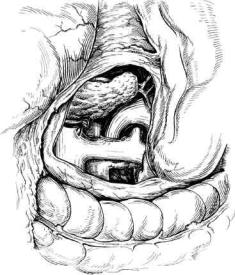
Рис. 10.17. Дистальное спленоренальное шунтирование. Анастомоз бок в бок наложен между дистальным отделом селезеночной вены и левой почечной веной. Селезеночная вена прошита и пересечена в проксимальном отделе.
В последние |
годы предпочтение |
лудочной железы. Выделяют левую |
||||
отдается парциальным Н-образным |
почечную вену. Селезеночную вену |
|||||
анастомозам и в большей степени опе- |
пересекают, проксимальный конец |
|||||
рациям дистального спленоренально- |
перевязывают, а дистальный исполь- |
|||||
го шунтирования [Плеханов А.Н., |
зуют для создания соустья. В почеч- |
|||||
1996]. Они обеспечивают адекватную |
ной вене формируют отверстие соот- |
|||||
декомпрессию воротной системы, в |
ветственно диаметру |
селезеночной |
||||
меньшей степени влияя на естест- |
вены и накладывают анастомоз по |
|||||
венную циркуляцию крови. После- |
типу конец в бок (рис. 10.17; 10.18). |
|||||
операционная |
энцефалопатия |
при |
Если наложить шунт без натяжения |
|||
селективном анастомозе наступает в |
не удается, используют аутовену (на- |
|||||
3 раза реже, чем при неселективном: |
иболее близка по диаметру яремная |
|||||
27 и 75 % соответственно [Mil-lucan |
вена) либо синтетический протез. |
|||||
W. et al., 1985]. Технически на- |
Применение оптимального по диа- |
|||||
ложение |
подобных |
анастомозов |
метру протеза, изготовленного из по- |
|||
сложнее, к тому же они создают на- |
литетрафлюороэтилена, |
значительно |
||||
иболее узкое сообщение между дву- |
снижает риск стеноза или окклюзии |
|||||
мя венозными системами, поэтому |
портосистемного селективного шун- |
|||||
склонны к тромбозу. В связи с этим |
та [Collins, 1994]. У детей возможно |
|||||
их рекомендуется накладывать толь- |
использование для создания соустья |
|||||
ко в тех случаях, если селезночная |
вены левого надпочечника [Mazarie- |
|||||
вена имеет достаточные размеры. |
gos G.V. et al., 1998]. |
|
||||
Хирургическое |
вмешательство |
вы- |
При тщательном отборе больных |
|||
полняют |
посредством |
верхнесре- |
результаты операции можно считать |
|||
динной или верхнепоперечной лапа- |
удовлетворительными: |
летальность |
||||
ротомии. |
Производят |
мобилизацию |
составляет 7 %, частота энцефалопа- |
|||
желудочно-кишечной связки, затем |
тии — 8 %, рецидивов — 5 % [Мег- |
|||||
препаровкой по нижнему краю под- |
cado et al., 1995]. |
|
||||
желудочной железы выделяют селезе- |
Хирургические вмешательства, на- |
|||||
ночную вену на протяжении 5—6 см. |
правленные на уменьшение притока |
|||||
Тупым и острым путем вскрывают за- |
крови в портальное русло, в послед- |
|||||
брюшинную клетчатку, |
ориентируясь |
нее время отходят на задний план, |
||||
по нижнему краю хвоста подже- |
|
поскольку сопряжены с рядом отри- |
||||
526 |
|
|
|
|
|
|