
Бромид натрия
.doc-
Общие сведения.
Формула:
NaBr
Натрия бромид, бромистый натрий, NaBr, соль; бесцветные кристаллы, плотность 3,20 г/см3, tпл 760 ?С. Растворимость в воде (%): 48,6 (25 ?С), 54,8 (100 ?С); из водных растворов при обычной температуре кристаллизуется NaBr×2H2O.
-
Получение.
Получают сжиганием натрия в парах брома, взаимодействием брома с аммиачным раствором карбоната натрия или бромида железа (II) с карбонатом натрия.
-
Качественный анализ.
-
Аналитические реакции на катион натрия.
-
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция - ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl
+ Zn(UO2)3(CH3COO)8
+ CH3COOН
+ 9 H2O
![]()
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl
+ K[Sb(OH)6]
![]() Na[Sb(OH)6]
+ KCl
Na[Sb(OH)6]
+ KCl
Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6]
+ HCl
![]() KCl + H3SbO4
+
2 H2O
KCl + H3SbO4
+
2 H2O
H3SbO4
![]() HSbO3
+ H2O
HSbO3
+ H2O
-
Аналитические реакции на бромид-ион.
-
С групповым реагентом - раствором AgNO3 (ГФ).
Методика: к 2-3 каплям раствора бромида, подкисленного HNO3 прибавляют 1-2 капли раствора нитрата серебра. Выпадает желтоватый творожистый осадок, трудно растворимый в водном растворе аммиака, нерастворимый в (NH4)2CO3.
-
С хлорамином Б или хлорной водой (ГФ) (экстракционный способ).
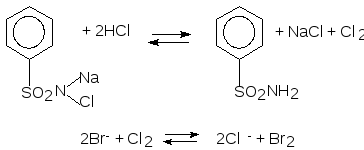
Методика: к 2 каплям раствора, содержащего бромид-ион, прибавляют 2 капли разбавленной HCl, 3-5 капель хлороформа и 3-5 капли хлорамина, взбалтывают. Слой хлороформа окрашивается в жёлто-бурый цвет.
Иодид-ионы должны отсутствовать или их предварительно окисляют до иодноватой кислоты (см. реакции с хлорной водой или KMnO4).
-
Количественный анализ.
-
Аргентометрия.
-
Аргентометрические методы анализа относятся к методам осаждения, которые нашли мировое применение для анализа лекарственных средств. Аргентометрию используют для анализа роданидов, хлоридов, бромидов, йодидов щелочноземельных металлов и органических оснований.
Рабочим раствором является раствор AgNO3 0,1М, а в методе Фольгарда – раствор NH4CNS 0,1М.
Для определения точки эквивалентности в зависимости от ph среды в аргентометрии применяют ряд индикаторов:
K2CrO4 – 5% раствор хромата калия;
NH4Fe(SO4)2 • 12H2O – насыщенный раствор железо – аммонийных квасцов, подкисленный азотной кислотой;
Адсорбционные индикаторы: эозинат натрия, бромфеноловый синий, флуоресцеин;
Свежеприготовленный раствор крахмала;
Нитрозо – крахмальная бумага.
Сущность аргентометрических методов заключается в выделении определяемого вещества в виде трудно растворимых осадков солей серебра:
AgCl, AgBr, AgJ, AgCN, AgCNS
После того, как все ионы галогенов будут осаждены, лишняя капля 0,1М AgNO3, будет взаимодействовать с индикатором с образованием окрашенных осадков или окрашенных растворов в точке эквивалентности.
Протекающие реакции должны удовлетворять следующим условиям:
Осадок должен выпадать быстро и быть практически нерастворимым.
На результаты титрования не должны влиять побочные реакции.
Точка эквивалентности должна легко фиксироваться.
Метод Гей-Люссака
Метод Гей-Люссака – это метод прямого титрования хлоридов и бромидов раствором AgNO3 0,1М без индикатора. Эквивалентная точка наблюдается по прекращению образования осадка и просветлению титруемого раствора.
Примечание.
Этот метод не применим для определения йодидов и радонидов, титрование которых сопровождается образованием коллоидных систем и адсорбцией, что затрудняет установление конечной точки титрования
Метод Мора.
Этот метод заключается в прямом титровании хлоридов и бромидов раствором нитрата серебра в присутствии индикатора хромата калия, с образованием нерастворимых осадков.
Cl- + Ag+ = AgCl Белый
Br- + Ag+ = AgBr желтовато белый
K2CrO4 + Ag+ = Ag2CrO4 Красный
Растворимость хромата серебра Ag2CrO4 значительно больше растворимости хлорида серебра AgCl или бромида серебра AgBr. Поэтому в данных реакциях сначала образуется осадок AgCl или AgBr. После того, как все галогенид – ионы будут практически осаждены, начнется взаимодействие между ионами и ионами Ag+. Как только станет ясно заметна перемена лимонно – желтой окраски в слабо розовую, титрование прекращают. Это говорит о достижении точки эквивалентности. Титрование по методу Мора проводят в нейтральных или слабощелочных растворах при ph от 6,5 до 10.
Метод Фаянса
Метод Фаянса – это метод прямого титрования галогенидов раствором AgNO3 0,1М в слабо кислой среде с применением адсорбционных индикаторов, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка.
Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно. В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора AgNO3 частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции.
В качестве адсорбционных индикаторов применяют:
Бромфеноловый синий, бромкрезеловый синий – в уксуснокислой среде;
Эозинат натрия – в уксуснокислой среде;
Флуоресцеин – в нейтральной и слабо щелочной среде.
Хлориды и бромиды можно титровать с бромфеноловым синим. Точную навеску хлорида или бромида растворяют в воде, прибавляют 2-3 капли индикатора бромфенолового синего, по каплям разведенную уксусную кислоту до зелено-желтого окрашивания и раствор AgNO3 0,1М до синего окрашивания. Можно с этим индикатором оттитровать и йодиды, только вместо синего окрашивания в точке эквивалентности будет зеленое окрашивание.
-
Применение.
Препараты брома обладают способностью концентрировать и усиливать процессы торможения в коре большого мозга, они могут восстанавливать равновесие между процессами возбуждения и торможения, особенно при повышенной возбудимости ЦНС.
В прошлом препараты брома широко применялись в качестве седативных и противосудорожных средств. В настоящее время ими пользуются реже, но своего значения они не потеряли.
Применяют препараты брома при неврастении, неврозах, истерии, повышенной раздражительности, бессоннице начальных формах гипертонической болезни, а также при эпилепсии и хорее.
-
Список литературы.
-
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
-
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
-
Методическое указание «Качественный химический анализ», Пермь, 2003;
-
Методическое указание «Количественный химический анализ», Пермь, 2004;
-
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;
-
«Большая советская энциклопедия».
