
Метод расчета энтропии для обратимых процессов
Энтропия изотермических процессов
Фазовое превращение типа превращения серого олова в белое. Температура этого превращения 286К, т.е. процесс обратим только при постоянной температуре и при постоянном давлении.
Рассмотрим процесс при постоянном давлении.
Энтальпия
![]() .
В дифференциальной форме
.
В дифференциальной форме
![]() Из первого закона термодинамики
Из первого закона термодинамики
![]() .
.
![]() и
и
![]() Интегрируя
при постоянной температуре
Интегрируя
при постоянной температуре


![]() - изменение энтальпии при превращении
- изменение энтальпии при превращении
Метод расчета энтропии для необратимых процессов
Проще всего рассмотреть пример затвердевания переохлажденной жидкости. Это необратимая реакция. После того как жидкость начала затвердевать процесс не остановить бесконечно малым изменением параметра, препятствующего затвердеванию.
![]()
![]()
![]() .
.
Чтобы изменить направление процесса,
необходимо поднять температуру выше
точки плавления, а разность
![]() не является бесконечно малой величиной.
не является бесконечно малой величиной.
Во время необратимого процесса система
в этом случае выделяет теплоту
![]() .
Если резервуар тепловой большой,
выделившееся теплота вызовет бесконечно
малое изменение температуры T1.
.
Если резервуар тепловой большой,
выделившееся теплота вызовет бесконечно
малое изменение температуры T1.
Можно считать, что окружающая среда имеет постоянную температуру T1.
Проведем теперь бесконечно малое изменение параметров резервуара (увеличим T1 на dT). Из-за неодинаковости размеров тепло будет выделяться из резервуара, и это действие может остановить процесс. Изменение энтропии окружающей среды может быть вычислено непосредственно. Вычислить изменение энтропии системы непосредственно нельзя. Но так как энтропия функция состояния, то можно провести системы последовательно через ряд обратимых состояний и достичь конечного результата.
Для рассматриваемой реакции очевидно три степени.
а) температуру жидкости A обратимо изменить от T1 до Tпл .
б) при Tпл имеется возможность обратимо заморозить жидкость.
в) твердое тело A охлаждается обратимо от Tпл до T1.
![]()
![]()
![]()
__________________
![]()
Энтропия рассматриваемой реакции

При необратимом процессе в системе теплота в резервуар может быть перенесена в в изотермический резервуар обратимо.
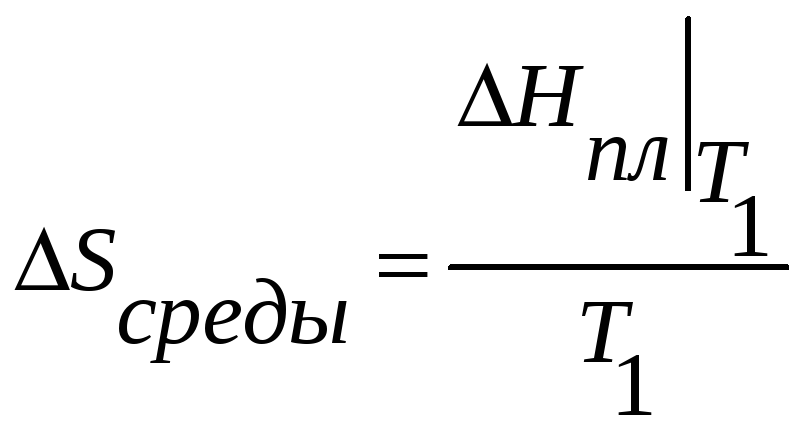
Однако
![]() - не может быть измерена непосредственно.,
но может быть рассчитана, используя
теплоемкости. Используя те же три ступени
реакции имеем изменение энтальпии
- не может быть измерена непосредственно.,
но может быть рассчитана, используя
теплоемкости. Используя те же три ступени
реакции имеем изменение энтальпии
![]()

![]()


Теплоемкость переохлажденной жидкости находят экстраполяцией от высоких температур в область переохлаждения.
Суммарное изменение энтропии и среды оказывается больше нуля.
Это модно обобщить.
Для обратимого процесса
![]() ,
а для самопроизвольного процесса
,
а для самопроизвольного процесса
![]() .
.
Для процесса, который не может протекать
самопроизвольно
![]()
![]() для необратимого процесса. Это формулировка
второго закона термодинамики.
для необратимого процесса. Это формулировка
второго закона термодинамики.
